镉和萘单一及复合胁迫对红树植物白骨壤幼苗生理影响的差异分析
2015-06-24陆志强陈昌徐章耕耘郑文教
陆志强, 陈昌徐, 马 丽, 章耕耘, 郑文教,①
(1. 集美大学水产学院, 福建 厦门 361021; 2. 厦门大学环境与生态学院, 福建 厦门361102;3. 国家海洋局第三海洋研究所, 福建 厦门361005)
镉和萘单一及复合胁迫对红树植物白骨壤幼苗生理影响的差异分析
陆志强1, 陈昌徐2, 马 丽3, 章耕耘1, 郑文教2,①
(1. 集美大学水产学院, 福建 厦门 361021; 2. 厦门大学环境与生态学院, 福建 厦门361102;3. 国家海洋局第三海洋研究所, 福建 厦门361005)
采用砂基培养法,对不同浓度镉(Cd)(0、25和150 mg·L-1)和萘(Nap)(0和10 mg·L-1)单一及复合胁迫45和90 d后红树植物白骨壤〔Avicenniamarina(Forsk.) Vierh.〕的叶片叶绿素含量,根尖和叶片的MDA、AsA和可溶性蛋白质含量及SOD和POD活性,根、茎、子叶和叶片中的Cd含量进行了比较分析。结果表明:胁迫处理45 d 时,Cd-Nap复合胁迫处理组的叶片叶绿素a含量、根尖和叶片的可溶性蛋白质含量及SOD和POD活性大多显著高于相同浓度Cd单一胁迫处理组,叶片叶绿素b含量显著低于后者,Chla/Chlb值显著高于后者。胁迫处理90 d时,与相同浓度Cd单一胁迫处理组相比,Cd-Nap复合胁迫处理组叶片的叶绿素a、叶绿素b和总叶绿素含量以及Chla/Chlb值,根尖和叶片的MDA和AsA含量总体上无显著差异,而根尖和叶片的可溶性蛋白质含量和POD活性及根尖的SOD活性均显著提高。经Cd-Nap复合胁迫处理后白骨壤幼苗的根、茎、子叶和叶片中的Cd含量总体上高于相同浓度Cd单一胁迫处理组,且随胁迫时间延长其差异越来越明显。研究结果显示:在Cd-Nap复合胁迫条件下Cd和Nap具有协同作用,随胁迫时间延长和Cd浓度提高,Cd-Nap复合胁迫对白骨壤幼苗的伤害逐渐增强,并能够促进各器官对Cd的累积。
红树植物; 白骨壤; 镉; 萘; 复合胁迫; 生理指标
红树林是分布于热带和亚热带潮间带中的重要生态系统,在防风护堤、维持沿海生态系统平衡和物种多样性方面具有重要作用[1-2]。白骨壤〔Avicenniamarina(Forsk.) Vierh.〕是中国常见的红树植物之一,为红树林群落的先锋树种和重要树种。由于红树林湿地的环境条件特殊,加之具有生产力高,富含有机碳、硫化物和腐殖质等特性,红树林湿地已经成为陆域和海域环境污染物的主要汇集地[3-5]。
重金属和有机物〔如多环芳烃(polycyclic aromatic hydrocarbons, PAHs)〕污染普遍存在于各种环境介质中,发生重金属污染的地区通常也会受到不同类型有机污染物的侵害[3],镉(Cd)和萘(Nap)分别是重金属污染和多环芳烃污染的典型污染物。虽然Cd并不是植物生长发育的必需元素,但却极易被植物吸收和富集,较低浓度的Cd即会在基因、生化以及生理水平上对植物的新陈代谢产生非常不利的影响[2],使植物生长发育受限,甚至导致植物死亡。PAHs是一类广泛存在于环境中的持久性有毒污染物[6-7],具有较强的致癌、致畸、致突变以及生物蓄积特性[8-9],低分子量PAHs对植物的毒害作用强于高分子量PAHs[10];在16种优控PAHs中,Nap的分子量最低且水溶性较强。因此,Nap不但对植物具有很强的毒害作用,而且还很容易被植物根部吸收,强烈抑制植物生长[11]。
目前,有关重金属或PAHs胁迫对红树植物的影响已有较多研究,但这些研究多为单一污染因子胁迫,而实际上在生态系统中植物接触的污染环境多包含复合污染物,复合污染物的作用机制比较复杂,无法用单一污染物的作用机制进行解释[12],因此,开展重金属和PAHs复合胁迫条件下红树植物生长发育的相关研究,对系统研究复合污染对红树植物的生态效应具有重要意义。
在石油污染、水淹、盐胁迫等逆境条件下,红树植物的生长通常伴随着叶绿素含量、抗氧化酶促系统及非酶促系统等方面的变化[13-16]。鉴于此,作者对Cd和Nap单一及复合胁迫条件下红树植物白骨壤幼苗叶片的叶绿素含量,根尖和叶片的MDA、AsA和可溶性蛋白质含量及SOD和POD活性进行了比较分析,并比较了白骨壤不同部位的Cd含量,以期明确Cd-Nap复合胁迫条件下白骨壤各器官中Cd的累积效应,为科学预测和评价重金属和PAHs复合污染对红树林的生态效应提供科学依据。
1 材料和方法
1.1 材料
成熟白骨壤种苗(成熟胚轴)采自福建省九龙江口红树林自然保护区海门岛的白骨壤林,挑选无病虫害、大小一致且成熟度相近的种苗进行胁迫实验。实验用CdCl2·2.5H2O和Nap均为分析纯级,分别购自国药集团有限公司和美国Sigma-Aldrich公司。
1.2 方法
1.2.1 胁迫及培养方法 实验共设置6个处理组,分别为0 mg·L-1Cd-0 mg·L-1Nap(CK)、0 mg·L-1Cd-10 mg·L-1Nap、25 mg·L-1Cd-0 mg·L-1Nap、25mg·L-1Cd-10mg·L-1Nap、150 mg·L-1Cd-0 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap;采用盐度为15的人工海水以及CdCl2·2.5H2O和Nap固体配制相应浓度的处理液,处理液酸碱度为pH 7~pH 8。
栽培用砂基经清洗及消毒后等量分装于直径30 cm、高15 cm培养盆中,每盆加入1 500 mL上述处理液,使液面刚好没过砂基表面;每盆栽植12~14株苗,每盆视为1次重复,每处理3盆,共40株苗。将幼苗置于自然透光的玻璃温室中培养90 d,昼、夜平均温度分别为24 ℃和16 ℃,昼、夜平均空气相对湿度分别为47%和76%;实验期间每7天更换1次相应浓度的处理液,每天用自来水补足散失的水分。
1.2.2 样品采集及指标测定方法 在胁迫处理的第45天和第90天分别随机选取部分植株,收集每株顶芽下的第2对叶片以及根尖(长度约1 cm),用于叶片的叶绿素含量以及叶片和根尖的MDA、AsA和可溶性蛋白质含量及SOD和POD活性测定;同时,将植株分成根、茎、子叶和叶片4部分,经105 ℃杀青15 min后,置于80 ℃条件下烘干至恒质量,研磨后过100目筛,备用。由于胁迫处理第90 d时150 mg·L-1Cd-0 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap处理组的植株均全部死亡,故未采集相应的样品。
将叶片去中脉后剪碎,称取约100 mg样品,采用混合液法[17]测定叶绿素含量。分别称取约500 mg叶片和根尖,采用硫代巴比妥酸(TBA)显色法[18]测定MDA含量;参考Dutilleul等[19]的方法测定AsA含量;采用考马斯亮蓝法[20]测定可溶性蛋白质含量;采用氮蓝四唑(NBT)还原法[21]测定SOD活性(以抑制50%NBT内反应液在470 nm处吸光值增加0.01为1个酶活性单位)。将根、茎、子叶和叶片的干样经箱式电阻炉干灰化后,用优级纯硝酸溶解灰分并定容,采用PE 9000 电感耦合等离子体质谱仪(ICP-MS,美国PE公司)测定Cd含量。由于采样量的限制,仅对胁迫处理90 d的根尖和叶片样品中的MDA和AsA含量进行了测定。每个指标重复测定3次。
1.3 数据统计及分析
采用SPSS 20.0统计分析软件对各处理组数据间的差异显著性进行LSD-t检验,并对各变量之间的相关性进行Pearson相关性分析。
2 结果和分析
2.1 Cd和Nap单一及复合胁迫对白骨壤幼苗部分生理指标的影响
2.1.1 对叶片中叶绿素含量的影响 Cd和Nap单一及复合胁迫45和90 d后白骨壤幼苗叶片叶绿素含量的变化见表1。


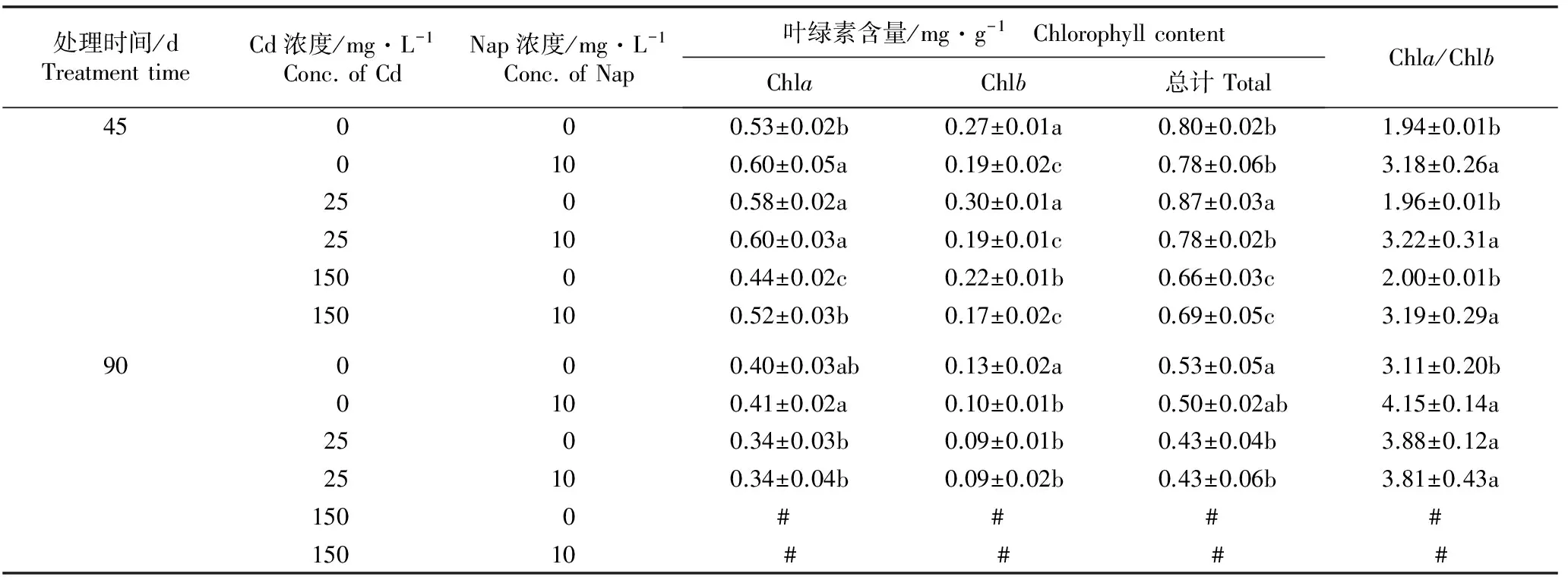
处理时间/dTreatmenttimeCd浓度/mg·L-1Conc.ofCdNap浓度/mg·L-1Conc.ofNap叶绿素含量/mg·g-1 ChlorophyllcontentChlaChlb总计TotalChla/Chlb45000.53±0.02b0.27±0.01a0.80±0.02b1.94±0.01b0100.60±0.05a0.19±0.02c0.78±0.06b3.18±0.26a2500.58±0.02a0.30±0.01a0.87±0.03a1.96±0.01b25100.60±0.03a0.19±0.01c0.78±0.02b3.22±0.31a15000.44±0.02c0.22±0.01b0.66±0.03c2.00±0.01b150100.52±0.03b0.17±0.02c0.69±0.05c3.19±0.29a90000.40±0.03ab0.13±0.02a0.53±0.05a3.11±0.20b0100.41±0.02a0.10±0.01b0.50±0.02ab4.15±0.14a2500.34±0.03b0.09±0.01b0.43±0.04b3.88±0.12a25100.34±0.04b0.09±0.02b0.43±0.06b3.81±0.43a1500 # # # # 15010 # # # #
1)同列中不同的小写字母表示同一处理时间各处理组间差异显著(P<0.05) Different small letters in the same column indicate the significant difference among different treatment groups at the same treatment time (P<0.05). #: 植株死亡 Plant death.
由表1可以看出:胁迫处理45 d,0 mg·L-1Cd-10 mg·L-1Nap处理组幼苗的叶绿素a含量显著高于对照(0 mg·L-1Cd-0 mg·L-1Nap)(P<0.05),而叶绿素b含量则显著低于对照,但它们的总叶绿素含量差异不显著。Cd和Nap复合胁迫处理组幼苗的叶绿素a含量均高于相同浓度Cd单一胁迫处理组,而其叶绿素b含量均低于相同浓度Cd单一胁迫处理组,如150 mg·L-1Cd-10 mg·L-1Nap处理组的叶绿素a含量显著高于150 mg·L-1Cd-0 mg·L-1Nap处理组,而叶绿素b含量则显著低于150 mg·L-1Cd-0 mg·L-1Nap处理组。25 mg·L-1Cd-10 mg·L-1Nap处理组的总叶绿素含量显著低于25 mg·L-1Cd-0 mg·L-1Nap处理组,150 mg·L-1Cd-10 mg·L-1Nap处理组与150 mg·L-1Cd-0 mg·L-1Nap处理组间的总叶绿素含量差异不显著(P>0.05)。此外,对Chla/Chlb值的分析结果显示:Cd单一胁迫处理组的Chla/Chlb值与对照接近,而Cd-Nap复合胁迫处理组的Chla/Chlb值则与Nap单一胁迫处理组接近,且Cd-Nap复合胁迫处理组的Chla/Chlb值均显著高于相同浓度Cd单一胁迫处理组。总体上看,150 mg·L-1Cd单一或复合胁迫处理组的叶绿素a、叶绿素b和总叶绿素含量均低于对照且大多差异显著。
由表1还可以看出:胁迫处理90 d,0 mg·L-1Cd-10 mg·L-1Nap处理组叶绿素a含量略高于对照且差异不显著,叶绿素b含量显著低于对照,总叶绿素含量略低于对照且差异不显著,Chla/Chlb值显著高于对照;而25 mg·L-1Cd-10 mg·L-1Nap处理组与25 mg·L-1Cd-0 mg·L-1Nap处理组的叶绿素a、叶绿素b及总叶绿素含量一致且均低于对照,前者的Chla/Chlb值略低于后者且差异不显著,但二者的Chla/Chlb值均显著高于对照。总体上看,随胁迫时间延长,白骨壤幼苗叶片中的叶绿素a、叶绿素b和总叶绿素含量均明显下降,但Chla/Chlb值却明显升高。
2.1.2 对根尖和叶片中MDA和AsA含量的影响Cd和Nap单一及复合胁迫90 d后白骨壤幼苗根尖和叶片中MDA和AsA含量的变化见表2。
由表2可见:胁迫处理90 d, 25 mg·L-1Cd-10 mg·L-1Nap处理组幼苗根尖和叶片的MDA含量与25 mg·L-1Cd-0 mg·L-1Nap处理组无显著差异(P>0.05),但却显著低于0 mg·L-1Cd-10 mg·L-1Nap处理组(P<0.05);25 mg·L-1Cd-10 mg·L-1Nap处理组根尖和叶片的AsA含量与25 mg·L-1Cd-0 mg·L-1Nap处理组间也无显著差异,但与0 mg·L-1Cd-10 mg·L-1Nap处理组差异显著(P<0.05),其中,根尖AsA含量较后者降低58.6%,叶片中AsA含量则升高6.5%。总体上看,10 mg·L-1Nap单一处理组的根尖和叶片的MDA和AsA含量均显著高于对照,而25 mg·L-1Cd单一胁迫处理组及25 mg·L-1Cd-10 mg·L-1Nap复合胁迫处理组的根尖MDA含量与对照无显著差异,但叶片的MDA含量显著低于对照,根尖和叶片的AsA含量均显著高于对照。



Cd浓度/mg·L-1Conc.ofCdNap浓度/mg·L-1Conc.ofNap不同部位MDA含量/nmol·g-1MDAcontentindifferentparts根尖Roottip叶片Leaf不同部位AsA含量/mg·g-1AsAcontentindifferentparts根尖Roottip叶片Leaf000.85±0.23b2.95±0.24b0.34±0.02c0.89±0.02c0104.86±0.32a3.52±0.10a1.33±0.05a0.93±0.01b2500.36±0.17b2.30±0.24c0.55±0.03b0.98±0.01ab25101.16±0.84b2.30±0.17c0.55±0.01b0.99±0.00a1500 # # # # 15010 # # # #
1)同列中不同的小写字母表示各处理组间差异显著(P<0.05) Different small letters in the same column indicate the significant difference among different treatment groups (P<0.05). #: 植株死亡 Plant death.
2.1.3 对根尖和叶片中可溶性蛋白质含量的影响Cd和Nap单一及复合胁迫45和90 d后白骨壤幼苗根尖和叶片中可溶性蛋白质含量的变化见表3。
由表3可以看出:胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap处理组的根尖和叶片中可溶性蛋白质含量均高于相同浓度的Cd单一胁迫处理组,其中,150 mg·L-1Cd-10 mg·L-1Nap处理组的根尖和叶片中可溶性蛋白质含量均显著高于150 mg·L-1Cd-0 mg·L-1处理组(P<0.05),分别较后者提高40.8%和15.7%。此外,10 mg·L-1Nap单一胁迫处理组的叶片可溶性蛋白质含量高于其他处理组,其根尖可溶性蛋白质含量也较高。总体上看,各处理组的根尖可溶性蛋白质含量均高于对照,而除150 mg·L-1Cd单一胁迫处理组外,其他处理组的叶片可溶性蛋白质含量也均高于对照。
由表3还可以看出:胁迫处理90 d,25 mg·L-1-10 mg·L-1Nap处理组根尖和叶片的可溶性蛋白质含量基本上均显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组,其根尖和叶片的可溶性蛋白质含量分别较25 mg·L-1Cd-0 mg·L-1Nap处理组提高19.5%和7.7%。总体上看,各处理组的叶片可溶性蛋白质含量均高于对照;除10 mg·L-1Nap单一胁迫处理组外,其他处理组的根尖可溶性蛋白质含量也均高于对照。



处理时间/dTreatmenttime浓度/mg·L-1ConcentrationCdNap不同部位可溶性蛋白质含量/mg·g-1Solubleproteincontentindifferentparts根尖Roottip叶片Leaf45002.00±0.17d12.52±0.20b0104.02±0.24b14.55±1.00a2503.32±0.18c13.90±0.16a25103.73±0.26bc14.42±0.54a15003.55±0.25bc12.10±0.77b150105.00±0.44a14.00±0.39a90003.30±0.09bc12.25±0.17b0102.95±0.11c12.77±0.39ab2503.43±0.46b12.26±0.11b25104.10±0.05a13.20±0.47a1500# #15010# #
1)同列中不同的小写字母表示同一处理时间各处理组间差异显著(P<0.05) Different small letters in the same column indicate the significant difference among different treatment groups at the same treatment time (P<0.05). #: 植株死亡 Plant death.
随胁迫时间延长,白骨壤幼苗根尖中的可溶性蛋白质含量均小幅增加,但叶片中的可溶性蛋白质含量却下降。
2.1.4 对根尖和叶片中SOD和POD活性的影响Cd和Nap单一及复合胁迫45和90 d后白骨壤幼苗根尖和叶片中SOD和POD活性的变化见表4。
由表4可以看出:胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap处理组根尖和叶片的SOD活性均显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组(P<0.05);150 mg·L-1Cd-10 mg·L-1Nap处理组根尖的SOD活性显著高于150 mg·L-1Cd-0 mg·L-1Nap处理组,而其叶片的SOD活性仅略高于后者且二者间差异不显著(P>0.05)。胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组根尖的SOD活性仍显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组,但其叶片的SOD活性却显著低于25 mg·L-1Cd-0 mg·L-1Nap处理组。总体上看,多数处理组根尖和叶片的SOD活性高于对照。
由表4还可以看出:胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap处理组根尖的POD活性显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组,而其叶片的POD活性则仅略高于25 mg·L-1Cd-0 mg·L-1Nap处理组且二者之间无显著差异;150 mg·L-1Cd-10 mg·L-1Nap处理组根尖和叶片的POD活性均显著高于150 mg·L-1Cd-0 mg·L-1Nap处理组。胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组根尖和叶片的POD活性均显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组。与对照相比,绝大多数处理组根尖和叶片的POD活性均高于对照。


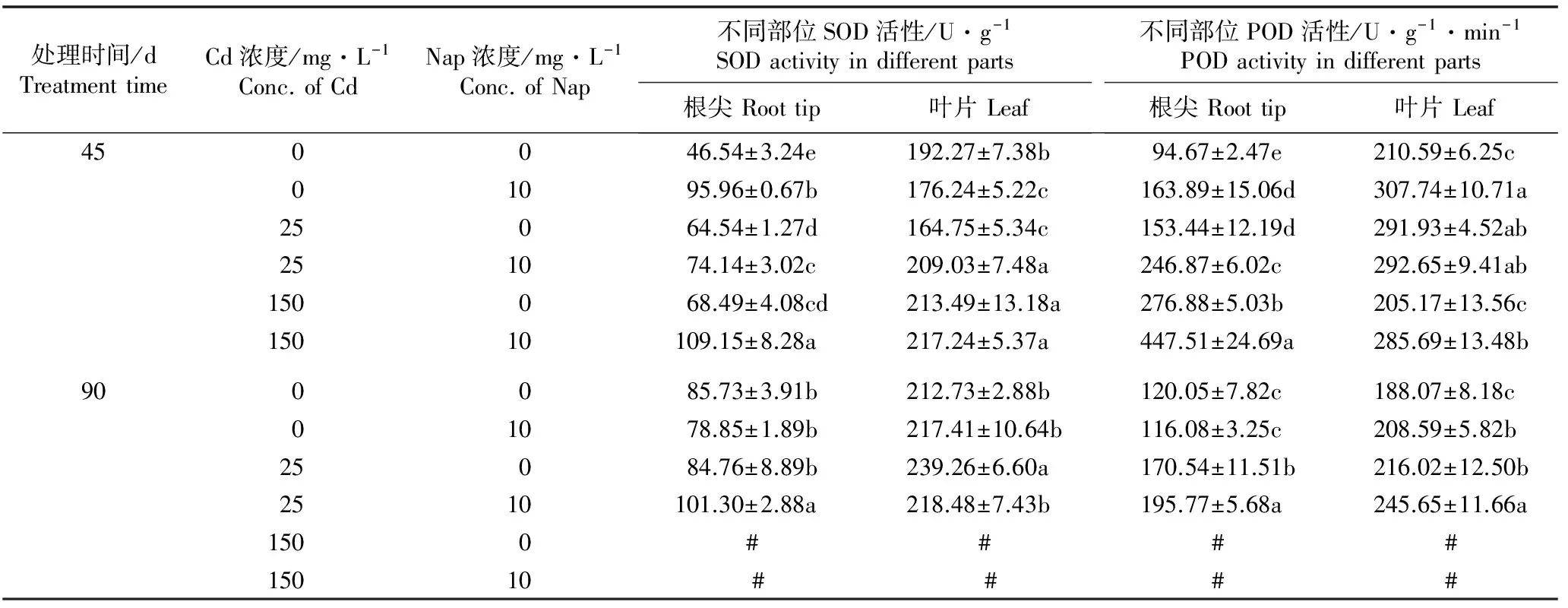
处理时间/dTreatmenttimeCd浓度/mg·L-1Conc.ofCdNap浓度/mg·L-1Conc.ofNap不同部位SOD活性/U·g-1SODactivityindifferentparts根尖Roottip叶片Leaf不同部位POD活性/U·g-1·min-1PODactivityindifferentparts根尖Roottip叶片Leaf450046.54±3.24e192.27±7.38b94.67±2.47e210.59±6.25c01095.96±0.67b176.24±5.22c163.89±15.06d307.74±10.71a25064.54±1.27d164.75±5.34c153.44±12.19d291.93±4.52ab251074.14±3.02c209.03±7.48a246.87±6.02c292.65±9.41ab150068.49±4.08cd213.49±13.18a276.88±5.03b205.17±13.56c15010109.15±8.28a217.24±5.37a447.51±24.69a285.69±13.48b900085.73±3.91b212.73±2.88b120.05±7.82c188.07±8.18c01078.85±1.89b217.41±10.64b116.08±3.25c208.59±5.82b25084.76±8.89b239.26±6.60a170.54±11.51b216.02±12.50b2510101.30±2.88a218.48±7.43b195.77±5.68a245.65±11.66a1500 # # ##15010 # # # #
1)同列中不同的小写字母表示同一处理时间各处理组间差异显著(P<0.05) Different small letters in the same column indicate the significant difference among different treatment groups at the same treatment time (P<0.05). #: 植株死亡 Plant death.
随胁迫时间延长,白骨壤幼苗根尖和叶片的SOD活性总体上升高,而根尖和叶片的POD活性则总体上降低。
2.2 Cd和Nap单一及复合胁迫对白骨壤幼苗根尖和叶片中Cd含量的影响
经不同浓度Cd和Nap单一及复合胁迫45和90 d后白骨壤幼苗不同器官(包括根、茎、子叶和叶片)中的Cd含量见表5。
由表5可见:胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap处理组根中的Cd含量均显著高于相同浓度Cd单一胁迫处理组(P<0.05),其中,25 mg·L-1Cd-10 mg·L-1Nap处理组根中Cd含量较25 mg·L-1Cd单一胁迫处理组增加157.9%,而150 mg·L-1Cd-10 mg·L-1Nap处理组根中Cd含量仅比150 mg·L-1Cd单一胁迫处理组增加18.4%。胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组根中的Cd含量显著高于25 mg·L-1Cd单一胁迫处理组,增幅为7.8%。
胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap处理组茎中的Cd含量均高于相同浓度Cd单一胁迫胁迫处理组,分别提高37.2%和27.6%。胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组茎中的Cd含量显著高于25 mg·L-1Cd单一胁迫处理组,增幅为77.4%。
胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap处理组子叶中的Cd含量显著高于25 mg·L-1Cd单一胁迫处理组,增幅为93.6%;而150 mg·L-1Cd-10 mg·L-1Nap处理组子叶中的Cd含量较150 mg·L-1Cd单一胁迫处理组显著降低,降幅为14.2%。胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组子叶中的Cd含量显著高于25 mg·L-1Cd单一胁迫处理组,增幅达189.0%。
胁迫处理45 d,25 mg·L-1Cd-10 mg·L-1Nap和150 mg·L-1Cd-10 mg·L-1Nap处理组叶片中的Cd含量仅略高于相同浓度Cd单一胁迫处理组;胁迫处理90 d,25 mg·L-1Cd-10 mg·L-1Nap处理组叶片中的Cd含量显著高于25 mg·L-1Cd-0 mg·L-1Nap处理组,增幅为109.6%。
随胁迫时间延长,白骨壤幼苗根、茎、子叶和叶片中的Cd含量总体上均明显增加。



处理时间/dTreatmenttimeCd浓度/mg·L-1Conc.ofCdNap浓度/mg·L-1Conc.ofNap不同器官中的Cd含量/μg·g-1 Cdcontentindifferentorgans根Root茎Stem子叶Cotyledon叶Leaf4500-- - - 010----25027.22±4.61d3.82±0.20b1.57±0.09d0.95±0.13b251070.19±18.61c5.24±1.33b3.04±0.38c0.98±0.22b1500109.41±5.35b17.21±0.23a8.80±0.45a1.80±0.13a15010129.53±5.43a21.96±5.04a7.55±0.61b2.07±0.40a9000-- - - 010----25091.10±2.97b3.37±0.26b10.44±2.43b2)6.53±0.99b251098.21±4.12a5.98±0.61a30.17±5.76a2)13.69±0.90a1500## # # 15010####
1)同列中不同的小写字母表示同一处理时间各处理组间差异显著(P<0.05) Different small letters in the same column indicate the significant difference among different treatment groups at the same treatment time (P<0.05). -: 未检出 Undetected; #: 植株死亡 Plant death.
2)供试样品为凋落的子叶 The sample tested is withered cotyledon.
3 讨论和结论
相关研究结果[23-24]表明:多环芳烃能够诱导植物分泌脱落酸(ABA),从而导致叶片中的叶绿素含量下降。由本实验结果可以看出:与对照(0 mg·L-1Cd-0 mg·L-1Nap)相比,在整个实验过程中Nap单一胁迫均能够导致白骨壤幼苗叶片中的叶绿素a含量提高、叶绿素b含量降低,总体表现为总叶绿素含量小幅下降但Chla/Chlb值显著升高,这一研究结果与孙成芬等[25]和Tomar等[26]的相关研究结果相似,而Chla/Chlb值升高说明与PSⅡ光化学反应效率相关的光捕获量降低[26-27]。
在受到重金属胁迫后,植物细胞会产生植物络合素(PC)等重金属结合多肽或蛋白,用于络合进入细胞中的重金属元素,从而降低重金属对植物体的伤害[29],而可溶性蛋白质含量为衡量重金属胁迫的常用指标之一。与相同浓度Cd单一胁迫相比,在Cd和Nap复合胁迫条件下白骨壤根尖和叶片可溶性蛋白质含量的增幅更大,且这种作用随Cd胁迫浓度升高和胁迫时间延长而增强,这一现象是否与重金属胁迫条件下植物细胞产生植物络合素(PC)等重金属结合多肽或蛋白有关,尚待深入研究。
与Cd单一胁迫相比,经Cd和Nap复合胁迫后白骨壤幼苗根尖的SOD和POD活性均显著升高,多数处理组的叶片SOD和POD活性也有所升高;其中,叶片SOD活性的增幅随Cd胁迫浓度升高和胁迫时间延长而减小,叶片POD活性的增幅则随Cd胁迫浓度升高和胁迫时间延长而增大。由于胁迫条件下白骨壤叶片的受害程度比根部更严重(另文发表),推测Cd和Nap复合胁迫条件下,随胁迫浓度的升高和胁迫时间的延长,白骨壤植株受到的过氧化伤害逐渐加重,导致叶片中SOD酶的基因表达受到抑制,从而使叶片的SOD活性增幅下降,而叶片POD活性增幅增大可能与白骨壤叶片启动POD有效防御过氧化伤害的阈值较高有关[5]。
与Cd单一胁迫相比,Cd和芘(Pyr)复合胁迫能够显著提高秋茄树(KandeliaobovataSheue, H. Y. Liu et J. Yong)根部的Cd含量[3];低浓度的Cd和PAHs复合胁迫也能够促使灯芯草属(JuncusLinn.) 植物J.subsecundusN.A. Wakef.各器官累积更多的Cd元素[30]。本研究中,在Cd和Nap复合胁迫条件下白骨壤各器官中的Cd含量基本上都高于相同浓度Cd单一胁迫处理组,且胁迫时间越长、Cd含量越高,说明Nap能够提高白骨壤幼苗根、茎、子叶及叶片对Cd的累积能力且这种效应随时间延长而增强。Wang等[3]认为,PAHs能抑制植物根尖质外体屏障的形成,导致根尖质粒体和质外体中Cd浓度上升,从而使植物对Cd的吸收量增加。然而,作者对秋茄树[31]的相关研究结果表明Nap能够增加植物的细胞膜透性,据此推测在Cd和Nap复合胁迫条件下,由于Nap不需要任何载体就能够直接渗透进入根部细胞中并使根部细胞膜透性增大,致使Cd能大量进入细胞中[32],由此导致白骨壤各器官中Cd的含量上升。但Cd和Nap复合胁迫的具体作用机制尚待进一步深入研究。
[1] 林 鹏. 红树林[M]. 北京: 海洋出版社, 1984: 297-316.
[2] XIEX, WEISSDJ,WENGB,etal. The short-term effect of cadmium on low molecular weight organic acid and amino acid exudation from mangrove (Kandeliaobovata(S., L.) Yong) roots[J]. Environmental Science and Pollution Research International, 2013, 20(2): 997-1008.
[3] WANG W Y, ZHANG X F, HUANG J, et al. Interactive effects of cadmium and pyrene on contaminant removal from co-contaminated sediment planted with mangroveKandeliaobovata(S., L.) Yong seedlings[J]. Marine Pollution Bulletin, 2014, 84(1/2): 306-313.
[4] LUZQ, ZHENGWJ,MAL. Bioconcentration of polycyclic aromatic hydrocarbons in roots of three mangrove species in Jiulong River Estuary[J]. Journal of Environmental Sciences, 2005, 17(2): 285-289.
[5] 孙 娟, 郑文教, 赵 胡. 萘胁迫对白骨壤种苗萌生及抗氧化作用的影响[J]. 厦门大学学报: 自然科学版, 2005, 44(3): 433-436.
[6] CHRISTENSEN E R, ARORA S. Source apportionment of PAHs in sediments using factor analysis by time records: application to Lake Michigan, USA[J]. Water Research, 2007, 41(1): 168-176.
[7] TSANG H L, WU S, LEUNG C K M, et al. Body burden of POPs of Hong Kong residents, based on human milk, maternal and cord serum[J]. Environment International, 2011, 37(1): 142-151.
[9] KWON H O, CHOI S D. Polycyclic aromatic hydrocarbons (PAHs) in soils from a multi-industrial city, South Korea[J]. The Science of the Total Environment, 2014, 470/471: 1494-1501.
[10] HENNER P, SCHIAVON M, DRUELLE V, et al. Phytotoxicity of ancient gaswork soils: effect of polycyclic aromatic hydrocarbons (PAHs) on plant germination[J]. Organic Geochemistry, 1999, 30(8): 963-969.
[11] KIPOPOULOU A M, MANOLI E, SAMARA C. Bioconcentration of polycyclic aromatic hydrocarbons in vegetables grown in an industrial area[J]. Environmental Pollution, 1999, 106(3): 369-380.
[12] 徐 胜, 王 慧, 陈 玮, 等. 土壤中多环芳烃污染对植物生理生态的影响[J]. 应用生态学报, 2013, 24(5): 1284-1290.
[13] 王雪峰, 陈桂珠, 许夏玲. 白骨壤对石油污染的生理生态响应[J]. 生态学报, 2005, 25(5): 1095-1100.
[14] 何斌源, 赖廷和, 陈剑锋, 等. 两种红树植物白骨壤(Avicenniamarina)和桐花树(Aegicerascorniculatum)的耐淹性[J]. 生态学报, 2007, 27(3): 1130-1138.
[15] 廖 岩, 陈桂珠. 三种红树植物对盐胁迫的生理适应[J]. 生态学报, 2007, 27(6): 2208-2214.
[16] YANZ, TAMNFY.Differencesinlead tolerance betweenKandeliaobovataandAcanthusilicifoliusseedlings under varying treatment times[J]. Aquatic Toxicology, 2013, 126: 154-162.
[17] 张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社, 2004: 67-70.
[18] HODGES D M, DeLONG J M, FORNEY C F, et al. Improving the thiobarbituric acid-reactive-substances assay for estimating lipid peroxidation in plant tissues containing anthocyanin and other interfering compounds[J]. Planta, 1999, 207(4): 604-611.
[19] DUTILLEUL C, GARMIER M, NOCTOR G, et al. Leaf mitochon-dria modulate whole cell redox homeostasis, set antioxidant capacity, and determine stress resistance through altered signaling and diurnal regulation[J]. The Plant Cell, 2003, 15(5): 1212-1226.
[20] BRADFORD M M. A rapid and sensitive method for the quantita-tion of microgram quantities of protein utilizing the principle of protein-dyebinding[J]. AnalyticalBiochemistry,1976,72(1/2): 248-254.
[21] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000: 167-169.
[22] 陈 坚, 李妮亚, 刘 强, 等. NaCl处理下两种引进红树的光合及抗氧化防御能力[J]. 植物生态学报, 2013, 37(5): 443-453.
[23] AHAMMED G J, YUAN H L, OGWENO J O, et al. Brassino-steroid alleviates phenanthrene and pyrene phytotoxicity by increasing detoxification activity and photosynthesis in tomato[J]. Chemosphere, 2012, 86(5): 546-555.
[25] 孙成芬, 马 丽, 盛连喜, 等. 土壤萘污染对玉米苗期生长和生理的影响[J]. 农业环境科学学报, 2009, 28(3): 443-448.
[26] TOMARRS, JAJOOA.Fluoranthene,a polycyclicaromatic hydrocarbon, inhibits light as well as dark reactions of photosynthesis in wheat (Triticumaestivum)[J]. Ecotoxicology and Environmental Safety, 2014, 109: 110-115.
[27] DEMMIG-ADAMS B, ADAMS W W Ⅲ. Chlorophyll and carotenoid composition in leaves ofEuonymuskiautschovicusacclimated to different degrees of light stress in the field[J]. Australian Journal of Plant Physiology, 1996, 23(5): 649-659.
[28] SUN L, YAN X L, LIAO X Y, et al. Interactions of arsenic and phenanthrene on their uptake and antioxidative response inPterisvittataL.[J]. Environmental Pollution, 2011, 159(12): 3398-3405.
[29] 冯保民, 麻 密. 植物络合素及其合酶在重金属抗性中的功能研究进展[J]. 应用与环境生物学报, 2003, 9(6): 657-661.
[30] ZHANG Z H, RENGEL Z, MENEY K, et al. Polynuclear aromatic hydrocarbons (PAHs) mediate cadmium toxicity to an emergent wetland species[J]. Journal of Hazardous Materials, 2011, 189(1/2): 119-126.
[31] 陆志强, 郑文教, 马 丽. 萘和芘胁迫对红树植物秋茄幼苗膜透性及抗氧化酶活性的影响[J]. 厦门大学学报: 自然科学版, 2008, 47(5): 757-760.
[32] ALKIO M, TABUCHI T M, WANG X C, et al. Stress responses to polycyclic aromatic hydrocarbons inArabidopsisinclude growth inhibition and hypersensitive response-like symptoms[J]. Journal of Experimental Botany, 2005, 56(421): 2983-2994.
(责任编辑: 佟金凤)
Difference analysis on effects of single and combination stresses of Cd and Nap on physiology of mangroveAvicenniamarinaseedlings
LU Zhiqiang1, CHEN Changxu2, MA Li3, ZHANG Gengyun1, ZHENG Wenjiao2,①
(1. Fisheries College, Jimei University, Xiamen 361021, China; 2. College of Environment and Ecology, Xiamen University, Xiamen 361102, China; 3. The Third Institute of Oceanography, State Oceanic Administration, Xiamen 361005, China),J.PlantResour. &Environ., 2015, 24(3): 60-67
Chlorophyll content in leaf, MDA, AsA, soluble protein contents and SOD and POD activities in root tip and stem, Cd content in root, stem, cotyledon and leaf of mangroveAvicenniamarina(Forsk.) Vierh. of different treatment groups after single and combination stressed for 45 and 90 d with different concentrations of cadmium (Cd) (including 0, 25 and 150 mg·L-1)and naphthalene (Nap) (including 0 and 10 mg·L-1) were comparatively analyzed by sand culture method. The results show that when stressed for 45 d, Chlacontent in leaf, soluble protein content and SOD and POD activities in root tip and leaf of Cd-Nap combination stress treatment group are mostly significantly higher than those of single stress treatment group with the same concentration of Cd, Chlbcontent in leaf is significantly lower than that of the latter, and Chla/Chlbratio is significantly higher than that of the latter. When stressed for 90 d, compared with single stress treatment group with the same concentration of Cd, there are generally no significant differences in Chla, Chlband total chlorophyll contents and Chla/Chlbratio of leaf, MDA and AsA contents in root tip and leaf of Cd-Nap combination stress treatment group, while soluble protein content and POD activity in root tip and leaf and SOD activity in root tip are all increased significantly. After treated by Cd-Nap combination stress, Cd content in root, stem, cotyledon and leaf ofA.marinaseedlings is generally higher than that of single stress treatment group with the same concentration of Cd, and their differences are more and more obvious with prolonging of stress time. It is suggested that under condition of Cd-Nap combination stress, Cd and Nap have a synergistic effect, with prolonging of stress time and increasing of Cd concentration, damage of Cd-Nap combination stress toA.marinaseedlings enhances gradually and Cd-Nap combination stress can promote the accumulation of Cd in different organs.
mangrove;Avicenniamarina(Forsk.) Vierh.; Cd; Nap; combination stress; physiological index
2015-01-20
福建省自然科学基金资助项目(2010J05098); 国家海洋局海洋环境保护司2013年业务性科研课题(HD130701)
陆志强(1977—),男,安徽池州人,博士,副教授,主要从事环境生态学方面的研究。
①通信作者 E-mail: zhengwenjiao2008@sina.com
Q945.78; S793.9; X53
A
1674-7895(2015)03-0060-08
10.3969/j.issn.1674-7895.2015.03.08
