注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗幼年特发性关节炎32例*
2015-06-15丁艳尹薇刘凡曾小燕谢彤
丁艳,尹薇,刘凡,曾小燕,谢彤
(武汉市儿童医院风湿免疫科,武汉 430016)
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗幼年特发性关节炎32例*
丁艳,尹薇,刘凡,曾小燕,谢彤
(武汉市儿童医院风湿免疫科,武汉 430016)
目的 研究注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗幼年特发性关节炎(JIA)的临床疗效。方法 52例非全身型JIA患儿随机分为治疗组32例和对照组20例。治疗组皮下注射注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,每次0.4 mg·kg-1,每周2次,共3个月,后减为每周0.4 mg·kg-1,总疗程6个月,允许合并使用非甾体类抗炎药和甲氨蝶呤,对照组口服甲氨蝶呤,允许合并使用非甾体类抗炎药。在治疗后1,3,6个月采用ACR Pedi 30/50/70评分进行疗效评估,并比较治疗前后的放射学改变,同时记录不良反应。结果 治疗组治疗后1,3,6个月ACR Pedi 30达标率分别为87.50%,93.75%,100.00%,ACR Pedi 50达标率分别为31.25%,65.63%,96.88%,ACR Pedi 70达标率分别为18.75%,34.38%,87.50%。治疗组治疗后1个月ACR Pedi 30,治疗后3,6个月ACR Pedi 30,50,70达标率均显著高于对照组(P<0.05)。治疗组治疗后1,3,6个月的C-反应蛋白(CRP)、血沉(ESR)均较治疗前明显降低(P<0.05),治疗后6个月的Poznanski值较治疗前明显改善(P<0.05)。治疗后1,3个月治疗组的CRP、ESR较对照组明显降低(P<0.05),治疗后6个月治疗组的CRP较对照组明显降低(P<0.05),放射学改变较对照组轻(P<0.05)。结论 注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合传统药物治疗非全身型JIA具有良好的安全性和有效性,与单纯使用传统药物相比,临床疗效优于传统治疗,能更快、更有效地降低炎性指标,并能减轻放射学改变。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白;关节炎,特发性/幼年;生物制剂
幼年特发性关节炎(juvenile idiopathic arthritis,JIA)是一组原因不明的发生于16岁以下、症状持续6周以上、并排除其他原因的关节炎患儿,是儿童时期最常见的慢性类风湿性疾病[1],也是导致小儿近期及远期残疾的重要原因之一,可能严重影响小儿甚至成年期生活质量。目前对JIA的治疗包括非甾体类抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)、皮质激素和缓解病情抗风湿药物(disease-modifying antirheumatic drugs,DMARDs)。甲氨蝶呤(methotrexate,MTX)是最常用的DMARD药物。然而,这些药物只对部分JIA患儿有较好疗效。近年来,生物制剂重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白已成为对MTX治疗疗效不佳或不能耐受的多关节型JIA患儿的首选药物[2-6]。重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白是目前唯一被批准用于 MTX 疗效不佳或不能耐受的4~17岁的儿童或青少年活动性多关节型JIA患儿的药物,其有效性和安全性已得到证实[7-8]。但目前在国内,重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白在成人风湿病包括类风湿关节炎(rheumatoid arthritis,RA)、强直性脊柱炎(ankylosing spondylitis,AS)等疾病中的应用日益广泛[9],但在JIA中应用的研究报道相对较少,且多为非对照、小样本的临床观察[10-11],缺乏前瞻性的对照研究及对放射学损害的评估。因此,2010年1月—2012年12月,笔者采用前瞻性的对照研究来进一步探讨注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗JIA的安全性、有效性及放射学改变的效应。
1 资料与方法
1.1 临床资料 采用前瞻性、随机、对照、开放研究。武汉市儿童医院住院的初治或难治的活动性非全身型JIA患儿共52例,诊断符合国际风湿病学联盟2001年在Edmonton制定的诊断和分类标准[12]。其中男21例,女31例,年龄1.2~15.8岁,平均年龄(7.1±3.7)岁;病程1.5~96个月,平均(11.9±19.1)个月;临床分型为多关节型、少关节型、与附着点炎症相关的关节炎(ERA);随机纳入治疗组32例和对照组20例。患儿符合以下条件之一:①经传统的标准治疗后反应不佳或不能耐受传统治疗;②病情处于活动期,活动期须具备:有≥5个关节肿胀,且有≥3个关节活动受限伴或不伴关节疼痛/压痛;③有预后不良因素的患儿:颈椎受累、髋关节炎、类风湿因子或抗环瓜氨酸多肽抗体阳性、影像学损害(骨侵蚀或关节腔狭窄)。排除条件:①有败血症或败血症风险;②伴有严重感染性疾病,包括但不限于活动性结核病、潜伏性结核感染、活动性病毒性肝炎等;③既往有脱髓鞘综合征病史或多发性硬化症病史;④充血性心力衰竭;⑤恶性肿瘤或癌前病变;⑥原发免疫缺陷病或严重继发性免疫缺陷病未纠正;⑦对药物成分产生变态反应。治疗组中多关节型20例,ERA3例,少关节型9例,平均年龄(7.2±3.7)岁;对照组中多关节型11例,ERA2例,少关节型7例,平均年龄(6.9±3.8)岁。两组患儿治疗前的C反应蛋白(C-reactive protein,CRP)、红细胞沉降率(erythrocyte sedimentation,ESR)、放射学损害差异无统计学意义(P>0.05),具有可比性。所有研究程序均遵循武汉市儿童医院医学伦理委员会所制定的伦理学标准并得到该委员会的批准,在充分告知药物的相关不良反应后均取得受试对象家属的知情同意,并签署药物治疗知情同意书。
1.2 给药方法 治疗组给予注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(商品名:益赛普,上海中信国健药业有限公司,批准文号:国药准字S20050058,规格:每支12.5 mg),每次0.4 mg·kg-1,皮下注射,每周2次,共3个月,后减为每周1次,3个月,总疗程6个月,所有病例均允许同时合并使用NSAID(常用萘普生)和MTX。对照组每周给予MTX 10~15 mg·(m2)-1,同时联合使用萘普生。分别在基线和1,3及6个月进行随访。随时观察记录用药期间的不良反应,并定期检测血常规、肝肾功能、自身抗体、结核菌素试验、胸部X线片等。
1.3 疗效评估 采用国际通用的JIA核心评估参数(即儿科用ACR疗效标准ACR Pedi 30/50/70)[13]进行评分,它包括6个项目,即医师对疾病的总体评估、患儿或患儿父母对病情的总体评估、儿童健康评估问卷(CHAQ)、活动性炎性关节计数、活动受限关节计数、ESR或CRP。治疗改善的定义:与治疗前比较,6项核心指标中至少3项有≥30%的改善,而且其余的任一指标均不能有超过30%的加重(此即ACR Pedi 30疗效)。
1.4 放射学损害评估 对有腕关节损害的27例多关节型患儿(治疗组18例,对照组9例)进行放射学损害评估。放射学关节损害评分根据文献报道的方法进行[14-15],由两名不知道相关临床数据的放射科医师各自独立进行,根据测量掌骨的放射学长度(RM)和第2掌骨的长度(M2)按POZNANSKI等[15]报道公式来计算。RM/M2比值,即为Poznanski值,反映腕部的放射学损害情况。Poznanski值负值越多,放射学损害就越严重。第6个月的放射学进展通过计算6个月时和基线之间的Poznanski值改变来确定。正值表明有改善,而负值则表明恶化。将2人各自的测量值进行平均,取平均值进行分析,每例患儿的Poznanski值以2个腕关节的平均值来表示。

2 结果
2.1 疗效评估 两组患儿治疗1,3,6个月ACR Pedi 30,50,70达标率比较见表1。结果显示,治疗组治疗1个月ACR Pedi 30,治疗3,6个月ACR Pedi 30,50,70达标率均显著高于对照组(P<0.05或P<0.01)。
2.2 炎性指标及放射学改变情况 治疗前两组间CRP、ESR和Poznanski值差异无统计学意义(P>0.05)。治疗后1,3,6个月治疗组的CRP均较对照组明显降低(P<0.05)。治疗后1,3个月治疗组ESR较对照组明显降低(P<0.05),治疗后6个月两组间ESR差异无统计学意义(P>0.05)。治疗后6个月两组间Poznanski值差异有统计学意义(P<0.05)。见表2。治疗组治疗后1,3,6个月的CRP、ESR均较治疗前明显降低(P<0.05)。对照组治疗后1,3个月的CRP、ESR较治疗前降低,但差异无统计学意义(P>0.05),治疗后6个月的CRP、ESR较治疗前明显降低,差异有统计学意义(P<0.05)。治疗组治疗后6个月的Poznanski值较治疗前明显改善(P<0.05),对照组亦较治疗前有所改善,但差异无统计学意义(P>0.05)。见表2。

表1 两组患儿治疗后ACR Pedi 30,50,70达标率比较%
2.3 不良事件发生情况 所有患儿均完成治疗,定期随访,依从性良好。有1例患儿在用药期间曾发生呼吸道感染2次,暂停注射重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白并给予对症治疗后痊愈,再次使用无不良反应;1例患儿曾出现注射局部皮肤红肿、瘙痒,给予抗变态反应治疗后消失,再次使用无不良反应,治疗期间定期筛查结核及慢性病毒感染,未见相关感染。
3 讨论
JIA是儿童时期常见的自身免疫性疾病[1],以慢性关节炎为主要特征,其症状常持续至成年,若治疗不及时或方法不当,可能导致严重的长期健康障碍,包括躯体残疾,是造成小儿残废和失明的首要原因。JIA分为7个亚型,包括全身型、多关节炎型(RF+和RF-)、少关节炎型、附着点炎症相关性、银屑病性关节炎和其他类型[12],其中多关节炎型是引起关节残疾的主要亚型。JIA 的治疗目标是控制炎症、防止关节破坏、保护关节功能、阻止病情发展、维持正常生长发育、提高生活质量,但长期以来缺乏特异性的治疗方法。早期对JIA的治疗方法为对症治疗,往往不能阻止病情发展及关节残疾,以后随着非生物DMARDs联合治疗的出现,大大改善JIA患儿的病情及预后,但这些药物通常需要6~8周起效,其远期效果仍仅能部分抑制疾病的结构性进展,缺乏持久的疗效,且有些患儿不能耐受不良反应,因此,对非生物DMARDs疗效不佳或不能耐受的患儿,迫切需要探索其他治疗方法,以提高疗效,减少致残、致畸率。
研究表明,肿瘤坏死因子α(tumor necrosis factor α,TNF-α)在JIA的免疫发病及炎症过程中起着非常关键的作用,是JIA的关键致炎因子,抗TNF生物制剂可特异性拮抗TNF-α,通过靶向治疗影响JIA发病机制中关键环节,不仅能迅速减轻炎症,控制关节炎症状,有效缓解病情[16-17],同时可防止关节结构破坏[18]。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白可以特异性地阻断TNF-α与其细胞表面受体的相互作用。国外生物制剂治疗JIA已经十多年,极大改善JIA 患儿的中短期预后。但在国内JIA治疗中,生物制剂使用仅5~7年,目前报道较少,且多为非对照、小样本的临床观察[10-11],缺乏前瞻性的对照研究及对放射学损害的评估,诸多问题仍需循证医学的验证。
本研究对32例非全身型JIA患儿应用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗的安全性和疗效的观察中,采用国际上通用的JIA核心评估参数[13],在治疗1,3和6个月时分别评估,结果显示,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合传统DMARDs治疗在缓解临床症状及降低炎性指标方面优于传统DMARDs治疗,且起效更快。
目前关于TNF拮抗药是否抑制JIA患者骨破坏(骨侵蚀或关节腔狭窄)的相关证据较少。国外一项研究显示,40例JIA患儿接受人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白(商品名:依那西普)治疗12个月后手足放射学评分显著优于治疗前[14]。本研究结果也显示,18例有腕关节损害的多关节型JIA患儿在接受注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗6个月后,其手关节放射学评分明显优于治疗前,且显著优于传统治疗,提示生物制剂治疗可减轻JIA患者放射学损害,抑制骨破坏。这对阻止或减缓关节破坏,缓解关节症状,改善关节的功能,防止关节畸形的发生,减少致残,帮助儿童尽可能维持正常的日常生活和生长发育这一治疗目标具有重要意义。本研究显示传统DMARDs治疗6个月后放射学评分较治疗前改善不明显,揭示传统治疗虽能暂时部分缓解临床症状及降低炎性指标,但不能阻止关节骨质破坏。
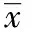
表2 两组患儿治疗前后炎性指标及放射学改变情况±s
与治疗前比较,*1P<0.05
德国一项研究显示,JIA患者接受人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合MTX治疗12个月时ACR Pedi 70达标率(62%)显著高于单用人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白的JIA患者(45%)[19]。2011年美国风湿病学会关于JIA治疗建议指出:对于病史中MTX有疗效的患者,即使采用TNF-α抑制药治疗,仍应继续使用MTX;而对于MTX完全无效患者,建议仍然倾向于继续使用MTX,主要理由是MTX可以减少抗TNF-α抑制药抗体的产生[20]。本研究治疗组为注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白联合MTX治疗,其ACR Pedi 70达标率高。
在随访观察中还发现,有4例病程较长,使用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗时已出现骨质破坏及关节畸形的患儿治疗效果较无骨质破坏及关节畸形的患儿效果差,达到ACR相应评分标准所需时间长,在治疗6个月时仍未能达ACR Pedi 70达标,患儿及其家长自觉症状、关节功能都有明显改善,炎性指标亦降低,但放射学评分无明显改善,关节畸形未能完全改善。提示生物制剂可以防止或延缓骨质破坏及关节畸形的发生,但不能逆转已经出现的骨质破坏。国外也有报道发现治疗前病程长的患儿在疾病早期使用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白效果更佳[21]。因此,对于存在预后不良因素的JIA患儿,如有颈椎受累、髋关节炎、RF或抗环瓜氨酸多肽抗体阳性、影像学损害(骨侵蚀或关节腔狭窄)在病程早期出现骨质破坏及关节畸形前使用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白,治疗效果会更好,有利于减少致畸致残率,改善这类患儿的预后,提高生活质量。
注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白最常见的不良反应是注射部位反应(28%~39%)[22],包括红斑、瘙痒、疼痛和肿胀等,其次为感染,为10%~36%[11,19,23],严重感染发生率很低,为每年1%~6%,其他还有头痛(20%),腹痛(16%),呕吐(14%),恶心(12%) 和皮疹(10%)[22]。本试验安全性观察显示,注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白治疗过程中仅个别患者出现轻度不良反应,如注射部位反应、上呼吸道感染等,未见严重的不良事件,未出现因药物不良反应而中断治疗者。当然,本研究观察时间短,例数不多,长期用药对机会感染、肿瘤以及其他不良反应还有待进一步观察。
通过研究,笔者认为,非全身型JIA患儿使用注射用重组人Ⅱ型肿瘤坏死因子受体-抗体融合蛋白具有较好的临床疗效,并可减轻放射学损害,安全性较高。对生物制剂治疗JIA的疗效及安全性评价还需要更大样本、更长随访时间的多中心研究。
[1] RAVELLI A, MARTINI A.Juvenile idiopathic arthritis[J].Lancet,2007,369(9563):767-778.
[2] MINDEN K, NIEWERTH M, ZINK A, et al.Long-term outcome of patients with JIA treated with etanercept, results of the biologic register JuMBO[J].Rheumatology(Oxford),2012,51(8): 1407-1415.
[3] BRACAGLIA C, BUONUOMO P S, TOZZI A E,et al.Safety and efficacy of etanercept in a cohort of patients with juvenile idiopathic arthritis under 4 years of age[J].J Rheumatol ,2012,39(6): 1287-1290.
[4] UNGAR W J, COSTA V, HANCOCK-HOWARD R, et al.Cost-effectiveness of biologics in polyarticular-course juvenile idiopathic arthritis patients unresponsive to disease-modifying antirheumatic drugs[J].Arthritis Care Res(Hoboken),2011,63(1):111-119.
[5] PAPSDORF V, HORNEFF G.Complete control of disease activity and remission induced by treatment with etanercept in juvenile idiopathic arthritis[J].Rheumatology(Oxford) ,2011, 50(1):214-221.
[6] PRINCE F H, DE BEKKER-GROB E W, TWILT M, et, al.An analysis of the costs and treatment success of etanercept in juvenile idiopathic arthritis: results from the dutch arthritis and biologicals in children register[J].Rheumatology(Oxford) ,2011,50(6):1131-1136.
[7] LOVELL D J, REIFF A, ILOWITE N T,et al.Safety and efficacy of up to eight years of continuous etanercept therapy in patients with juvenile rheumatoid arthritis[J].Arthrits Rheum,2008,58(5): 1496-1504.
[8]KERENSKY T A, GOTTLIEB A B, YANIV S,et al.Etanercept: efficacy and safety for approved indications[J].Exp Opin Drug Saf,2012,11(1):121-139.
[9] 胡清,曾玉琴,李雪锋,等.小剂量生物制剂联合甲氨蝶呤治疗类风湿关节炎35例[J].医药导报,2012,31(8):1026-1028.
[10] 李亚琴,曹兰芳,薛海燕.依那西普治疗非全身型幼年特发性关节炎的近期疗效及安全性观察[J].临床儿科杂志,2011,29(1):31-33.
[11] 刘小惠,邹峥,蔡素芬,等.探讨益赛普治疗多关节型幼年特发性关节炎的临床疗效与安全性[J].当代医学,2014,20(26):45-46.
[12] PETTY R E,SOUTHWOOD T R,MANNERS P,et al.In-ternational league of associations for rheumatology classification of juvenile idiopathic arthritis:second revision,edmonton[J].J Rheumatol,2004,31(2):390-392.
[13] GIANNINI E H,RUPTERTO N,RAVELLI A,et al.Preli-minary definition of improvement in juvenile arthritis[J].Arthritis Rheum,1997,40(7):1202-1209.
[14] NIELSEN S, RUPERTO N, GERLONI V, et al.Prelimi-nary evidence that etanercept may reduce radiographic progression in juvenile idiopathic arthritis[J].Clin Exp Rheumatol,2008,26(4): 688-692.
[15] POZNANSKI A K, HERNANDEZ R J, GUIRE K E, et al.Carpal length in children-a useful measurement in the diagnosis of rheumatoid arthritis and some congenital malformation syndromes[J].Radiology,1978,129(3):661-668.
[16] 尹薇, 丁艳, 刘凡,等.幼年特发性关节炎患儿基质金属蛋白酶及细胞因子的改变及意义[J].中华风湿病学杂志,2013,17(9):601-605.
[17] KAHN P .Juvenile idiopathic arthritis: an update for the clinician[J].Bull NYU Hosp Jt Dis, 2012,70(3):152-166.
[18] LLOYD S,BUJKIEWICZ S A,WAILOO A J,et al.The effectiveness of anti-TNF-α therapies when used sequentially in rheumatoid arthritis patients:a systematic review and meta-analysis[J].Rheumatology(Oxford),2010,49(12):2313-2321.
[19] HORNEFF G, DE BOCK F, FOELDVARI I, et al.Safety and efficacy of combination of etanercept of methotrexate compared to treatment with etanercept only in patients with juvenile idiopathic arthritis(JIA):preliminary data from the German JIA Registry[J].Ann Rheum Dis,2009,68(4): 519- 525.
[20] BEUKELMAN T,PATKAR N M,SAAG K G, et al.2011 American college of rheumatology recommendations for the treatment of juvenile idiopathic arthritis: initiation and safety monitoring of therapeutic agents for the treatment of arthritis and systemic features[J].Arthritis Care Res(Hoboken),2011,63(4):465-482.
[21] HELMICK C G, FELSON D T, LAWRENCE R C, et al.Estimates of the prevalence of arthritis and other rheumatic conditions in the United States.PartⅠ[J].Arthritis Rheum,2008,58(1):15-25.
[22] LOVELL D J,GIANNINI E H,REIFF A,et al.Etanercept in children with polyarticular juvenile rheumatoid arthritis.pediatric rheumatology collaborative study group[J].N Engl J Med,2000,342(11):763-769.
[23] PRINCE F H,TWILT M,TEN CATE R,et al.Long-term follow-up on effectiveness and safety of etanercept in juvenile idiopathic arthritis:the dutch national register[J].Ann Rheum Dis,2009,68(5):635-641.
2014-05-16
2014-09-16
*武汉市卫生局临床重点专科研究项目(武卫[2007]43号)
丁艳(1970-),女,湖北恩施人,主任医师,博士,研究方向为小儿风湿免疫性疾病。电话:027-82433383,E-mail:dingyanmx@163.com。
尹薇(1964-),女,主任医师,博士,研究方向为小儿风湿免疫性疾病。电话:027-82433383,E-mail:18696174676@163.com。
R977.3;R726.8
B
1004-0781(2015)02-0193-05
DOI 10.3870/yydb.2015.02.013
