全氟辛烷磺酸(PFOS)对半滑舌鳎肝脏细胞的毒性效应
2015-06-07党红蕾那广水高会李瑞婧高艳飞姚子伟祖国仁
党红蕾,那广水,高会,李瑞婧,高艳飞,姚子伟,祖国仁,#
1.大连工业大学生物工程学院,大连 116034 2.国家海洋局近岸海域生态环境重点实验室 国家海洋环境监测中心,大连 116023
全氟辛烷磺酸(PFOS)对半滑舌鳎肝脏细胞的毒性效应
党红蕾1,2,那广水2,*,高会2,李瑞婧2,高艳飞1,姚子伟2,祖国仁1,#
1.大连工业大学生物工程学院,大连 116034 2.国家海洋局近岸海域生态环境重点实验室 国家海洋环境监测中心,大连 116023
为探究海洋环境中持久性有机污染物——全氟辛烷磺酸(PFOS)的生物毒性效应,以半滑舌鳎肝脏细胞(HTLC)为研究对象,将其暴露于含不同浓度PFOS的DMEM-F12培养基中,分别染毒24、48、72 h后,利用噻唑蓝比色法(MTT)和透射电镜实验评价PFOS的细胞毒性; 同时测定活性氧自由基(ROS)和超氧化物歧化酶(SOD)活性来探讨PFOS对细胞的氧化损伤效应。结果发现,细胞活性随PFOS浓度升高呈先促进后抑制趋势,当PFOS浓度达到1 000mol·L-1时细胞活性受到显著抑制(P<0.01);电镜结果显示PFOS能引起与代谢相关的细胞器如线粒体、 内质网等发生肿胀甚至破损; 与对照组相比,ROS含量和SOD活性分别在20mol·L-1、200mol·L-1开始出现显著性差异(P<0.05),证实在PFOS引起的氧化应激反应中SOD起到了清除自由基作用以维持细胞稳态。研究表明,PFOS对海洋鱼类细胞具有一定的生物毒性,能引起细胞产生氧化应激反应,并进一步破坏生物膜系统,从而导致细胞增殖和多种代谢途径受到抑制。
全氟辛烷磺酸; 肝细胞; 半滑舌鳎; 细胞毒性; 氧化应激
全氟辛烷磺酸(PFOS)是一种具有疏水、疏油特性的表面活性剂,在工业生产中具有重要应用,包括金属电镀、润滑剂、农药、纺织、造纸、食品包装等[1-2]。由于具有持久性、生物蓄积性和毒性,PFOS及其盐类在2009年被《斯德哥尔摩公约》确定为新兴持久性有机污染物。由于没有很好的替代产品,PFOS仍在金属电镀、半导体、航空液压油、泡沫灭火器等领域生产和使用[3]。PFOS上的C-F键稳定性强、难被降解,在全球范围内的多种环境介质中均检测到不同程度的PFOS污染[4-5],并且PFOS在生物体和人体中也有大量富集[6],因此近几年PFOS的环境风险问题开始受到人们普遍关注。
相比于其他持久性有机污染物,PFOS溶解度较高、不易挥发,所以水环境是其污染传播的重要途径[7-8]。从世界多地海水和海洋生物的检测结果来看,表层海水和近海岸地区的可食用海产品中PFOS均有检出[9-12],并且废水和半导体制造厂附近海水中PFOS污染较严重[13],在东京湾、佛兰德斯地区以及灭火泡沫意外溢漏区域的检测结果发现,鱼体肝脏是PFOS的重要富集场所,其最大检出范围为1.8~9.03 μg·g-1[14-16]。关于PFOS对水生生物特别是鱼类的毒性研究表明,PFOS属于中等毒性并能损伤全身器官的有毒污染物,将胚胎期海洋青鱂暴露于PFOS导致鱼幼体免疫抑制并引发炎症反应[17];水中PFOS暴露引起斑马鱼胚胎致畸、影响金鱼游泳性能等毒性效应[18-20];Jennifer等[21]发现低浓度PFOS染毒下大头鱼腮内多种蛋白质差异性表达,并且这些蛋白可能与能量代谢和细胞骨架系统相关。迄今为止,PFOS对海洋生物毒性效应机制还不明确。
PFOS对海洋生物毒理效应的研究方法大多以鱼类胚胎或鱼体为实验对象,由于生物体的免疫调节作用,没有很好反映PFOS毒性作用机制。本文根据体外细胞稳定和对污染物敏感性高的特点,并基于鱼类肝脏作为PFOS在鱼体内的主要富集场所、同时也是生物体主要解毒器官的事实,以典型近海鱼类半滑舌鳎肝脏细胞(HTLC)为实验对象,研究PFOS对细胞活性及细胞器损伤影响,揭示在氧化应激反应下PFOS的致毒过程,为PFOS对海洋环境和海洋生物的潜在风险研究提供海洋生物细胞毒理的依据。
1 材料与方法(Materials and methods)
1.1 主要仪器与试剂
仪器: 细胞培养箱(上海一恒科技有限公司),Model 680型酶标仪(美国BioRad公司),374型荧光酶标仪(美国Thermo公司),XD-202型倒置显微镜(南京江南永新光学有限公司)。
试剂: 青链霉素抗体、四甲基偶氮噻唑蓝MTT(北京索莱宝科技有限公司),全氟辛烷磺酸钾盐PFOSK(纯度98%,上海晶纯生化科技有限公司),DMEM-F12培养基(美国Thermo公司),成纤维生长因子bFGF(美国PeproTech公司),胎牛血清(浙江天杭生物科技有限公司),ROS试剂盒、SOD试剂盒、BCA法蛋白定量测试盒(南京建成生物工程研究所)。
1.2 细胞培养
半滑舌鳎肝脏细胞(HTLC)来源于任国诚等[22]建立的海洋鱼类半滑舌鳎的肝脏组织细胞,该细胞系是贴壁生长细胞,形态呈纤维样,传代稳定,细胞培养条件为24 ℃,全培养基为含15%胎牛血清、1%青链霉素抗体、1% bFGF的DMEM-F12培养基。
1.3 MTT实验
配置浓度为1 mol·L-1的PFOS标准品母液,逐级稀释至实验所需浓度,培养基中DMSO浓度<0.1%。将长势良好的HTLC细胞以2×105个·mL-1密度接种于96微孔板中,培养24 h后,移出旧培养基,加入含不同浓度PFOS(20、100、200、400、1 000 μmol·L-1)标准培养基,同时设定无PFOS培养基作为空白对照组。每个实验浓度包括6个平行,细胞于24 ℃培养,暴露时间24、48、72 h。染毒结束后,每孔加20 μL MTT(5 mg·mL-1)溶液,孵育4 h,再加入150 μL DMSO,振荡10 min,用酶标仪在490 nm下测定吸光值。
1.4 透射电镜实验
依据MTT实验结果,选择20 μmol·L-1及200 μmol·L-12个浓度,对细胞染毒24 h后,进行电镜实验。收集106个细胞,进行固定、包埋、超薄切片、染色[23],利用JEOL JEM-1200EX型电子显微镜观察。
1.5 ROS含量及SOD活性测定
使用化学荧光法和四唑盐WST-1法测定细胞内ROS含量和SOD活性。PFOS(20、100、200、400、1 000 μmol·L-1)染毒24、48、72 h后收集细胞,PBS重悬沉淀,调整细胞浓度1×106个·mL-1,每组实验设定3个平行,对照组为无PFOS培养基。实验方法参照ROS、SOD及BCA试剂盒。
1.6 数据处理
运用Excel软件计算各组数据平均值及标准差,采用SPSS 19.0软件对实验数据进行单因素ANOVA分析和t检验,完成对照组与染毒组之间的显著性差异分析(*P<0.05差异显著,**P<0.01差异极显著)。
2 结果(Results)
2.1 细胞形态观察
不同浓度PFOS作用于HTLC细胞24 h后,显微镜下观察结果见图1。发现随着PFOS染毒浓度升高,200、400、1 000 μmol·L-1染毒组中HTLC细胞不规则程度增加,贴壁能力下降,细胞数量减少,PFOS对HTLC细胞具有明显的增殖抑制效应。
2.2 MTT实验结果
在检测PFOS细胞毒性的MTT实验中,PFOS浓度分别为200 μmol·L-1、400 μmol·L-1和1 000 μmol·L-1染毒组与对照组的细胞活性出现显著差异(图2)。当PFOS以200 μmol·L-1浓度作用72 h后,HTCL细胞活性显著增加(P<0.05);PFOS浓度为400 μmol·L-1时,染毒48 h后的细胞活性与对照组相比具有显著差异(P<0.05),染毒72 h差异极显著(P<0.01);在PFOS浓度为1 000 μmol·L-1时,染毒24、48、72 h后细胞活性均受到极显著抑制(P<0.01)。可见,随着PFOS浓度增加及作用时间延长,HTCL细胞活性变化更显著(图2)。
2.3 透射电镜实验结果
透射电镜观察HTCL细胞受PFOS作用实验结果见图3。空白对照组HTCL细胞中线粒体清晰可见,细胞核及内质网完整;PFOS浓度20 μmol·L-1染毒组细胞核结构完整但形态发生变化、线粒体及内质网肿胀;PFOS浓度为200 μmol·L-1时,HTCL细胞细胞核并无裂解现象、但细胞核被挤到细胞膜内侧,胞内产生大量脂质,线粒体及内质网模糊不清,细胞内膜系统破坏,损伤较严重。

图1 不同浓度PFOS染毒24 h后HTLC细胞形态变化
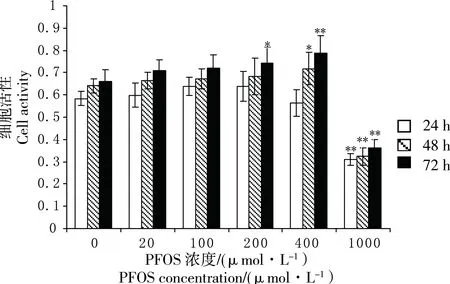
图2 不同浓度PFOS对HTLC细胞活性的影响
2.4 ROS含量测定结果
不同浓度PFOS作用于HTLC细胞,细胞内ROS含量变化情况见图4。HTLC细胞内ROS含量随PFOS浓度增加而先升高后降低,随PFOS作用时间延长呈升高趋势。染毒24 h结果表明,HTLC细胞内ROS含量在PFOS浓度20 μmol·L-1染毒组与对照组相比显著升高(P<0.05),200、400、1 000 μmol·L-1染毒组ROS含量极显著降低(P<0.01);染毒48 h后,400、1 000 μmol·L-1组与对照组相比ROS含量极显著降低(P<0.01);而染毒72 h时,20 μmol·L-1组细胞内ROS含量显著升高(P<0.05),100、200、400、1 000 μmol·L-1染毒组ROS含量均显著降低(P<0.05,P<0.01)。

图3 不同浓度PFOS染毒24 h后电镜观察HTCL细胞结果(A,B:对照组;C,D:20 μmol·L-1;E,F:200 μmol·L-1)
2.5 SOD活性测定结果
在生物体内存在自由基产生和清除的动态平衡,SOD是清除ROS的典型抗氧化酶。PFOS染毒后,HTLC细胞内SOD含量升高(图5)。PFOS浓度400 μmol·L-1和1 000 μmol·L-1组均具有极显著差异(P<0.01)。在染毒24 h时,PFOS浓度200 μmol·L-1组的HTLC细胞内SOD含量与对照组相比具有显著差异(P<0.05),染毒48 h和72 h后,随PFOS浓度增加,SOD含量显著升高(图5),HTLC细胞表现出明显的剂量依赖效应,说明在氧化应激过程中,SOD起到了清除HTLC细胞内自由基的作用。

图4 不同浓度PFOS对HTLC细胞ROS含量影响

图5 不同浓度PFOS对HTLC细胞SOD活性影响
3 讨论(Discussion)
PFOS具有高蛋白结合性,易在动物的血液和肝脏中蓄积[24-25],高浓度暴露下,PFOS能影响生物体的免疫系统、生殖系统和神经系统发育,造成生物毒性效应[17,26-27]。Liu等[28]研究发现PFOS浓度大于500 μmol·L-1时对原代培养的罗非鱼肝脏细胞具有毒性效应,并认为目前污染程度对鱼类生殖发育带来的风险很小。本研究中HTLC细胞比罗非鱼肝脏细胞对PFOS的敏感性高,结果显示PFOS浓度为100 μmol·L-1时可导致细胞形态发生明显变化,并随PFOS浓度升高细胞变形率增多;不同浓度PFOS作用下,细胞活性表现出低浓度促进高浓度抑制的毒性特点,因此,HTLC细胞可以作为PFOS对海洋生物毒性机理研究的理想模型。在PFOS染毒浓度为20~400 μmol·L-1时,细胞活性有增加现象,这可能与细胞为防止毒性产生而启动了DNA修复过程有关[29],端正花等[30]的研究中同样有PFOS显著促进细胞增殖这一现象,并认为PFOS可能具有类雌激素风险。当染毒浓度为1 000 μmol·L-1时,PFOS极显著抑制细胞活性,Arnaud和Shan等[31-32]研究PFOS对人体肝癌细胞毒性时也得出相似结论,即较高浓度暴露下PFOS具有明显的细胞毒性效应。


图6 PFOS引起细胞内产生氧化应激反应及毒性作用过程
综上所述,本研究通过测定PFOS对细胞活性、细胞器损伤和氧化损伤相关酶活性的影响,初步揭示了不同染毒浓度和染毒时间下PFOS对海洋鱼类细胞的致毒过程,即低浓度PFOS进入HTLC细胞后,通过与线粒体呼吸链辅酶结合,产生ROS同时阻碍ATP合成过程,进而造成琥珀酸脱氢酶(SDH)含量积累,产生细胞活性增加的假象,诱导细胞启动DNA修复与SOD防御作用维持细胞代谢平衡,但细胞将长期处于由PFOS引起的氧化胁迫状态;当高浓度PFOS所造成的损伤作用超出细胞自身修复防御能力时,细胞内ROS氧化与SOD还原失衡,产生氧化应激反应,大量ROS破坏生物膜系统及线粒体等细胞器,导致细胞内多种代谢途径受到抑制,细胞活性降低,并由此引发细胞凋亡过程。
致谢:感谢青岛黄海水产研究所陈松林研究员赠送本实验所用HTLC细胞系,感谢孙爱老师对本实验的帮助。
[1] 杨莉莉,金芬,李敏洁,等.食品和食品包装材料中全氟化合物(PFCs)的研究进展[J].食品工业科技,2014,35(8): 367-373
Yang L L,Jin F,Li M J,et al.Research progress in advance of perfluorochemicals in food [J].Science and Technology of Food Industry,2014,35(8): 367-373 (in Chinese)
[2] 梅胜放.我国PFOS/PFOA的生产,应用以及国内外标准现状[J].有机氟工业,2008 (1): 21-25
[3] Wang T,Wang Y,Liao C,et al.Perspectives on theinclusion of perfluorooctane sulfonate into the stockholm convention on persistent organic pollutants 1 [J].Environmental Science & Technology,2009,43(14): 5171-5175
[4] 杨永亮,路国慧,杨伟贤,等.沈阳地区水环境和生物样品中全氟化合物的污染分布特征[J].环境科学学报,2010,30 (10): 2097-2107
Yang Y L,Lu G H,Yang W X,et al.Levels and distribution of perfluorinated compounds in water and biological samples from the Shenyang area,China [J].Acta Scientiae Circumstantiae,2010,30 (10): 2097-2107 (in Chinese)
[5] 潘媛媛,史亚利,蔡亚岐.土壤,底泥和活性污泥中全氟化合物的高效液相色谱-串联质谱分析方法[J].环境化学,2010,29(3): 519-523
Pan Y Y,Shi Y L,Cai Y Q.Determination of perfluorinated compounds in soil,sediment and sludge using HPLC-MS/MS [J].Environmental Chemistry,2010,29(3): 519-523 (in Chinese)
[6] 胡佳玥,戴家银.全氟及多氟类化合物在人体分布及其毒性研究进展[J].生态毒理学报,2013,8(5): 650-657
Hu J Y,Dai J Y.Advance instudies on human distribution and toxic effects of perfluoroalkyl and polyfluoroalkyl substances [J].Asian Journal of Ecotoxicology,2013,8(5): 650-657 (in Chinese)
[7] 杨兰琴,冯雷雨,陈银广.中国水环境中全氟化合物的污染水平及控制策略[J].化工进展,2012,31(10): 2304-2312
Yang L Q,Feng L Y,Chen Y G.Pollution status and control strategies of perfluorinated compounds in water environments over China: A review [J].Chemical Industry and Engineering Progress,2012,31(10): 2304-2312 (in Chinese)
[8] 韩建,方展强.水环境PFOS和PFOA的污染现状及毒理效应研究进展[J].水生态学杂志,2010,3(2): 99-105
[9] Pan Y,Shi Y,Wang Y,et al.Investigation of perfluorinated compounds (PFCs) in mollusks from coastal waters in the Bohai Sea of China [J].Journal of Environmental Monitoring,2010,12(2): 508-513
[10] Chen C,Wang T,Naile J E,et al.Perfluorinated compounds in aquatic products from Bohai Bay,Tianjin,China [J].Human and Ecological Risk Assessment: An International Journal,2011,17(6): 1279-1291
[11] Gulkowska A,Jiang Q,So M K,et al.Persistent perfluorinated acids in seafood collected from two cities of China [J].Environmental Science & Technology,2006,40(12): 3736-3741
[12] Zhao Y G,Wan H T,Law A,et al.Risk assessment for human consumption of perfluorinated compound-contaminated freshwater and marine fish from Hong Kong and Xiamen [J].Chemosphere,2011,85(2): 277-283
[13] Lin A Y C,Panchangam S C,Lo C C.The impact of semiconductor,electronics and optoelectronic industries on downstream perfluorinated chemical contamination in Taiwanese rivers [J].Environmental Pollution,2009,157(4): 1365-1372
[14] Moody C A,Martin J W,Kwan W C,et al.Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek [J].Environmental Science & Technology,2002,36(4): 545-551
[15] Taniyasu S,Kannan K,Horii Y,et al.A survey of perfluorooctanesulfonate and related perfluorinated organic compounds in water,fish,birds,and humans from Japan [J].Environmental Science & Technology,2003,37(12): 2634-2639
[16] Hoff P T,Van Campenhout K,Van de Vijver K,et al.Perfluorooctane sulfonic acid and organohalogen pollutants in liver of three freshwater fish species in Flanders (Belgium): Relationships with biochemical and organismal effects [J].Environmental Pollution,2005,137(2): 324-333
[17] Fang C,Huang Q,Ye T,et al.Embryonic exposure to PFOS induces immunosuppression in the fish larvae of marine Medaka [J].Ecotoxicology and Environmental Safety,2013,92: 104-111
[18] 叶露,吴玲玲,蒋雨希,等.PFOS/PFOA对斑马鱼(Danio rerio)胚胎致毒效应研究[J].环境科学,2009,29(6): 170-174
Ye L,Wu L L,Jiang Y X,et al.Toxicological study of PFOS/PFOA to zebrafish (Danio rerio) embryos [J].Environmental Science,2009,29(6): 170-174 (in Chinese)
[19] Shi X,Du Y,Lam P K S,et al.Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS [J].Toxicology and Applied Pharmacology,2008,230(1): 23-32
[20] Xia J,Fu S,Cao Z,et al.Ecotoxicological effects of waterborne PFOS exposure on swimming performance and energy expenditure in juvenile goldfish (Carassius auratus) [J].Journal of Environmental Sciences,2013,25(8): 1672-1679
[21] Dorts J,Kestemont P,Marchand P A,et al.Ecotoxicoproteomics in gills of the sentinel fish species,Cottusgobio,exposed to perfluorooctane sulfonate (PFOS) [J].Aquatic Toxicology,2011,103(1): 1-8
[22] 任国诚,陈松林,沙珍霞.半滑舌鳎肝脏细胞系的建立与鉴定[J].高技术通讯,2008,18(6): 657-660
Ren G C,Chen S L,Sha Z X.Development and characterization of a liver cell line from half-smooth tongue-sole (Cynoglossus semilaevis) [J].Chinese High Technology Letters,2008,18(6): 657-660 (in Chinese)
[23] 李龙,陈家堃.现代毒理学实验技术原理与方法[M].北京: 化学工业出版社,2006: 79
[24] 沈葆真,曹文军,钟键.全氟化合物在生物体内污染水平的研究进展[J].化学与生物工程,2014,31(1): 6-9
[25] Bao J,Kärrman A,van Bavel B,et al.Perfluoroalkyl substances in the blood samples from a male population of Sweden [J].Chinese Science Bulletin,2014,59(4): 388-395
[26] 刘晓晖,胡宏,李双月,等.全氟辛烷磺酸神经发育毒性机制研究进展[J].生态毒理学报,2013,8(5): 643-649
Liu X H,Hu H,Li S Y,et al.Research progress on mechanisms in the developmental neurotoxicity of PFOS [J].Asian Journal of Ecotoxicology,2013,8(5): 643-649 (in Chinese)
[27] Pereiro N,Moyano R,Blanco A,et al.Regulation of corticosterone secretion is modified by PFOS exposure at different levels of the hypothalamic-pituitary-adrenal axis in adult male rats [J].Toxicology Letters,2014,230(2): 252-262
[28] Liu C,Du Y,Zhou B.Evaluation of estrogenic activities and mechanism of action of perfluorinated chemicals determined by vitellogenin induction in primary cultured tilapia hepatocytes [J].Aquatic Toxicology,2007,85(4): 267-277
[29] Kienzler A,Bony S,Devaux A.DNA repair activity in fish and interest in ecotoxicology: A review [J].Aquatic Toxicology,2013,134: 47-56
[30] 端正花,王勋功,王华.全氟辛烷羧酸(PFOA)与全氟辛烷磺酸(PFOS)的细胞毒性效应[J].生态毒理学报,2014,9(2): 353-357
Duan Z H,Wang X G,Wang H.The cytotoxic effect of PFOA and PFOS [J].Asian Journal of Ecotoxicology,2014,9(2): 353-357 (in Chinese)
[31] Florentin A,Deblonde T,Diguio N,et al.Impacts of two perfluorinated compounds (PFOS and PFOA) on human hepatoma cells: Cytotoxicity but no genotoxicity? [J].International Journal of Hygiene and Environmental Health,2011,214(6): 493-499
[32] Shan G,Ye M,Zhu B,et al.Enhanced cytotoxicity of pentachlorophenol by perfluorooctanesulfonate or perfluorooctanoic acid in HepG2 cells [J].Chemosphere,2013,93(9): 2101-2107
[33] Reuter S,Gupta S C,Chaturvedi M M,et al.Oxidative stress,inflammation,and cancer: How are they linked? [J].Free Radical Biology and Medicine,2010,49(11): 1603-1616
[34] 张晶,梁岳,方展强.全氟辛烷磺酸类物质对剑尾鱼Cu/Zn-SOD及相关应激基因表达的影响[J].水产学报,2014,38(4): 482-490
[35] 王贺威,马胜伟,张喆,等.全氟辛烷磺酸盐(PFOS)胁迫对翡翠贻贝抗氧化酶的影响[J].生态毒理学报,2012,7(5): 508-516
Wang H W,Ma S W,Zhang Z,et al.Effects of perfluorooctane sulfonate (PFOS) exposure on antioxidant enzymes of Perna viridis [J].Asian Journal of Ecotoxicology,2012,7(5): 508-516 (in Chinese)
[36] Wang X,Zhao G,Liang J,et al.PFOS-induced apoptosis through mitochondrion-dependent pathway in human-hamster hybrid cells [J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis,2013,754(1): 51-57
[37] Klaunig J E,Kamendulis L M.The role of oxidative stress in carcinogenesis [J].Annual Review of Pharmacology and Toxicology,2004,44: 239-267
[38] Orrenius S,Nicotera P,Zhivotovsky B.Cell death mechanisms and their implications in toxicology [J].Toxicological Sciences,2011,119(1): 3-19
[39] Zhang D Y,Xu X L,Shen X Y,et al.Analysis of apoptosis induced by perfluorooctane sulfonates (PFOS) in mouse leydig cells in vitro [J].Toxicology Mechanisms and Methods,2015,25(1): 21-25
◆
Toxicity Effects of Perfluorooctane Sulfonate (PFOS) on Liver Cells ofCynoglossussemilaevis
Dang Honglei1,2,Na Guangshui2,*,Gao Hui2,Li Ruijing2,Gao Yanfei1,Yao Ziwei2,Zu Guoren1,#
1.School of Biological Engineering,Dalian Polytechnic University,Dalian 116034,China 2.Key Laboratory for Ecological Environment in Coastal Areas of State Oceanic Administration,National Marine Environmental Monitoring Center,Dalian 116023,China
11 November 2014 accepted 3 December 2014
MTT assay and transmission election microscope (TEM) were used to analyze the cytotoxicity of perfluorooctane sulfonate (PFOS) on liver cells of Cynoglossus semilaevis (HTLC).Reactive oxygen species (ROS) and superoxide dismutase (SOD) activity were applied to evaluate the oxidative damage of HTLC exposed to different concentrations of PFOS for 24,48,72 h,respectively.The results indicated that cell activity was promoted under the low concentration of PFOS.However,the activity was inhibited obviously when PFOS concentration increased to 1 000 μmol·L-1(P<0.01).TEM results showed that organelles relevant to metabolism,such as intracellular mitochondria and endoplasmic reticulum,would swell and/or be damaged under the condition of high PFOS concentration in HTLC.ROS contents and SOD activity also displayed significant difference at 20 μmol·L-1and 200 μmol·L-1of PFOS,respectively (P<0.05),indicating that SOD can maintain the cellular homeostasis by removing free radicals induced in the process of oxidative stress caused by PFOS.The results confirmed that the proliferation and metabolic pathways can be inhibited significantly by PFOS in HTLC by the oxidative stress and then the destruction of the biomembrane system of HTLC in marine fish.
PFOS; Cynoglossus semilaevis; liver cell; cytotoxicity; oxidative stress
国家海洋局海洋公益性科研专项(201105013);国家自然科学基金(21377032);国家海洋局近岸海域生态环境重点实验室开放 基金(201506)
党红蕾(1990-),女,硕士研究生,研究方向为污染物毒理,E-mail: hongleidang@163.com;
*通讯作者(Corresponding author),E-mail: gsna@nmemc.org.cn
10.7524/AJE.1673-5897.20141111002
2014-11-11 录用日期:2014-12-03
1673-5897(2015)4-162-08
X171.5
A
那广水(1977-),男,博士,研究员,硕士生导师,从事新型污染物环境行为及其毒理学研究。
#共同通讯作者(Co-corresponding author),E-mail: zugr@dlpu.edu.cn
党红蕾,那广水,高会,等.全氟辛烷磺酸(PFOS)对半滑舌鳎肝脏细胞的毒性效应[J].生态毒理学报,2015,10(4): 162-169
Dang H L,Na G S,Gao H,et al.Toxicity effects of perfluorooctane sulfonate (PFOS) on liver cells of Cynoglossus semilaevis [J].Asian Journal of Ecotoxicology,2015,10(4): 162-169 (in Chinese)
