磺化石墨烯对小麦幼苗生长及生理生化指标的影响
2015-06-07常海伟任文杰刘鸿雁滕应李丽娜
常海伟,任文杰,刘鸿雁,滕应,*,李丽娜
1.贵州大学资源与环境工程学院,贵阳 550025 2.中国科学院土壤环境与污染修复重点实验室(南京土壤研究所) ,南京 210008
磺化石墨烯对小麦幼苗生长及生理生化指标的影响
常海伟1,2,任文杰2,刘鸿雁1,滕应2,*,李丽娜2
1.贵州大学资源与环境工程学院,贵阳 550025 2.中国科学院土壤环境与污染修复重点实验室(南京土壤研究所) ,南京 210008
随着石墨烯生产量和使用量的不断增大,其对生态环境的风险逐渐引起了环境学家的关注。采用水培试验,探究了磺化石墨烯(SGO)对小麦幼苗的生长、抗氧化酶活性及脂质过氧化的影响。结果表明:在培养10 d后,低浓度磺化石墨烯对小麦根系的生长有显著促进作用(P<0.05),200 mg·L-1浓度处理与对照处理相比提高了84.3%,随着浓度增加促进作用逐渐减弱,1 000 mg·L-1时与对照相比提高了19.9%。但对小麦地上部的生长没有影响。磺化石墨烯处理的小麦幼苗根系和叶片组织中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)及丙二醛(MDA)都呈现先下降后上升的趋势。当磺化石墨烯浓度低于200 mg·L-1时,处理组小麦抗氧化酶的活性及MDA含量相对于对照处理大都有所降低,说明低浓度时磺化石墨烯没有对小麦的生长产生氧化胁迫,这与磺化石墨烯可能具有一定的抗氧化能力有关,而高浓度时由于产生氧化胁迫使各项生理生化指标逐渐上升。本实验结果为石墨烯材料对植物的毒理学研究提供了基础数据。
磺化石墨烯;小麦;抗氧化酶;MDA
石墨烯(graphene)是由碳原子sp2杂化形成的具有二维结构的新型纳米材料[1]。由于具有很高的机械强度、优异的导电性能、 独特的光学特征和良好的电化学特性,故石墨烯可以广泛应用于电子、光学、医疗器械、化妆品、食品包装、水处理等各个行业[2-4]。近年来,纳米产品正以每3年翻一番的速度增长,预计到2020年将达到3万亿的市场价值[5],而石墨烯作为纳米材料中的佼佼者必将占据重要地位。随着石墨烯生产量和使用量的不断增大,不可避免地会进入到大气、水体和土壤等环境中,因此石墨烯对生态环境和人类健康的影响逐渐引起了环境学家的关注。
目前关于石墨烯对生态环境的效应研究主要集中在动物[6-7]和细菌活性[8-9]方面。已有报道指出,石墨烯由于具有强吸附能力和高化学活性,容易与有机体相互作用并引起组织损伤甚至细胞凋亡[10]。植物是生态系统结构的重要组成部分和主要的初级生产者,因此研究石墨烯对植物的毒性以及环境效应至关重要。已有一些学者对石墨烯等纳米材料对植物的发芽率[11]、根长、株高和代谢[12]的影响展开了研究。研究结果表明不同浓度石墨烯、氧化石墨烯都能引起细胞脂质过氧化进而导致机体受损死亡[13]。但是随着纳米材料的种类、暴露时间、剂量,还有植物种类的不同,影响程度也会有所不同[14]。磺化石墨烯(SGO)是否同其他纳米材料一样具有相同的影响,目前还不得而知。本研究以小麦作为供试植物,分析了在不同浓度SGO胁迫下,小麦幼苗生长、抗氧化酶活性及丙二醛含量等指标的变化情况,了解SGO对小麦幼苗的毒性效应,从而为石墨烯的毒性评价、生态环境效应等提供科学依据和基础资料。
1 材料与方法(Materials and methods)
1.1 材料与仪器
SGO由苏州高通新材料有限公司提供,其扫描电镜图像如图1。从扫描电镜图像可见,其结构非常规整。
小麦种子购于南京农业大学神州种业公司,品种为南农9918。测定小麦幼苗生理生化指标的相关试剂盒和标准品购于南京建成生物工程研究所。NaCl、冰醋酸为分析纯,乙醇、NaOH和HNO3为优级纯,均购于南京博巧生物科技有限公司。实验用水为去离子水。

图1 磺化石墨烯(SGO)的扫描电镜图像
实验仪器:752紫外可见分光光度计(上海菁华科技仪器有限公司),人工气候恒温培养室,Allegra X-型高速离心机(贝克曼库尔特公司,美国),KQ-300VDE型超声波仪(昆山超声仪器有限公司)。
1.2 实验处理
选取颗粒饱满、大小均匀的小麦种子,经3%的H2O2水溶液表面消毒10 min后,用去离子水充分冲洗。在(25±1) ℃的培养箱中催芽48 h。配制不同浓度(0、50、100、200、500、800、1 000 mg·L-1)的SGO分散液,分别取50 mL分散液于培养瓶中,采用0.1 mol·L-1NaOH溶液调节pH至6.3~6.5之间,然后将定植篮放置于培养瓶中,此时培养瓶中的SGO分散液刚好将定植篮浸没,挑选芽长一致的种子均匀摆放于定植篮上。将培养瓶放置于智能光照培养室(光照强度60% Lx,25 ℃,光照10 h,黑暗14 h)中进行培养。以不加SGO的处理作为对照,每个处理设3个重复。每天补水至初始液面处,震荡使得溶液混合均匀,培养10 d。
1.3 测定方法
1.3.1 生物量及根长、株高的测定
培养结束后,用去离子水冲洗干净,用吸水纸吸干植株表面水分。测定株高和根长,称量鲜重,然后将根和叶分开,分别称量根部和地上部鲜重,根据以下公式计算根冠比:根冠比=根部鲜重(g)/地上部鲜重(g)。
1.3.2 小麦抗氧化酶活性及丙二醛含量的测定
将一定量的植物地上部和根部分别置于液氮中速冻,各加入体积为9倍于鲜重的生理盐水,在冰浴中研磨,冰水浴提取20 min后,将得到的10%组织匀浆液于4 000 r·min-1(4°C)离心20 min,上清液即可用于各指标的分析测定。超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)等生理生化指标均严格按照试剂盒说明进行测定。
1.4 数据分析
实验结果以平均值±标准偏差表示。采用SPSS19.0软件,以单因素方差分析(One way ANOVA)对SOD、POD、CAT等酶的活性和MDA含量变化进行差异性分析,并采用Origin软件绘图。
2 结果(Results)
2.1 SGO对小麦幼苗生长的影响
如图2所示,培养10 d后,不同浓度SGO处理下,小麦幼苗的根长均显著(P<0.05)高于对照处理。当SGO浓度为50~200 mg·L-1时,各浓度处理之间小麦幼苗的根长没有显著差异,200 mg·L-1处理时,小麦幼苗根长最长,相比于对照提高84.3%;而当SGO浓度为200~1 000 mg·L-1时,小麦幼苗的根长随着SGO浓度的增加而降低,1 000 mg·L-1处理时,小麦幼苗的根长相比对照提高了19.9%。结果表明SGO在试验浓度范围能促进小麦根的伸长,但浓度相对较高时,这种促进作用会逐渐降低。然而各浓度处理的小麦幼苗地上部长度与对照相比无显著差异。
根冠比(root/shoot ratio)是指植物地下部分与地上部分的鲜重或干重的比值。在农业生产过程中,往往力求促进根系生长,增大根冠比,为作物幼苗期创造良好的营养条件。若根系生长受到促进(或阻碍),根冠比往往会表现出升高(或下降)的趋势。如图2所示,在各浓度SGO处理下,小麦幼苗的根冠比与对照相比显著增大,随着SGO浓度的增加根冠比随之增加,到200 mg·L-1时达到最大,后又随浓度的增加逐渐下降,这与小麦根长先增加后降低的趋势保持一致。

图2 SGO对小麦根长、株高及根冠比的影响
2.2 SGO对小麦幼苗SOD活性的影响
2.3 SGO对小麦幼苗POD和CAT活性的影响
POD和CAT的反应底物都是H2O2,能够清除植物体内产生的H2O2,在抑制植物膜脂过氧化方面发挥着重要作用。它们的诱导说明植物体内产生了大量的H2O2,使植物体处于氧化应激状态。从图4可以看出,各浓度处理幼苗的根系POD活性显著低于对照,SGO浓度为200 mg·L-1时降到最低(相对于对照降低了26.5%)。叶片中200 mg·L-1浓度处理的POD活性比对照显著降低了18.1%,其余处理与对照相比均无显著差异,根中CAT活性除50 mg·L-1浓度较对照处理显著提高24.5%,其余各浓度处理均无明显差异,而叶中CAT活性相对于对照先降低后又逐渐升高。就总体趋势来看,2种酶活性在低浓度时降低(200 mg·L-1最低)后随浓度增大而升高。
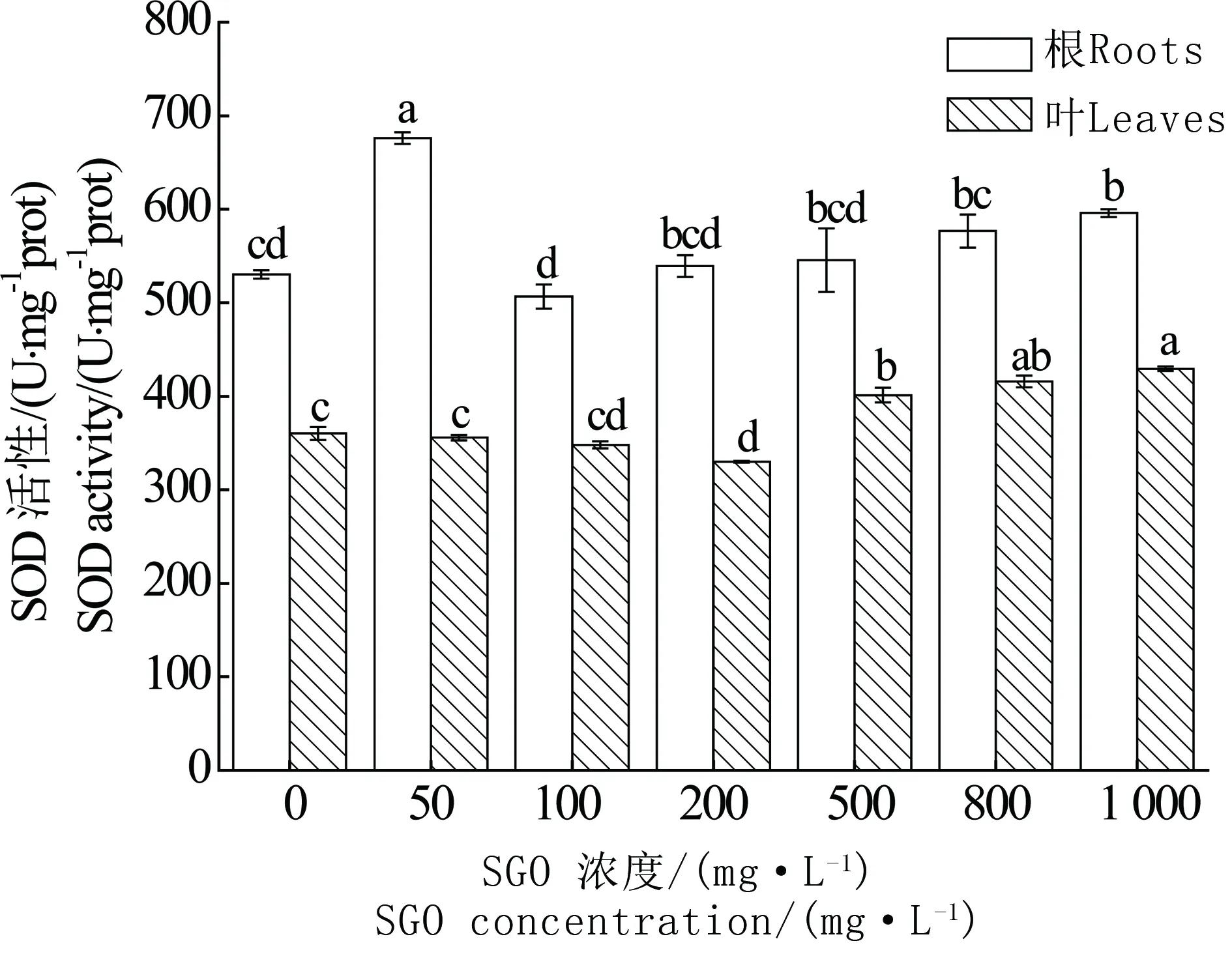
图3 SGO对小麦根系和叶片中SOD活性的影响
2.4 SGO对小麦幼苗MDA含量的影响
当植物受到比较严重的胁迫时,大量活性氧(ROS)会超过抗氧化酶系统的清除能力,活性氧自由基就会在植物体内积累导致脂质过氧化损伤。而MDA是膜质过氧化作用的重要产物之一,它的含量可表示膜质过氧化作用的损伤程度。如图5所示,低浓度(小于200 mg·L-1)时,根和叶中MDA含量逐渐降低,随着浓度的升高(大于200 mg·L-1),MDA含量又逐渐升高,但是与对照相比,各浓度处理均显著降低。
3 讨论(Discussion)
已有研究表明大部分纳米材料对植物生长具有毒害作用,而本研究结果与之相反。在所试浓度范围内,SGO能够明显促进小麦根系生长,增大根冠比,当浓度大于200 mg·L-1时,随浓度增大促进作用逐渐减弱,而地上部分与对照处理相比没有显著差异(图1)。这可能是由于SGO只是吸附到根系表面,因为植物的细胞壁和凯氏带对SGO进入细胞起阻碍作用。根系表面吸附的SGO可能会刺激根细胞的水通道蛋白,促进细胞吸水,提高细胞的含水量进而促进根细胞的各种代谢[15-16]。在幼苗凯氏带尚未形成时,可能有少量SGO通过细胞壁孔隙进入根细胞并经导管转移到地上部[17],但不足以对叶片生长产生影响,SGO进入细胞时由于机械力破坏了细胞壁膜结构导致细胞持水量增加[18],因而也能促进根系细胞的伸长。Wang等[19]的研究也发现氧化多壁碳纳米管(o-MWCNTs)能够显著促进根区细胞的伸长并增加脱氢酶的活性进而促进小麦根系的快速生长。

图4 SGO对小麦根系和叶片中POD和CAT活性的影响
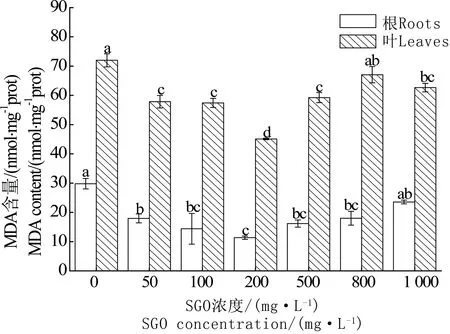
图5 SGO对小麦根系和叶片中MDA含量的影响
本实验结果表明,SGO胁迫对小麦的生长及酶活性产生了一定的影响,但对于不同浓度SGO对植物产生不同效应的内在机理还不是很清楚,这将是今后研究的重点。
致谢:感谢苏州高通新材料有限公司为本研究免费提供磺化石墨烯。
[1] Novoselov K S,Geim A K,Morozov S V,et al.Electric field effect in atomically thin carbon films [J].Science,2004,306: 666-669
[2] Ji L,Chen W,Xu Z,et al.Graphene nanosheets and graphite oxide as promising adsorbents for removal of organic contaminants from aqueous solution [J].Journal of Environmental Quality,2013,42(1): 191-198
[3] Zhang W X,Elliott D W.Applications of iron nanoparticles for ground water remediation [J].Remediation,2006,16: 7-21
[4] Klaine S J,Alvarez P J,Batley G E,et al.Critical review—Nanomaterials in the environment: Behavior,fate,bioavailability,and effects [J].Environmental Toxicology and Chemistry,2008,27(9): 1825-1851
[5] Roco M C,Mirkin C A,Hersam M C.Nanotechnology Research Directions for Societal Needs in 2020 [R].New York:Springer,Science Policy Reports,2011
[6] Yang K,Gong H,Shi X,et al.In vivobiodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administration [J].Biomaterials,2013,34(11): 2787-2795
[7] Zhang X,Yin J,Peng C,et al.Distribution and biocompatibility studies of graphene oxide in mice after intravenous administration [J].Carbon,2011,49 (3): 986-995
[8] Akhavan O,Ghaderi E.Toxicity of graphene and graphene oxide nanowalls against bacteria [J].ACS Nano,2010,4 (10): 5731-5736
[9] Liu S,Zeng T H,Hofmann M,et al.Antibacterial activity of graphite,graphite oxide,grapheme oxide,and reduced graphene oxide: Membrane and oxidative stress [J].ACS Nano,2011,5(9): 6971-6980
[10] Begum P,Fugetsu B.Induction of cell death by graphene in Arabidopsis thaliana (Columbiaecotype) T87 cell suspensions [J].Journal of Hazardous Materials,2013,260: 1032-1041
[11] Begum P,Ikhtiari R,Fugetsu B.Graphene phytotoxicity in the seedling stage of cabbage,tomato,red spinach,and lettuce [J].Carbon,2011,49: 3907-3919
[12] Naser A,Anjum N S,Manoj K S,et al.Single-bilayer graphene oxide sheet impacts and underlying potential mechanism assessment in germinating faba bean (Vicia faba L.) [J].Science of the Total Environment,2014,472: 834-841
[13] Amedea B,Seabra A J,Paula R L,et al.Nanotoxicity of graphene and graphene oxide [J].Chemical Research in Toxicology,2014,27(2): 159-168
[14] Melissa A,MaurerIan L,Gunsolus Catherine J,et al.Toxicity of engineered nanoparticles in the environment [J].Analytical Chemistry,2013,85: 3036-3049
[15] Horie T,Kaneko T,Sugimoto G,et al.Mechanisms of water transport mediated by PIP aquaporins and their regulation via phosphorylation events under salinity stress in barley roots [J].Plant and Cell Physiology,2011,52 (4): 663-675
[16] Hove R M,Bhave M.Plant aquaporins with non-aqua functions: Deciphering the signature sequences [J].Plant Molecular Biology,2011,75(4): 413-430
[17] Nowack B,Buchel T D.Occurrence,behavior and effects of nanoparticles in the environment [J].Environmental Pollution,2007,150(1): 5-22
[18] Akhavan O,Ghaderi E.Toxicity of graphene and graphene oxide nanowalls against bacteria [J].ACS Nano,2010,4(10): 5731-5736
[19] Wang X P,Han H Y,Liu X Q,et al.Multi-walled carbon nanotubes can enhance root elongation of wheat (Triticumaestivum) plants [J].Journal of Nanoparticle Research,2012,14: 841-851
[20] Gill S S,Tuteja N.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants [J].Plant Physiology Biochemistry,2010,48(12): 909-930
[21] Anjum N A,Ahmad I,Mohmood I,et al.Modulation of glutathione and its related enzymes in plants' responses to toxic metals and metalloids—A review [J].Environmental and Experimental Botany,2012,75: 307-324
[22] Cyren M R,Jie H,Maria I M,et al.Effect of cerium oxide nanoparticles on rice: A study involving antioxidant defense system and in vivo fluorescence imaging [J].Environmental Science & Technology,2013,47(11): 5635-5642
[23] Asada K.The water-water cycle in chloroplasts: Scavenging of active oxygens and dissipation of excess photons [J].Annual Review of Plant Physiology and Plant Molecular Biology,1999,50: 601-639[24] Wei X L,Ge Z Q.Effect of graphene oxide on conformation and activity of catalase [J].Carbon,2013,60: 401-409
◆
Effect of Sulfonated Graphene on Seedling Growth and Physiological and Biochemical Indices of Wheat
Chang Haiwei1,2,Ren Wenjie2,Liu Hongyan1,Teng Ying2,*,Li Lina2
1.College of Resource and Environmental Engineering,Guizhou University,Guiyang 550025,China 2.Key Laboratory of Soil Environment and Pollution Remediation,Institute of Soil Science,Chinese Academy of Sciences,Nanjing 210008,China
26 January 2015 accepted 13 May 2015
With the increasing consumption and production amount of graphene,its risk to ecological environment attracts growing concern of environmentalists.The effect of sulfonated graphene (SGO) on seedling growth,antioxidant enzyme activities and lipid peroxidation content of wheat was investigated based on hydroponic experiments.The results showed that sulfonated graphene at low concentrations significantly promoted wheat root length (P<0.05) after culturing for 10 d.Compared to the control treatment,the root length was increased by 84.3% at a concentration of 200 mg·L-1.However,the promotion effect gradually decreased as the concentration increased,and the root length was increased by 19.9% at a concentration of 1 000 mg·L-1.No obvious effect was observed on wheat shoot length.The activities of superoxide-dismutase (SOD),catalase (CAT),peroxidase (POD) and the content of malondialdehyde (MDA) in roots and leaves were decreased at first and then increased after 10 d.These indices at graphene concentrations below 200 mg·L-1were higher than those of the control treatment,indicating that sulfonated graphene did not generate oxidative stress at low concentrations,which may be due to the antioxidant capacity of sulfonated graphene.Sulfonated graphene generated oxidative stress at high concentrations,resulting in the increasing physiological and biochemical indices.These results have provided basic data for plant toxicology of graphene.
sulfonated graphene; wheat; antioxidant enzymes; MDA
国家自然科学基金青年基金(No.41401565)
常海伟,男,硕士研究生,研究方向为环境化学,E-mail: chw1207818533@163.com;
*通讯作者(Corresponding author),E-mail: yteng@issas.ac.cn
10.7524/AJE.1673-5897.20150126002
2015-01-26 录用日期:2015-05-13
1673-5897(2015)4-123-06
X171.5
A
滕应(1975- ),男,土壤学博士,研究员,主要从事污染土壤环境过程与生物修复、污染土壤微生物生态与风险评估、土壤污染化学生物学等方面研究。
常海伟,任文杰,刘鸿雁,等.磺化石墨烯对小麦幼苗生长及生理生化指标的影响[J].生态毒理学报,2015,10(4): 123-128
Chang H W,Ren W J,Liu H Y,et al.Effect of sulfonated graphene on seedling growth and physiological and biochemical indices of wheat [J].Asian Journal of Ecotoxicology,2015,10(4): 123-128 (in Chinese)
