广西钦州湾百年来红树林演变的有机碳同位素和孢粉示踪及其影响因素
2015-06-01夏鹏孟宪伟平爱平李珍
夏鹏,孟宪伟*,平爱平,李珍
(1.国家海洋局第一海洋研究所,山东青岛 266061;2.华东师范大学河口海岸学国家重点实验室,上海 200062)
广西钦州湾百年来红树林演变的有机碳同位素和孢粉示踪及其影响因素
夏鹏1,孟宪伟1*,平爱平1,李珍2
(1.国家海洋局第一海洋研究所,山东青岛 266061;2.华东师范大学河口海岸学国家重点实验室,上海 200062)
气候变化和人类活动制约下的红树林演变是一种长时间尺度效应,而沉积物则是记录这种响应的最佳档案。采用古生态学研究思路,选择有效的示踪参数是解读这一档案的有效途径。本文通过广西钦州湾红树林区1根柱状沉积物中有机碳同位素(δ13C)、C/N分析和孢粉鉴定,以沉积物中的红树林源有机碳贡献和红树植物孢粉组合为示踪参数,在210Pb年龄框架构建的基础上,通过对比研究红树林源有机碳贡献和红树孢粉组合特征,揭示百年来钦州湾红树林兴衰和群落演替规律;进而重塑其红树林演变历史:兴盛期(1864-1918年)、衰退期(1918-1968年)和低谷期(1968-2007年),这与土地替代、遥感分析和现场勘测数据较为吻合。结合气候变化和人类活动资料,发现钦州湾红树林的近期衰退主要源于人类活动的影响,尤其是虾塘围垦;而与气候变化关系不大。
红树林;有机碳同位素;孢粉;气候变化;人类活动
1 引言
高生产力的红树林生态系统[平均生产力(以碳计)2 500 mg/(m2·d)]覆盖了60%~75%的热带海岸线[1—2],占陆源碳输出入海量的11%和海洋埋藏总有机碳的15%[3—4],在近岸环境生物地球化学循环过程中起到了重要作用。此外,红树林可以拦截进入沿海的陆源营养物质、污染物和沉积物,减轻高负荷的人为输入[5]。红树林生态系统对气候变化、人类活动非常敏感[6—7],为了解当前乃至将来红树林生态系统对外界环境变化的响应,掌握历史时期红树林生态系统的兴衰演变规律是至关重要的[8]。高生产力和低泥沙呼吸速率相结合,使红树林沉积物有着长期封存有机碳的潜力[9]。埋藏的红树林有机遗骸化石,如花、果、叶和孢粉等,是用于红树林古生态重建的重要化石证据[10—11]。潮湿的红树林区沉积物易于形成厌氧环境,利于这些化石记录的长期保存[11]。
δ13C和C/N比值再辅以其他示踪剂(如:类脂化合物、氨基酸、木质素和长链烷烃等)已被广泛应用于近岸和河口沉积物中有机质来源的辨识[12—13],也被用于示踪食物链中红树林源有机质的转移路径[7,10]。然而,有机质来源的复杂性和早期成岩作用,致使不同端元的有机质同位素信号发生不同程度的改变[12—14]。沉积物中有机质来源的重塑仅反映被保存下来的残存有机组分,而非当初有机质的实际埋藏通量;例如,红树林碳比浮游藻类碳顽固,将会被优先保存[15—16]。而红树孢粉是示踪红树林沼泽沉积环境的独特指标,可以识别不同红树种群的群落演替特征[11,17]。因此,孢粉图谱有助于弥补有机碳同位素的某些限制[17—18],增加红树林古生态恢复的可靠性。但是,在红树林古生态恢复的国内外文献中,有机碳同位素和孢粉数据相互印证的研究却鲜有报道。
本文通过广西钦州湾红树林湿地的1根柱状沉积物中δ13C、TOC、TN分析以及孢粉鉴定,以沉积物中红树林源有机碳贡献和红树孢粉组合为示踪参数,在210Pb年龄框架构建的基础上,通过红树林源有机碳贡献和红树孢粉组合特征的对比研究,揭示百年来钦州湾红树林兴衰和群落演替规律,进而重塑其红树林演变历史;结合钦州湾气候变化和人类活动资料,建立百年来广西钦州湾红树林演变对气候变化和人类活动的响应关系。
2 样品采集与分析
2.1 样品采集
2007年4月27日,趁低潮时在钦州湾茅岭江口南侧的红树林沼泽外缘潮滩插管获取了3根80~90 cm长的柱状岩心,从中选取1根90 cm长且沉积连续的柱状岩心Q37作为研究对象(图1),其沉积类型以粉砂质砂(TS)为主。利用美国Trimble公司的DSM 212H双信标DGPS进行定位,平面定位精度优于1 m。在样品采集和运输的过程中尽量保持沉积物的原始状态。实验室内按2 cm间隔进行切割,子样品用于210Pb测年、有机碳同位素和孢粉等分析。同步采集Q37柱周边不同种类的红树植物叶片,用于红树林端元有机碳同位素的测定。
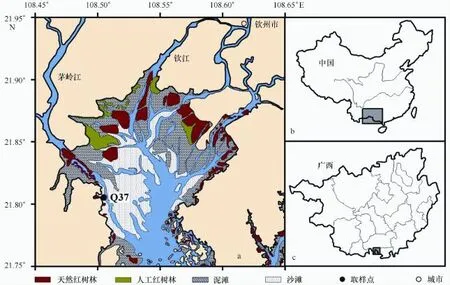
图1 区域背景和Q37柱的站位分布图Fig.1 Location of Maowei Sea and sampling site
2.2 分析方法
210Pb测年:对入管蜡封并放置3周的5 g干样进行210Pb、226Ra和137Cs的放射性比活度测试,采用EG&G Ortec公司生产的高纯锗低本底γ能谱仪完成[19];但由于沉积物中137Cs含量过低,均未超过检出限。分析工作在华东师大河口海岸国家重点实验室完成。李贞等[20]基于CIC模型计算了Q37柱的沉积速率为0.63 cm/a,时间跨度为143 a;由于岩芯顶部的年代为样品采集时间2007年,底层年代为1864年。
孢粉分析:每个样品取样5 g,经盐酸处理去碳酸钙后,用重液分离法使孢粉富集、制片。Leitz显微镜下放大250倍观察统计2个20 mm×20 mm盖玻片下的孢粉数量,作为该样品的化石丰度。对丰度在50粒/片以上的进行统计,计算属种个数和百分含量。参考图谱分别为《中国热带亚热带被子植物花粉形态》和《中国植物花粉形态》[21]。分析工作在华东师大河口海岸国家重点实验室完成。运用程序CONISS[22]进行聚类分析,并参考孢粉成分的相对变化来确定孢粉的组合带[20]。
TOC和TN分析:TOC(有机碳)和TN(总氮)分别利用重铬酸钾—硫酸氧化—硫酸亚铁法滴定法和重铬酸钾—硫酸消化—凯氏定氮法测试[23]。分析工作在国家海洋局第一海洋研究所海洋沉积与环境地质实验室完成。有机碳埋藏通量BForg的计算公式为:
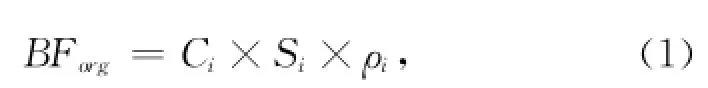
式中,BForg为有机碳埋藏通量[单位:mg/(cm·a)];Ci为有机碳含量(单位:mg/g);Si为沉积物累积速率(单位:cm/a);ρi为沉积物的干密度(单位:g/cm);i为沉积物某一层的深度(单位:cm)。
有机碳同位素分析:样品用清水洗净、晾干,先用1.5 mol/L盐酸处理以去除无机碳酸盐,置于烘箱中烘干(65℃),研磨过40目筛。研磨后的样品在Delta-PlusXP质谱仪(Thermo Scientific,Bremen,Germany)上进行碳同位素值测定,带元素分析仪(Flash EA1112,CE Instruments,Wigan,UK),燃烧温度为1 020℃。分析工作在中国农业大学资源与环境学院稳定同位素实验室完成,碳同位素值用国际PDB标准表示,平行样分析误差小于0.2‰。
3 结果
3.1 孢粉图谱
Q37柱中孢粉浓度变化范围介于4 536~17 076粒/g,表层孢粉浓度总体略低于底层。鉴定植物种类主要包括:(1)陆生木本植物(Pinus、Alnus、Morus、Cedrus、Meliaceae、Syzygium、Eucalyptus、Anacardiaceae、Engelhardia、Sapindus、Eurya、Cratoxylum、Castanopsis、Tetrameles、Mallotus、Rutaceae、Quercus、Liquidambar、Lonicera、Quercus、Hamamelidaceae);(2)半红树植物(Arenga、Malvaceae、Casuarina、Trachycarpus、Quisqualis);(3)红树植物(Bruguiera、Aegiceras、Rhizophora);(4)中生草本植物(Daphne、Loranthus、Poaceae、Piper、Euphorbia、Orchidaceae);(5)耐旱草本植物(Artemisia、Compositae、Chenopodium);(6)湿生/水生草本植物(Lilium、Cyperaceae、Acorus);(7)蕨类孢子(Gleicheniaceae、Cyatheaceae、Polypodiaceae、Pteridiaceae)。其中,草本植物类型的孢粉含量最高,介于36.2%~54.5%之间;其次是木本植物,介于21.5%~45.5%;蕨类孢子含量最少。孢粉组合的变化主要表现在针叶、热带雨林以及红树植物类型的变化,结合聚类分析结果,可划分为3个孢粉组合带(图2)。
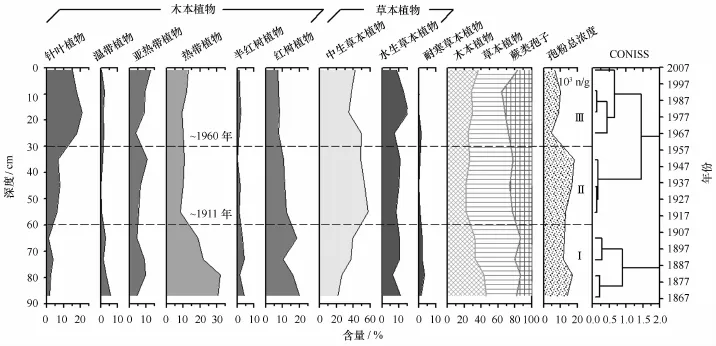
图2 Q37柱孢粉组合特征及其CONISS分带Fig.2 Pollen diagram and its three zones based on CONISS cluster analysis from Core Q37
孢粉Ⅰ带(88~60 cm,1864-1911年):该带以孢粉组合Gramineae-Cyatheaceae-Rhizophora-Eurya-Piper为主要特征,主要孢粉类型为木本植物,介于25.7%~53.6%;其中,红树花粉(10%~22%)和热带乔木花粉占主导位置,红树植物主要为R.stylosa(红海榄,3.6%~12.7%)和A.corniculatum(桐花树,4.5%~8.4%),B.gymnorrhiza(木榄)花粉主要出现在底部(图3)。热带乔木类花粉以Eurya(最大13.9%)、Mallotus(0~5.7%)和Piper(2.4%~9.5%)为主,Pinus的含量极低。草本植物类型中以禾本科为主,其花粉含量与木本相近,但是二者的变化趋势相反。耐盐的滨藜及蒿等也有少量呈现,表明沉积物固结程度较高。孢粉总浓度介于74 000~102 000粒/g,但蕨类孢子含量较低,反映了较弱的水动力环境。参照现代红树孢粉谱特征,表明该期区域植被以热带雨林为主;采样点应处于以红海榄为主的群落边缘,外缘有桐花树分布。
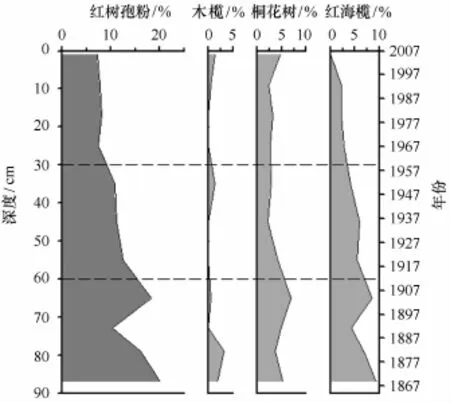
图3 红树植物孢粉图式Fig.3 Vertical distribution of mangrove species
孢粉Ⅱ带(60~30 cm,1911-1960年):该带以木本植物花粉含量降低、红树植物花粉锐减为主要特征,且草本植物花粉保持稳定高值;其孢粉组合为Gramineae-Cyatheaceae-Cyperaceae-Rhizophora-Polypodiaceae。孢粉Ⅱ带浓度比Ⅰ带略有增加,保持在较高水平;蕨类孢子也略有增加(尤其是Polypodiaceae和Cyatheaceae),反映了较弱的水动力环境。热带植物花粉类型多样性变化不大,但含量明显降低;针叶植物成分增加,其中Pinus占6.0%~7.0%。红树植物与半红树植物成分均相应减少,红海榄含量不足10%。而以Gramineae为主的中生草本植物含量增大,湿生/淡水生植物Cyperaceae增加至5.4%~8.3%。
孢粉Ⅲ带(30~0 cm,1960-2007年):孢粉组合特征为Gramineae-Pinus-Cyatheaceae-Cyperaceae-Polypodiaceae。孢粉总浓度锐减到24 000~52 000粒/g,而Pinus含量递增至18.4%~20.8%,蕨类孢子含量也达到最大,表明水动力强度明显增强。红树植物花粉降到最低值,伴随着桐花树增加和红海榄减少;但二者含量均不足5%,表明均由异地携入,非原生红树植物产生。与人类活动密切相关的Casuarina和Morus等人工防护林类型明显增加,而半红树种类和热带植物花粉类型均相应减少。草本植物中仍以Gramineae为主要成分,但含量略有降低,湿生/淡水生植物中的Cyperaceae、Lilium和Acorus明显增加。红树植物与半红树植物成分均减少,桐花树含量不足10%;而中生草本植物孢粉含量增大,增加至5.4%~8.3%。该孢粉组合反映了区域热带雨林减少和人类种植及次生林的增加,该区以红树林消退、水动力环境增强为主要变化特征。
综上所述,Q37柱总体反映了3段不同的沉积环境:(1)1864-1911年间,该区为红树林滩,群落优势种为红海榄和桐花树,且处于红树林群落内缘;(2)1911-1960年间,红树林滩呈现衰退趋势,伴随着草本植物的大量增加及区域植物类型的多样性增强,均反映出受河流影响增强的趋势[24];(3)1960-2007年间,孢粉总浓度迅速减少,而蕨类孢子和Pinus明显增加,反映出水动力环境有所增强[24—25],应与滩面上覆红树植物的减少有关。
3.2 有机碳同位素和C/N比
3.2.1 端元值的确定
钦州湾潮间带沉积物中埋藏的有机碳具有多源性,如陆源、红树林源和海洋生物源;因此选择合适的参数(δ13C和C/N)定量分离出沉积物中红树林源有机碳的贡献成为利用红树林源有机碳贡献示踪红树林演变的关键。而δ15N同位素不适于示踪有机质来源的主要原因是15N易于沿食物链富集[26-27]以及富15N农业和城镇废水的排放[28-29]。3个不同端元有机质之间的δ13C和C/N比值存在着明显差异(见图4a),这是定量分离沉积物中有机质来源的先决条件之一。对不同红树植物叶片(即桐花树、秋茄、木榄和红海榄)的δ13C或C/N进行两两T检验,p均小于0.05,表明不同红树植物的δ13C或C/N不存在显著差异;可以组合在一起计算红树林源有机碳的端元值。
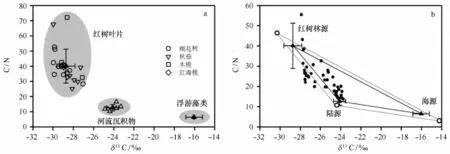
图4 三端元有机碳的δ13C和C/N散点分布(a)和Q37柱中有机碳的三端元解析图(b)Fig.4 δ13C and C/N for three end member samples(a),andδ13C and C/N in ternary mixing diagrams for mangrove,terrestrial OM and phytoplankton(b)
红树植物叶片的δ13C(-28.75‰±0.89‰)和C/N(40.15±11.18)值与肯尼亚[31]和墨西哥湾[30]的红树植物叶片δ13C和C/N较为一致。然而,相比红海榄(δ13C:-29.14‰±0.46‰,C/N:40.15±0.15)、桐花树(δ13C:-29.13‰±0.90‰,C/N∶40.13± 7.44)和秋茄(δ13C:-28.35‰±0.85‰,C/N:37.38 ±13.11),木榄有着较高的δ13C和C/N值(δ13C:-28.39‰±0.88‰,C/N:45.75±18.12;图4a)。陆源有机碳的平均δ13C(-24.12‰±0.60‰)和C/N比(12.76±2.11)与珠江上游表层沉积物(δ13C:-24.9‰±1.0‰,C/N:13.3±1.4)[32]的较为接近,源于河床沉积物相似的物源背景。本次选取南海北部陆坡浮游植物的平均δ13C(-16.05‰±0.82‰)和C/N比(6.46±0.10)作为对海洋生物源有机碳的端元值[32—33]。
3.2.2 有机碳来源解析
Q37柱中δ13C、TOC、TN、C/N摩尔比和BForg的垂向分布特征如图5a~d所示。TOC、TN、C/N和BForg的变化趋势较为一致,两两之间保持高度正相关关系;其中,TOC-TN、TOC-C/N和TOC-BForg的相关系数分别为0.85(P<0.01)、0.83(P<0.01)和0.99(P<0.01)。而δ13C与TOC、TN、C/N、BForg的变化趋势恰好相反,即较重的δ13C值对应较低的TOC含量;其中,δ13C-TOC和δ13C-C/N的相关系数分别为-0.84(P<0.01)和-0.76(P<0.01)。
基于Q37柱中δ13C-C/N的三端元散点分布特征(图4b),78%的样品点落于10%耐受水平下的三角区域内,表明可用三端元计算公式[34]来解释。其余落于三角区域外的10个样品点多位于深层沉积物中,其埋藏有机质可能受早期成岩作用的影响发生轻微改变[12,14,35];可用邻近两端元来近似解释[34]。结合210Pb年代框架,可将红树林源有机碳贡献大致划分为3个阶段:
阶段Ⅰ(89~56 cm,1864-1918年):沉积物具有较高的TOC和TN含量,均值分别为1.51%和0.06%,且其含量自下往上递减趋势明显;而δ13C的表现相对稳定,介于-27.89‰~-25.59‰(均值-27.34‰)。该段有机碳的埋藏通量较高,平均有机碳埋藏通量为12.15 mg/(cm2·a)[6.76~22.14 mg/(cm2·a)]。红树林源有机碳贡献处于高值区,平均贡献为81.45%,其次为陆源;即高含量的有机碳主要源于红树林的贡献。
阶段Ⅱ(56~24 cm,1918-1965年):TOC和TN含量明显递减,均值分别为0.66%和0.03%,总体呈现“先减后增”的轻微变化趋势;而δ13C递增趋势明显,介于-26.72‰~-23.89‰(均值-25.05‰)。该段有机碳的平均埋藏通量为5.88 mg/(cm2·a)[2.62~10.15 mg/(cm2·a)],埋藏通量较之阶段Ⅰ减少了50%以上。该段陆源、红树林源和海源有机碳的平均贡献分别为50.00%、30.92%和19.08%;由于陆源有机碳的入海量年际变化不大,有机碳埋藏通量的大幅减少应与红树林源有机碳的减少有关。
阶段Ⅲ(24~0 cm,1965-2007年):TOC和TN含量保持在较低水平上,均值分别为0.42%和0.03%;而δ13C介于-25.42‰~-23.75‰(均值-24.33‰)。该段有机碳的平均埋藏通量为3.95 mg/(cm2·a)[2.62~7.92mg/(cm2·a)],埋藏通量较之阶段Ⅱ减少了30%以上。该段陆源、红树林源和海源有机碳的平均贡献量分别为63.93%、12.85%和23.22%;有机碳埋藏通量的持续减少主要源于红树林源有机碳的减少。
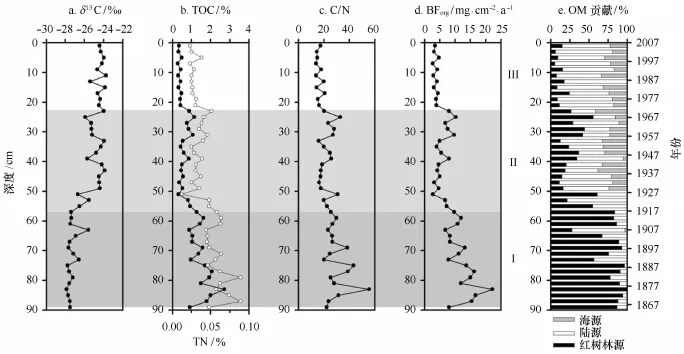
图5 Q37柱中δ13C(a),TOC(实心)和TN(空心)(b),C/N摩尔比(c),BForg(d),有机碳贡献(e)的垂向分布特征Fig.5 Vertical distributions ofδ13C(a),TOC(filled circles)and TN(empty circles)(b),C/N(c),BForg(d)and% OM source and depth(e)
4 讨论
4.1 基于红树孢粉和有机碳同位素综合示踪红树林演变
由于有机碳同位素复杂的物源特征及其可能受早期成岩作用或有机质降解作用的影响,在单独示踪红树林演变时存在弊端;需要与更直观指示红树林生长状态的红树花粉含量进行相互印证[11]。为了研究红树林源有机碳贡献(见图6a)与红树植物花粉变化趋势是否一致(见图6b),基于最小二乘法的线性回归被广泛应用于调查两个变量间的关系(见图6c)。研究表明:二者之间呈显著正相关(r=0.80,P<0.01),且散点均落于95%预测区间内;表明有机碳同位素在示踪历史时期红树林演变阶段时取得与红树花粉一致的结论。因此,红树林生长演化可以划分为3个阶段:兴盛期(1864-1918年)、衰退期(1918-1968年)和低谷期(1968-2007年)。这与土地替代、遥感分析和现场实测同期数据较为吻合:广西海岸曾经有23 904 hm2红树林,是现存面积的近3倍[36];但到解放后的1955年减少了61%,仅剩下9 351.2 hm2[37];自1955年以后红树林面积急速下降,到1988年广西红树林面积下降到1955年的50%,即4 671.4 hm2[37]。
4.2 与气候变化和人类活动的关系
近年来,红树林生态系统受气候变化和人类活动的影响严重[6];为了查清红树林衰退(见图7a~b)与二者之间的相互关系,本文选用了气温、降雨量和日照时数(见图7e~g)作为气候因子以及围填海面积和海堤长度(见图7c~d)作为人类活动因子进行对比研究。研究发现:近50年来的气温具有十年际变化趋势,一个周期约15 a,与太平洋十年涛动(PDO)[38]类似,且呈逐年递增的趋势;日照时数却呈逐年减少的趋势;而降雨量年际增减趋势不明显。显然,气温和日照时数的轻微变化不是造成红树林大幅衰退的主要原因。而近期记录的钦州湾围填海面积和海堤长度总体呈快速递增趋势,尤其是虾塘面积;这与范航清[36]记录的红树林区虾塘围垦是导致近期红树林生态系统快速衰退的主要原因相吻合。
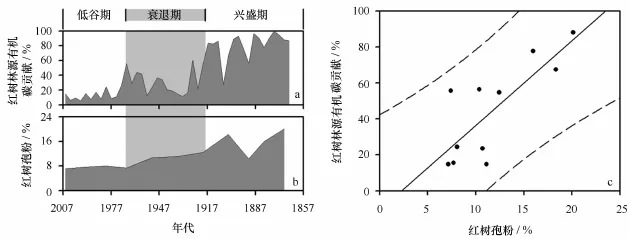
图6 红树林源有机碳贡献(a)和红树花粉的年际变化(b)及其散点关系图(c)Fig.6 Mangrove-derived OM contribution(a),mangrove pollen content(b),and its scatter plots(c)
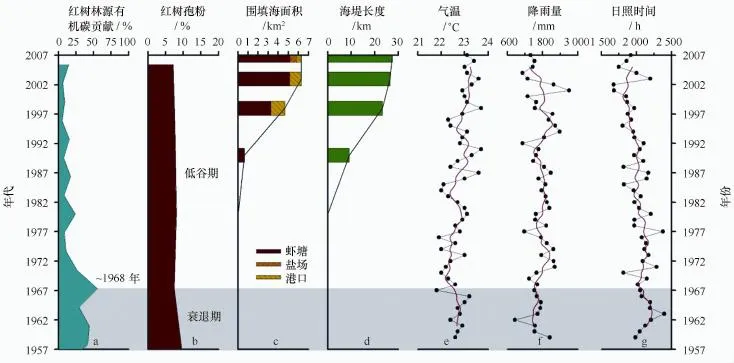
图7 红树林演化(a、b)与人类活动(c、d)和气候变化(e~g)的关系Fig.7 Mangrove development(a,b)and its relationship with anthropogenic activity(c,d)and climate change(e,g)
5 结论
由于孢粉数据难于准确定量和有机碳同位素复杂的物源特征及其受早期成岩作用的影响,它们在单独示踪近期红树林演化状况时互有利弊。因此,本文以沉积物中红树林源有机碳贡献和红树植物孢粉组合为示踪参数,在210Pb年代框架和有机碳端元值构建的基础上,通过红树林源有机碳贡献和红树植物孢粉组合变化的对比研究,相互印证并揭示了近150年来钦州湾红树林兴衰和群落演替规律。进而将钦州湾红树林的演化划分为3个阶段:兴盛期(1864-1918年)、衰退期(1918-1968年)和低谷期(1968-2007年),这与土地替代、遥感分析和现场实测数据相吻合。并结合气候变化和人类活动资料,发现近期钦州湾红树林衰退主要源于人类活动的影响,尤其是虾塘围垦;而与气候变化关系不大。
致谢:中国农业大学王国安教授、华东师范大学李贞、国家海洋局第一海洋研究所王湘芹、杨刚、朱志伟等参加了现场观测、样品采集和分析工作,在此一并感谢!
[1] Clough B.Mangrove forest productivity and biomass accumulation in Hinchinbrook Channel,Australia[J].Mangroves and Salt Marshes,1998,2:191-198.
[2] Jennerjahn T C,Ittekkot V.Relevance of mangroves for the production and deposition of organic matter along tropical continental margins[J].Naturwissenschaften,2002,89:23-30.
[3] Alongi D M.The dynamics of benthic nutrient pools and fluxes in tropical mangrove forests[J].Journal of Marine Research,1996,54:123-148.
[4] Lee S Y.Mangrove outwelling:a review[J].Hydrobiologia,1995,295:203-212.
[5] Valiela I,Cole M L.Comparative evidence that salt marshes and mangroves may protect seagrass meadows from land-derived nitrogen loads[J].E-cosystems,2002,5:92-102.
[6] Alongi D M.Mangrove forests:resilience,protection from tsunamis,and responses to global climate change[J].Estuarine,Coastal and Shelf Science,2008,76:1-13.
[7] Chong V C,Low C B,Ichikawa T.Contribution of mangrove detritus to juvenile prawn nutrition:a dual stable isotope study in a Malaysian mangrove forest[J].Marine Biology,2001,138:77-86.
[8] Valiela I,Bowen J L,York J K.Mangrove forests:one of the world's threatened major tropical environments[J].Bioscience,2001,51:807-815.
[9] Kristensen E,Bouillon S,Dittmar T,et al.Organic carbon dynamics in mangrove ecosystems:A review[J].Aquatic Botany,2008,89:201-219.
[10] Bouillon S,Connolly R M,Lee S Y.Organic matter exchange and cycling in mangrove ecosystems:recent insights from stable isotope studies[J].Journal of Sea Research,2008,59:44-58.
[11] Ellison JC.Long-term retrospection on mangrove development using sediment cores and pollen analysis:A review[J].Aquatic Botany,2008,89:93-104.
[12] Graham M C,Eaves M A,Farmer JG,et al.A study of carbon and nitrogen stable isotope and elemental ratios as potential indicators of source and fate of organic matter in sediments of the Forth Estuary,Scotland[J].Estuarine,Coastal and Shelf Science,2001,52:375-380.
[13] Yamamuro M.Chemical tracers of sediment organic matter origins in two coastal lagoons[J].Journal of Marine Systems,2000,26:127-134.
[14] Fourqurean J W,Schrlau J E.Changes in nutrient content and stable isotope ratios of C and N during decomposition of seagrasses and mangrove leaves along a nutrient availability gradient in Florida Bay,USA[J].Chemistry and Ecology,2003,19,373-390.
[15] De Boer W.Biomass dynamics of seagrasses and the role of mangrove and seagrass vegetation as different nutrient sources for an intertidal ecosystem[J].Aquatic Botany,2000,66:225-239.
[16] Holmer M,Olsen A B.Role of decomposition of mangrove and seagrass detritus in sediment carbon and nitrogen cycling in a tropical mangrove forest[J].Marine Ecology Progress Series,2002,230:87-101.
[17] Wooller M J,Swain D L,Ficken K J,et al.Late Quaternary vegetation changes around Lake Rutundu,Mount Kenya,East Africa:evidence from grass cuticles,pollen and stable carbon isotopes[J].Journal of Quaternary Science,2003,18(1):3-15.
[18] Ficken K J,Wooller MJ,Swain D L,et al.Reconstruction of a sub-alpine grassdominated ecosystem,Lake,Rutundu,Mount Kenya:a novel multiproxy approach[J].Palaeogeography,Palaeoclimatology,Palaeoecology,2002,177:137-150.
[19] San Miguel E G,Bolívar J P,García-tenorio R.Vertical distribution of Th-isotope ratios,210Pb,226Ra and137Cs in sediment cores from an estuary affected by anthropogenic releases[J].Science of the Total Environment,2004,318:143-157.
[20] 李贞,李珍,张卫国,等.广西钦州湾海岸带孢粉组合和沉积环境演变[J].第四纪研究,2010,30(3):598-608.
Li Zhen,Li Zhen,Zhang Weiguo,et al.Pollen assemblage and sedimentary environment evolution in the coastal zone in Qinzhou Bay,Guangxi province[J].Quaternary Sciences,2010,30:598-608.
[21] 王伏雄,钱南芬,张玉龙,等.中国植物花粉形态[M].北京:科学出版社,1995.
Wang Fuxiong,Qian Nanfen,Zhang Yulong,et al.Pollen morphology of Chinese plant[M].Beijing:Science Press,1995.
[22] Grimm E C.Coniss:A Fortran 77 program forstratigra phically constrained cluster analysis by method of incremental sum of squares[J].Computers&Geosciences,1987,13:13-35.
[23] 刘建军,吴敬禄.太湖大浦湖区近百年来湖泊记录的环境信息[J].古地理学报,2006,8(4):559-564.
Liu Jianjun,Wu Jinglu.Environmental information of recent 100 years recorded sediments of Dapu area in Taihu Lake[J].Journal of palaeogeography,2006,8:559-564.
[24] Van Der Kaars S.Pollen distribution in marine sediments from the south-eastern Indonesian waters[J].Palaeogeography,Palaeoclimatology,Palaeoecology,2001,171:341-361.
[25] Hooghiemstra H,Lézine A M,Leroy S A G,et al.Late Quaternary palynology in marine sediments:A synthesis of the understanding of pollen distribution patterns in the NW African setting[J].Quaternary International,2006,148:29-44.
[26] Cole M L,Valiela I,Kroeger K D,et al.Assessment of aδ15N isotopic method to indicate anthropogenic eutrophication in aquatic ecosystems[J].Journal of Environmental Quality,2004,33:124-132.
[27] Kwak T J,Zedler JB.Food web analysis of southern California coastal wetlands using multiple stableisotopes[J].Oecologia,1997,110(2):262-277.
[28] Mutchler T,Dunton K H,Townsend-small A,et al.Isotopic and elemental indicators of nutrient sources and status of coastal habitats in the Caribbean Sea,Yucatan Peninsula,Mexico[J].Estuarine Coastal and Shelf Sciences,2007,74:449-457.
[29] Savage C.Tracing the influence of sewage nitrogen in a coastal ecosystem using stable nitrogen isotopes[J].Ambio,2005,34(2):145-150.
[30] Gonneeaa M E,Paytana A,Herrera-silveira J A.Tracing organic matter sources and carbon burial in mangrove sediments over the past 160 years[J].Estuarine,Coastal and Shelf Science,2004,61:211-227.
[31] Rao R G,Woitchik A F,Goeyens L,et al.Carbon,nitrogen contents and stable carbon isotope abundancein mangrove leaves from an East-African coastal lagoon(Keyna)[J].Aquatic Botany,1994,7:175-183.
[32] He B,Dai M,Huang W,et al.Sources and accumulation of organic carbon in the Pearl River Estuary surface sediment as indicated by elemental,stable carbon isotopic,and carbohydrate compositions[J].Biogeosciences,2010,7:3343-3362.
[33] 侯秀琼.流沙湾海洋生物稳定碳氮同位素应用的初步研究[D].湛江:广东海洋大学,2009:16-17.
Hou Xiuqiong.Preliminary study on marine species in Liusha Bay by using stable carbon and nitrogen isotopes[D].Zhanjing:Guangdong Ocean University,2009,16-17.
[34] Dittmar T,Lara R J,Kattner G.River or mangrove?Tracing major organic matter sources in tropical Brazilian coastal waters[J].Marine Chemistry,2001,73:253-271.
[35] Yamamuro M,Kayanne H.Rapid direct determination of organic carbon and nitrogen in carbonate-bearing sediments with a Yanaco MT-5 CHN analyzer[J].Limnology and Oceanography,1995,40(5):1001-1005.
[36] 范航清.广西海岸红树林现状及人为干扰[M]//范航清,梁士楚.中国红树林研究与管理.北京:科学出版社,1995.
Fan Hangqing.Mangroves status and factitious disturbance in the coast of Guangxi[M]//Mangroves Study and Management in China.Beijing:Science Press,1995,189-202.
[37] 黄鹄,戴志军,胡自宁,等.广西海岸环境脆弱性研究[M].北京:海洋出版社,2005.
Huang Hao,Dai Zhijun,Hu Zining,et al.Study on the coastal environmental vulnerability in Guangxi[M].Beijing:China Ocean Press,2005.
[38] Mantua N J,Hare S R,Zhang Y,et al.A Pacific decadal climate oscillation with impacts on salmon[J].Bulletin of the American Meteorological Society,1997,78:1069-1079.
Historical retrospection on mangrove development using stable carbon isotopes and pollen analysis,and its response to climate change and human activity
Xia Peng1,Meng Xianwei1,Feng Aiping1,Li Zhen2
(1.First Institute of Oceanography,State Oceanic Administration,Qingdao 266061,China;2.State Key Laboratory of Estuarine and Coastal Research,East China Normal University,Shanghai 200062,China)
Mangrove evolution is the long time-scale process under the condition of climate change and human activity,and is clearly recorded by the surrounding sediments.It is a new palaeoecological approach to trace mangrove evolution using organic carbon isotopes and mangrove pollen from sedimentary records.In the study,a sediment core was collected from a mangrove swamp of the Qinzhou Bay,Guangxi.Based on the three end-number model,δ13C and C/N analysis were used to calculate the contribution of mangrove-derived organic carbon.Compared with mangrove pollen assemblage and210Pb dating,it revealed the temporal evolution of mangrove development and its community succession in the recent 150 years.The mangrove evolution could be divided into three major stages:flourish(1864-1918 A.D.),degradation(1918-1968 A.D.)and low-level period(1968-2007 A.D.),which was consistent with the previous reports.An significantly degradation in mangrove ecosystem recently corresponded to the increase of reclamation area(especially for the shrimp-pond reclamation)and artificial seawalls,rather than the climate change as recorded in the region.
mangrove;carbon;isotope;pollen;climate change
P736.4
A
0253-4193(2015)03-0077-09
夏鹏,孟宪伟,丰爱平,等.广西钦州湾百年来红树林演变的有机碳同位素和孢粉示踪及其影响因素[J].海洋学报,2015,37(3):77—85,
10.3969/j.issn.0253-4193.2015.03.008
Xia Peng,Meng Xianwei,Feng Aiping,et al.Historical retrospection on mangrove development using stable carbon isotopes and pollen analysis,and its response to climate change and human activity[J].Haiyang Xuebao,2015,37(3):77—85,doi:10.3969/j.issn.0253-4193.2015.03.008
2014-02-26;
2014-06-29。
国家自然科学基金(41206057,41376075);973计划(2010CB951203);中央级公益性科研院所基本科研业务费专项资金(2012G18);国家海洋局青年基金(2013326)。
夏鹏(1982—),男,山东省潍坊市人,副研,博士,从事海洋地球化学研究。E-mail:pengxia@fio.org.cn
*通信作者:孟宪伟(1963—),男,辽宁省辽中县人,研究员,博士,从事同位素地球化学研究。E-mail:mxw@fio.org.cn
