亚抑菌浓度的抗生素对金黄色葡萄球菌杀白细胞素表达及释放的影响
2015-06-01徐元宏
王 璐,徐元宏
亚抑菌浓度的抗生素对金黄色葡萄球菌杀白细胞素表达及释放的影响
王 璐1,2,徐元宏1
目的观察亚抑菌浓度抗生素对金黄色葡萄球菌(金葡菌)杀白细胞素(PVL)表达的影响。方法利用PCR筛选出8株PVL阳性金葡菌。常量稀释法测定克林霉素、替加环素、利奈唑胺和万古霉素最低抑菌浓度值(MIC);荧光定量PCR测定前3种抗生素对PVL阳性金葡菌在1/8、1/4、1/2 MIC作用下PVLmRNA相对变化。ELISA法测定4种抗生素1/4、1/2 MIC时PVL蛋白含量。结果克林霉素、利奈唑胺和替加环素在1/8、1/4、1/2 MIC时均可降低PVL表达。PVL mRNA在3种抗生素作用下分别降低17%~82%、8%~85%和11%~78%;PVL蛋白水平在1/4、1/2 MIC克林霉素和利奈唑胺作用下,分别下降了65%和83%、40%和61%,替加环素仅1/2 MIC时降低较明显,达64%。万古霉素不影响PVL表达。结论不同抗生素亚抑菌浓度时对PVL表达影响不同。克林霉素和利奈唑胺可明显降低PVL表达,且呈剂量依赖性,替加环素只在较高浓度时抑制PVL表达,万古霉素对PVL表达无影响。
金黄色葡萄球菌;杀白细胞素;亚抑菌浓度
金黄色葡萄球菌(简称金葡萄)是一种可产生多种毒素因子并导致人类感染的革兰阳性球菌。这些毒素中有一种被称为杀白细胞素(paton-valentine leukocidin,PVL)的毒力因子,可以引起包括皮肤软组织感染、坏死性骨髓炎以及病死率极高的坏死性肺炎[1-3]等在内的各种疾病。而且,近几年来不断涌现出关于检测出PVL的报道,说明PVL阳性的金葡菌已经在世界范围内播散开来。随着金葡菌耐药性的日益增强,临床上治疗金葡菌感染的抗生素选择范围也越来越窄,找到可抑制其毒力因子(如PVL)表达释放的抗生素,将为临床治疗金葡菌感染或是缓解患者感染症状提供一个新的思路。
1 材料与方法
1.1 材料
1.1.1 菌株 2013年10月~2014年10月安徽医科大学第一附属医院从住院患者送检的各种标本分离的385株金黄色葡萄球菌。其中耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)160株,甲氧西林敏感金黄色葡萄球菌(methicillin sensitive Staphylococcus aureus,MSSA)225株。PVL阴性和PVL阳性标准菌株(CCUG46923)均由安徽省立医院检验科马筱玲教授惠赠。
1.1.2 试剂和仪器设备 VITEK32全自动微生物分析仪(法国生物梅里埃公司);Biometra-Tgradient PCR扩增仪(德国Biometra公司);DYY-10C凝胶电泳仪(北京六一仪器厂);NanoDrop 2000浓度仪(美国Thermo Scientific公司);ABI 7300荧光定量分析仪(美国应用生物公司);PCR引物由上海生工生物工程技术服务有限公司合成;克林霉素(clindamycin,CLI)、利奈唑胺(linezolid,LZD)购自美国Sigma公司;替加环素(tigecycline,TGC)以及万古霉素(vancomycin,VAN)购自美国Cayman公司;酪蛋白水解酵母提取物培养基(casein hydrolysate-yeast extractmedium,CCY)肉汤细菌总RNA提取纯化试剂盒(上海生工生物工程股份有限公司);SYBR®Premix Ex Taq试剂盒(日本TaKaRa公司);ELISA试剂盒(美国CLOUD-CLONE公司)。
1.1.3 引物设计与合成 根据文献[4]报道设计引物序列,由上海生工生物工程技术服务有限公司合成引物。gyrB上游引物:GGTGGCGACTTTGATCTAGC;gyrB下游引物:TTATACAACGGTGGCTGTGC;Luk-pv-F:AATAACGTATGGCAGAAATA TGGATGT;Luk-pv-R:CAAATGCGTTGTGTATTCTA GATCCT。
1.2 方法
1.2.1 DNA提取 采用普通加热法粗提DNA,取200μl TAE缓冲液加入到高压灭菌过的1.5 ml EP管中,挑取血平板18~24 h培养的金黄色葡萄球菌菌落3~4个,充分研磨,再加入溶葡萄球菌素10 μl,干式恒温器100℃加热15 min,快速冷却10 min,在低温高速离心机中以15 000 r/min离心5 min,将上清液转移至高压灭菌过的EP管中,-20℃保存备用。
1.2.2 聚合酶链反应(PCR) 总反应体积为50 μl,10×缓冲液5μl,Taq酶0.25μl dNTP 3μl,引物各1μl,模板3μl,加灭菌去离子水至50μl,反应条件:95℃初变性10 min,94℃变性30 s,55℃退火30 s,72℃延伸1 min,30个循环后,72℃延伸6 min。PCR产物置4℃冰箱保存。
1.2.3 凝胶电泳 电子天平称取0.3 g琼脂糖,加入30 ml TAE缓冲液,微波炉加热煮沸2 min,加入溴化乙锭(ethidium bromide,EB)液3μl,配成1%的琼脂糖凝胶进行电泳,110 V、25 min后置凝胶成像仪中观察结果。
1.2.4 金葡菌MIC值的测量 按照CLIS操作规程采用常量稀释法测金葡菌最低抑菌浓度(minimum inhibitory contentration,MIC)值。
1.2.5 亚抑菌耐药的诱导 挑取血琼脂平板上经37℃培养24 h的菌落用水解酪蛋白(MH)肉汤稀释(添加有50 mg/L的钙离子和12.5 mg/L的镁离子),浊度调整为0.5麦氏标准。上述菌液于37℃、300 r/min条件下振荡培养。当菌液的光密度(optical density,OD)值达2.0麦氏浊度时,将配置好的1/2、1/4、1/8 MIC的克林霉素、利奈唑胺、替加环素和万古霉素加入玻璃培养管中,与未加抗生素的(正常对照组)菌液于37℃条件下振荡培养。孵育6 h后达到最佳生长浓度时取样,进行下一步试验。
1.2.6 荧光定量PCR 按上海生工细菌总RNA提取试剂盒说明书提取总RNA。cDNA合成及实时荧光定量PCR:取上述方法提取的总RNA 2μg,用TaKaRa SYBR®Premix Ex TaqTM试剂盒分别进行逆转录。PVL为目的基因,gyrB为内参基因[4]。按SYBR®Premix Ex Taq试剂盒说明书用荧光染料嵌合法同时检测PVL和gyrB表达水平,以PVL/gyrB比值反映PVL mRNA表达水平的高低。反映在ABI7300实时荧光PCR仪上进行,试验重复3次。
1.2.7 ELISA法定量测定PVL ELISA法分别测量8株PVL阳性金葡菌在无抗生素及亚抑菌抗生素浓度(1/4、1/2 MIC)时的PVL含量。取含上述亚抑菌耐药菌株的肉汤,10 000 r/min离心10 min,取上清液,进行ELISA(按说明书操作)实验,在450 nm波长测量各孔的OD值,每份样本均设置2个复孔。将各抗生素浓度时的PVL含量(μg/L)与无抗生素时测得的含量(μg/L)进行比较(试验进行3次取平均值)。
1.3 统计学处理应用SPSS 12.0软件进行分析,采用One-Way ANOVA及两两比较方法Dunnett-t检验。
2 结果
2.1 金葡菌PVLPCR产物扩增结果用PCR法检测385株金葡菌,显示3株MRSA和5株MSSA在433 bp处有明显单一条带,PCR产物测序结果证实,8株金葡菌均为PVL阳性。见图1。
2.2 8株PVL阳性的金葡菌MIC值测定对上述PVL阳性菌进行MIC值测定,CLIMIC:0.13~16 mg/L;TGCMIC:0.063~0.250 mg/L;LZD MIC:0.5~2 mg/L;VAN MIC:0.5~2 mg/L。见表1。
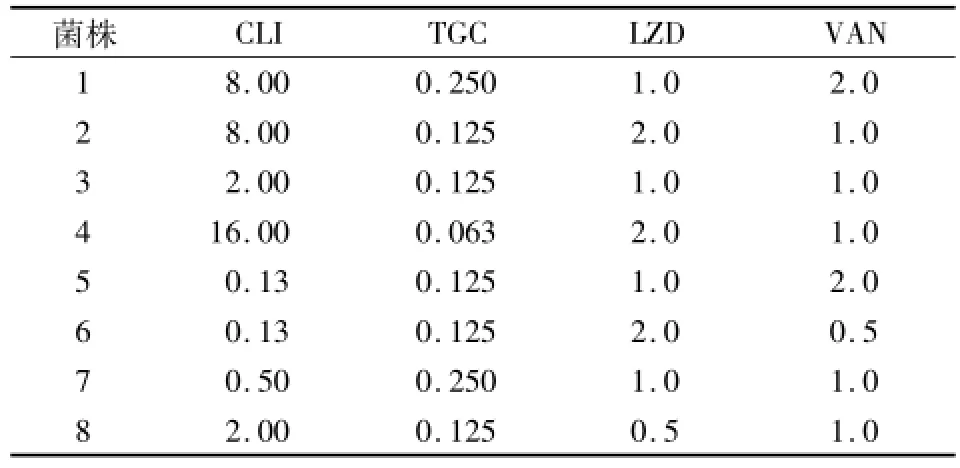
表1 8株PVL阳性金葡菌在CCY肉汤中的M IC值(mg/L)
2.3 抗生素对PVLmRNA表达的影响经由8株PVL阳性菌进行测试,孵育6 h,克林霉素和利奈唑胺从1/8 MIC、1/4 MIC到1/2 MIC对PVLmRNA表达具有很强的剂量依赖性降低作用,克林霉素降低水平从17%~82%不等,利奈唑胺降低了8%~85%不等。替加环素对6株的PVL mRNA表达具有抑制作用,可降低11%~78%,其中2株金葡菌在1/8 MIC浓度时,PVL mRNA表达量反而轻微增加。1/4 MIC(克林霉素F=1.92、利奈唑胺F=2.45);1/2 MIC(克林霉素F=2.05、利奈唑胺F=1.11、替加环素F=1.27);1/8 MIC替加环素(F=3.13)。万古霉素对PVLmRNA表达无影响。见图2。其中,1/8 MIC TGC,1/4 MIC CLI、LZD、TGC和1/2 MIC CLI、LZD、TGC相较于无抗生素组,差异有统计学意义。
2.4 不同亚MIC浓度下PVL阳性金葡菌PVL蛋白含量变化克林霉素和利奈唑胺在1/4 MIC和1/2 MIC及替加环素的1/2 MIC时相较于无抗生素时,PVL含量的变化有统计学意义(P<0.05):1/4 MIC(克林霉素F=1.02、利奈唑胺F=2.45);1/2 MIC(克林霉素F=0.85、利奈唑胺F=2.11、替加环素F=1.97)。万古霉素作用下,PVL蛋白含量无变化。见图3、4。
3 讨论
亚抑菌浓度的抗生素可以调控金葡菌毒力因子的表达,影响金葡菌所致感染疾病的转归。有学者进行体内PVL试验,结果表明PVL可以影响坏死组织部位的最低抑菌浓度形成障碍,从而有碍于病原菌的清除和感染灶的修复。因此本次试验测定亚抑菌浓度抗生素对PVL表达的影响,以期对严重感染的临床用药及日后转归提供一个新的思路。
经检测385株金葡菌,其中PVL基因阳性有8株,阳性率为2.1%。稍低于同地区李春等[5]的4.9%。可能本次研究的菌株均是来源于医院获得性金葡菌(hospital acquired Staphylococcus aureus,HA-SA),而李春等[5]选用的标本还包括了社区获得性金葡菌(community-associated methicillin-resistance Staphylococcus aureus,CA-MRSA),现在已有普遍报道指出CA-MRSA中PVL阳性率远远高于HAMRSA[6-7]。本次实验显示,160株MRSA中检出PVL阳性菌株3株,阳性率为1.9%,225株MSSA中有5株PVL阳性菌株,阳性率为2.2%。
本次实验选用了8株分离自临床标本的PVL阳性金葡菌和4种抗生素,结果显示,亚抑菌浓度的克林霉素、利奈唑胺和替加环素均可减少PVL表达,从试验中可以看出PVL是在mRNA的转录水平上进行调控,从而降低mRNA的翻译,减少PVL的合成和释放,这与相关研究[4,8]结果相似。8株金葡菌的PVL蛋白合成在替加环素的作用下全部降低,1/2 MIC时降低达64%。有研究[4]显示,替加环素可与金葡菌核糖体30s亚基结合,阻断细菌蛋白质肽链延伸,可能抑制了PVL的合成。试验中两种亚抑菌浓度的万古霉素对PVL蛋白表达影响均不明显。
利奈唑胺作为新型抗生素,用于治疗包括MRSA引起的院内和社区获得性肺炎、复杂性皮肤软组织感染。Elisabeth et al[9]认为利奈唑胺对治疗PVL阳性的MRSA和MSSA均有效,并且报道了3例PVL阳性金葡菌感染病例,临床均给予克林霉素和利奈唑胺联合治疗,3种感染均得到治愈,并且预后良好。
替加环素是用于成人复杂皮肤及软组织感染和腹内感染的新型抗生素,美国外科感染协会尤其指出替加环素应当用于进展较快的由金葡菌引起的皮肤软组织感染[10]。
如今细菌耐药率不断上升以及超级细菌的出现,寻找合适的替代万古霉素的抗生素显得尤为重要。Puzniak et al[11]对替加环素和万古霉素在治疗金葡菌感染中的作用同时进行评估,发现替加环素在治疗MRSA引起的皮肤软组织感染时,作用等同于万古霉素,而且有研究[12-13]表明万古霉素在治疗严重MRSA感染时发挥的作用正逐渐减小。因此,可以认为在治疗PVL阳性金葡菌引起的皮肤软组织及包括切口放置物引起的外科感染时,替加环素或可做为首选用药。
本研究是国内首次报道PVL在亚抑菌浓度抗生素作用下的合成及释放,但由于目前CA-MRSA中PVL阳性率远远高于HA-MRSA,因此应当继续收集门诊患者的金葡菌标本,选取更多样的抗生素,以期为临床治疗PVL阳性的金葡菌感染提供更多的方法。
[1] Hu Q,Cheng H,Yuan W,et al.Panton-Valentine leukocidin(PVL)-positive health care-associatedmethicillin-resistant Staphylococcus aureus isolates are associated with skin and soft tissue infections and colonized mainly by infective PVL-encoding bacteriophages[J].JClin Microbiol,2015,53(1):67-72.
[2] Jin T,Zhu Y L,Li J,et al.Staphylococcal protein A,Panton-Valentine leukocidin and aggravate the bone loss and bone destruction in osteomyelitis[J].Cell Physiol Biochem,2013,32(2):322-33.
[3] Chen J,Luo Y,Zhang S,et al.Community-acquired necrotizing pneumonia caused by methicillin-resistant Staphylococcus aureus producing Panton-Valentine leukocidin in a Chinese teenager:case reportand literature review[J].Int JInfect Dis,2014,26(9):17-21.
[4] Otto M P,Martin E,Badiou C,etal.Effectofsubinhibitory concentrations of antibiotics on virulence factor expression by community-acquired methicillin-resisitant Staphylococcus aureus[J].J Antimicrob Chemother,2013,68(7):1524-32.
[5] 李 春,王中新,方 欣.41株金黄色葡萄球菌耐药性分析及PVL基因检测[J].安徽医药,2013,17(3):434-6.
[6] Brown M L,O’Hara F P,Close N M,et al.Prevalence and sequence variation of Panton-Valentine leukocidin in methicillin-resistant Staphylococcus aureus strains in the United States[J].J Clin Microbiol,2012,50(1):86-90.
[7] Tenover FC,Tickler IA,Goering R V.Characterization of nasal and blood culture isolates ofMethicillinresistant Staphylococcusaureus from patients in United States Hospitals[J].Antimicrob A-gents Chemother,2012,56(3):1324-30.
[8] Olson M W,Ruzin A,Feyfant E,et al.Functional,biophysical and structural bases for antibacterial activity of tigecycline[J]. Antimicrob Agents Chemother,2006,50(6):2156-66.
[9] Elisabeth P,Maria S,Irene G,etal.Success stories about severe pneumonia caused by Panton-Valentine leucocidin-producing Staphylococcus aurues[J].Braz J Infect Dis,2014,18(3):341-5.
[10]May A K,Stafford R E,Bulger EM,et al.Treatment of complicated skin and soft infections[J].Surg Infect(Larchm t),2009,10(5):467-99.
[11]Puzniak L A,Quintana A,Wible M,et al.Methicillin-resistant Staphylococcus aureus infection epidemiology and clinical response from tigecyline soft tissue infection trials[J].Diag Mircobiol Infect Dis,2014,79(2):261-5.
[12]Martinez-Olondris P,Rigol M,Soy D,et al.Efficacy of linezolid compared to vancomycin in an experimental model of pneumonia induced bymethicillin-resistant Staphylococcus aurues in ventilated pigs[J].Crit Care Med,2012,40(1):162-8.
[13]Diep B A,Afasizheva A,Le H N,et al.Effects of linezolid on suspressing in vivo production of Staphyloccoccal toxin and improving survical outcomes in a rabbit model of methicillin-resistant Staphylococcus aurues necrotizing pneumonia[J].J Infect Dis,2013,208(1):75-82.
Effect of subinhibitory concentrations of antibiotics on Staphylococcus aureus producing panton-valentine leukocidin
Wang Lu1,2,Xu Yuanhong1
(1Dept of Clinical Laboratory,The First Affiliated Hospital of AnhuiMedical University,Hefei 230001,2Clinical Laboratory Center,Lu′an People′s Hospital,Lu’an 237005)
Objective To explore the effect of subinhibitory concentrations(sub-MICs)of four antibiotics on panton-valentine leucocidin(PVL)expression by Staphylococcus aureus.MethodsEight strains of PVL-positiveStaphylococcus aureus were isolated by PCR.The MICs of these antibiotics were determined by constant dilution. then,PVL expression of Staphylococcus aureus wasmeasured at differentMICs of these antibiotics by ELISA.ResultsClindamycin,linezolid and tigecycline all could reduce the expression of PVL at1/8 MIC~1/2 MIC.after 4 and 6 hours of culturing,the relative PVL mRNA expression was reduced about 17%~82%,8%~85%and 11%~78%by clindamycin,linezolid and tigecycline,respectively.The protein expression of PVLwas reduced by 65%and 83%under1/4 and 1/2 MIC of clindamycin,and reduced by 40%and 61%under1/4 and 1/2MIC of linezolid,and reduced by 61%only at1/2 MIC of tigecycline.There had no effect of vancomycin on PVL expression.ConclusionThe effects of four antibiotics on PVL expression at sub-MICs were different.Clindamycin and linezolid could significantly reduced PVL expression.Tigecycline colud reduced PVL expression only at high sub-MICs.Vancomycin had no effect.
Staphylococcus aureus;panton-valentine leucocidin;subinhibitory concentrations
R 446.5
A
1000-1492(2015)08-1086-05
2015-04-29接收
国家自然科学基金(编号:81171606);安徽省科技厅临床检验技术公共服务平台项目(编号:PT20081011)
1安徽医科大学第一附属医院检验科,合肥 230022
2六安市人民医院检验科,六安 237005
王 璐,女,硕士研究生;
徐元宏,男,教授,主任技师,硕士生导师,责任作者,E-mail:xyhong1964@163.com
