诱导子对海南粗榧悬浮细胞生长及三尖杉酯类碱合成的影响
2015-05-30龙晓娟李永成
龙晓娟 李永成
摘 要 为提高海南粗榧悬浮细胞三尖杉酯类碱产量,本实验在悬浮培养第15天后,分别添加不同浓度的茉莉酸甲酯和水杨酸。通过测定细胞比生长速率、细胞活力、关键酶活力、产物合成量等,研究诱导子对海南粗榧悬浮细胞生长及三尖杉酯类碱合成的影响。结果表明:茉莉酸甲酯、水杨酸均可抑制细胞生长,增加细胞中苯丙氨酸解氨酶活力,促进酚类物质生成,但对6-磷酸葡萄糖脱氢酶活力无显著影响。在产物合成方面,100 μmol/L茉莉酸甲酯和50 μmol/L水杨酸效果最显著,三尖杉酯类碱总量依次为10.32和7.27 mg/L,分别是对照的3.40和2.26倍。因此,在海南粗榧悬浮培养第15天分别添加100 μmol/L茉莉酸甲酯和50 μmol/L水杨酸最有利于三尖杉酯类碱的合成。
关键词 海南粗榧;茉莉酸甲酯;水杨酸;三尖杉酯类碱;悬浮培养
中图分类号 Q813.1 文献标识码A
Abstract In order to improve the yield of cephalotaxus alkaloids in the suspension cells of C. mannii, different doses of methyl jasmonate and salicylic acid were added to cell suspension culture of C. mannii at day 15 respectively. The effects of elicitors on the growth and cephalotaxus alkaloids accumulation of C. mannii suspension cells were studied by testing cell growth rate, cell activity, key enzyme activity, yield of cephalotaxus alkaloids et al. The results showed that both MJ(methyl jasmonate)and SA(salicylic acid)could inhibit cell growth, promot phenylalanine ammonium-lyase activity and increase the synthesis of phenols. But the two kinds of elicitors had no obvious influence on the activity of glucose 6-phosphate dehydrogenase compared with the control. In terms of the accumulation of cephalotaxus alkaloids, the results indicated that cells treated with 100 μmol/L MJ and 50 μmol/L SA had the most significant effect, the content of cephalotaxus alkaloids was 10.32 mg/L and 7.27 mg/L, respectively, which was 3.40 times and 2.26 times compared with the control. Therefore with the treatmenrt of 100 μmol/L MJ and 50 μmol/L SA at day 15 in C. mannii cell suspension cultures respectively was the most effective way to enhance the yield of C. alkaloids.
Key words Cephalotaxus mannii;Methyl jasmonate;Salicylic acid;Cephalotaxus alkaloids;SDuspension culture
海南粗榧是海南特有的植物,其根、茎、叶和果实中都含有生物碱,其中主干树皮部位含量最高。生物碱中有显著抑瘤作用的三尖杉酯碱、高三尖杉酯碱已在临床得到广泛应用[1-2]。随着海南粗榧抗癌效果的发现,海南粗榧被大肆砍伐,再加上其生长缓慢母树结子少,种子萌发困难,难以形成种群更新,已成为一种濒危物种[3]。三尖杉酯碱与高三尖杉酯碱在海南粗榧中的含量约为0.38%(树皮)左右,提取一克分析纯的三尖杉酯碱需要近一吨的海南粗榧木材,原料耗费巨大[4],靠自然资源难以满足市场需求。
细胞悬浮培养不受地理环境、土壤条件、季节因素限制;生产连续、生产周期短、可有目标的生产目的化合物,在植物药物生产中应用广泛[5-6]。诱导子是提高植物细胞培养中次生代谢产物的有效途径之一,在适宜条件下,利用诱导子调节植物次生代谢途径,有利于提高次生代谢产物产量[7]。
茉莉酸甲酯(methyl jasmonate, MJ)作为一种重要信号分子,在影响细胞初生代谢的同时还可诱导细胞防御基因的表达[8]。水杨酸(Salicylic acid, SA)为肉桂酸衍生物,是一种广泛存在于高等植物体内的酚类物质,在植物许多生理过程中发挥重要作用[9-10]。二者在植物细胞培养中应用广泛。余龙江等[11]研究了MJ( methyl jasmonate)对紫杉醇生物合成的影响,结果表明:培养20 d加入10 μmol/L MJ,紫杉醇产量较对照组提高280.7%。蔡长福等[12]在三尖杉细胞培养及其产物次生代谢的研究中发现水杨酸能有效提高三尖杉悬浮细胞生物碱产量。其中,2.0 mg/LSA(Salicylic acid)+8.0 mg/L赤霉素+0.5 mg/L苯甲酸钠最有利于三尖杉酯碱合成,其产量为11.03 μg/g。梅兴国等[13]通过研究水杨酸对红豆杉细胞诱导作用得出:20 mg/L SA对紫杉醇合成的促进效果最明显。Dong等[14]的研究表明适量浓度的SA(6.25~22.5 mg/L)可提高丹参细胞PAL(phenylalanine ammonium-lyaseactivity)活力,增加酚类化合物的积累,对丹参酚酸B和咖啡酸的合成有重要作用。
茉莉酸甲酯、水杨酸可激发细胞防御反应,提高苯丙氨酸解氨酶活力,促进次生代谢产物的合成。但以上两种诱导子在海南粗榧中的研究尚未见报道。该研究通过测定细胞生物量、细胞活力、褐化值、苯丙氨酸解氨酶活力、6-磷酸葡萄糖脱氢酶等探讨茉莉酸甲酯和水杨酸对海南粗榧悬浮细胞生长及三尖杉酯类碱合成的影响,从而达到增加三尖杉酯类碱产量的目的。
1 材料与方法
1.1 植物材料
本实验材料海南粗榧外植体采自海南省儋州市热带植物园,愈伤组织由本实验室诱导获得[15]。选取8 g质地疏松的愈伤组织,于100 mL悬浮培养基,27 ℃,100 r/min黑暗继代培养5代(毎代12 d),可获得分散性良好的悬浮细胞用于实验。悬浮培养基为:MS(Murashige and Skoog Basal Medium)培养基+蔗糖20 g/L+酶水解酪蛋白1 g/L+聚乙烯吡咯烷酮0.5 g/L+NAA(1-naphthaleneacetic acid)4 mg/L+KT(kineten)0.1 mg/L+VB1(Vitamin B1)10 mg/L[15]。
1.2 方法
1.2.1 植物细胞培养与处理方法 称6 g 1.1中悬浮细胞于80 mL上述悬浮培养基,于27 ℃黑暗培养,摇床转速100 r/min,培养周期30 d。在细胞培养的第15天分别添加50、100、150、200 μmol/L MJ及25、50、100、150 μmol/L SA。
1.2.2 海南粗榧悬浮细胞生物量的测定 实验中采用比生长速率衡量细胞生物量。比生长速率=细胞增长量/接种量/培养天数,细胞增长量=收获量-接种量。
1.2.3 细胞活力的测定 取3 mL悬浮细胞离心去上清液,加0.6%TTC(2,3,5-Triphenyltetrazolium chloride)溶液3 mL,25 ℃下反应24 h,吸去TTC,用蒸馏水清洗3次,弃水溶液并收集细胞;加入3 mL 95%无水乙醇于60 ℃恒温水浴10 min,以抽提酶反应生成的红色甲臜,离心取上清液,冷却,于492 nm处测定其吸光值。细胞活力单位以每克湿细胞在492 nm处的吸光值表示(OD/g)[16]。
1.2.4 培养液褐化的测定 取3 mL悬浮细胞离心取上清液于430 nm处测定吸光值[17],吸光值与褐化程度成正比。
1.2.5 苯丙氨酸解氨酶(PAL)活力的测定 通过测定PAL催化产物反式肉桂酸来测定PAL的活性[18]。取3 mL悬浮细胞离心去上清液,收集细胞。加少量聚乙烯吡咯烷酮(polyvinylpyrrolidone,简称PVP)、石英砂、2 mL预冷的酶提取液(含5 mmol/L巯基乙醇、1%PVP、0.1 mol/L硼酸缓冲液)于冰上研磨。10 000 r/min离心15 min取上清液为酶粗提液。
1 mL酶液加1 mL 0.02 mol/L苯丙氨酸,对照用1 mL蒸馏水代替酶液。30 ℃恒温水浴中反应0.5 h,于290 nm处测定反应前后吸光度变化值,以反应前后每5 min吸光度变化0.01所需的酶量定义为一个单位(U)。细胞酶活性以每克湿细胞的酶单位(U/g)表示。
1.2.6 6-磷酸葡萄糖脱氢酶(G6PDH)活力的测定
通过测定G6PDH(glucose 6-phosphate dehydro
genase)催化产物NADPH来测定G6PDH的活性[19]。取3 mL悬浮细胞离心去上清液,收集细胞。加少量PVP、石英砂、1 mL预冷的酶提取液(含0.42 mol/L甘露醇、0.005 mol/L KCl、0.005 mol/L MgSO4、0.05 mol/L Tris-HCl)于冰上研磨。10 000 r/min离心15 min取上清液为粗酶液。
0.1 mL酶液加0.1 mL 0.09 mol/L G-6-P-2Na、0.1 mL 0.003 mol/L NADP、0.1 mL 12.5 mmol/L MgCl2、2.6 mL 0.05 mol/L Tris-HCl,35 ℃恒温水浴中反应5 min,于340 nm处测定反应前后吸光度变化值。以反应前后每5 min吸光度的变化0.01所需的酶量定义为一个单位(U)。细胞酶活性以每克湿细胞的酶单位(U/g)表示。
1.2.7 三尖杉酯类碱含量的测定 胞内产物的提取:收获过滤后的悬浮细胞,60 ℃烘干,研磨为细粉,氨水润湿细胞,甲醇浸泡,超声破碎30 min,抽提24 h后过滤,真空浓缩至干,1 mL色谱级甲醇复溶待测。培养液中产物的提取:培养液用氨水调节pH 8左右,氯仿抽提3次,真空浓缩至干,1 mL色谱级甲醇复溶待测。
测定:利用HPLC(high performance liquid chromatography)法,色谱条件为:XDBC18(150 mm×4.6 mm,5 μm)色谱柱, 柱温25 ℃, 0.02 mol/L乙酸铵 ∶ 甲醇=55 ∶ 45(V/V), 流量0.8 mL/min, 检测波长280 nm, 进样量: 10 μL[20]。
1.2.8 统计分析 本实验数据来自3个平行实验的平均值,误差以标准偏差表示,显著性分析用SPSS统计软件进行数据分析,Duncan法进行多重比较,p<0.05视为差异显著。
2 结果与分析
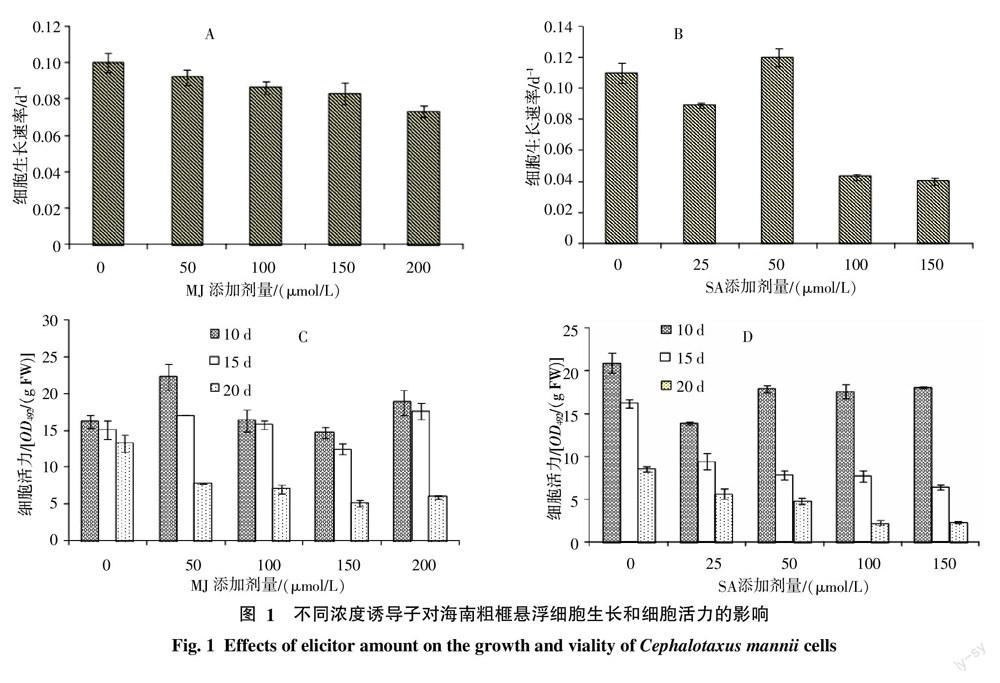
2.1 诱导子对海南粗榧悬浮细胞生长及活力的影响
通常情况下,添加诱导子会抑制细胞生长。当MJ浓度为50、100、150、200 μmol/L时,细胞比生长速率依次为0.092、0.086、0.083、0.073 d-1,对照为0.10 d-1(图1-A)。当SA浓度为25、50、100、150 μmol/L时,细胞比生长速率依次为:0.089、0.12、0.043、0.040 d-1,对照为0.11 d-1(图1-B)。统计分析表明:50、100、150、200 μmol/L 及25、100、150 μmol/L SA对细胞生长均有显著抑制作用(p<0.05)。
图1-C和图1-D显示了各实验组在添加前(15 d)和添加后5 d内(20 d)细胞活力的变化值。当MJ浓度为50、100、150、200 μmol/L时,细胞活力分别降低了54.51%、55.68%、58.80%、66.02%;而对照仅降低12.16%,MJ各处理均与对照差异显著(p<0.05)(图1-C)。在SA处理中,随SA浓度的增加(25、50、100、150 μmol/L),细胞活力在添加SA后的5 d内,分别降低了40.13%、38.49%、70.03% 和63.65%,对照降低了47.04%(图1-D)。经统计分析表明SA浓度大于50 μmol/L时,细胞活力降低幅度与对照差异显著(p<0.05)。
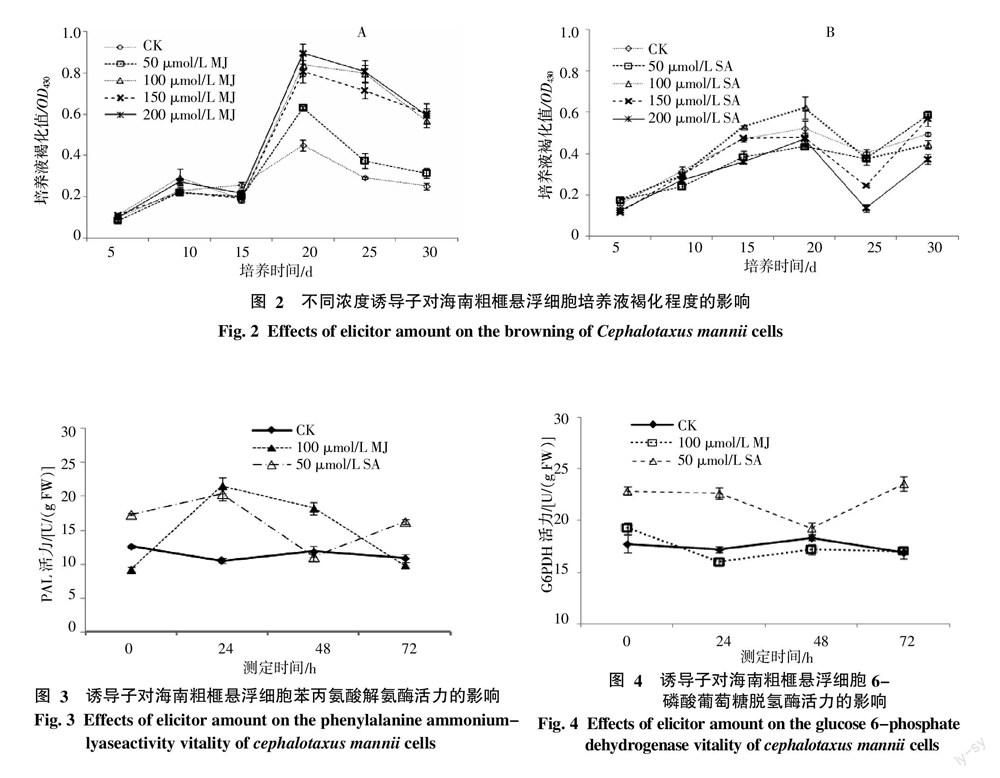
2.2 诱导子对苯丙氨酸解氨酶活力及褐化值的影响
褐变是指细胞在培养过程中释放褐色物质,使培养基逐渐变成褐色的现象。褐变的发生与外植体中所含酚类化合物数量有直接关系,PAL为这一途径关键酶。
由图2-A可知,添加MJ的5 d内(20 d),随MJ浓度的增加(50、100、150、200 μmol/L),培养液褐化值较添加前(15 d)分别增长了3.14、4.43、4.16及4.18倍,而对照仅增长1.75倍。然而,在添加SA的5 d内,随SA添加浓度的增加(25、50、100、150 μmol/L),培养液褐化值分别增长了1.12、1.17、1.00和1.37倍,对照增加了1.11倍(图2-B)。由统计分析可知,细胞经各浓度MJ,50 μmol/L SA及150 μmol/L SA处理后,5 d内褐化值增量明显高于对照(p<0.05),且MJ对褐化程度的影响要高于SA。
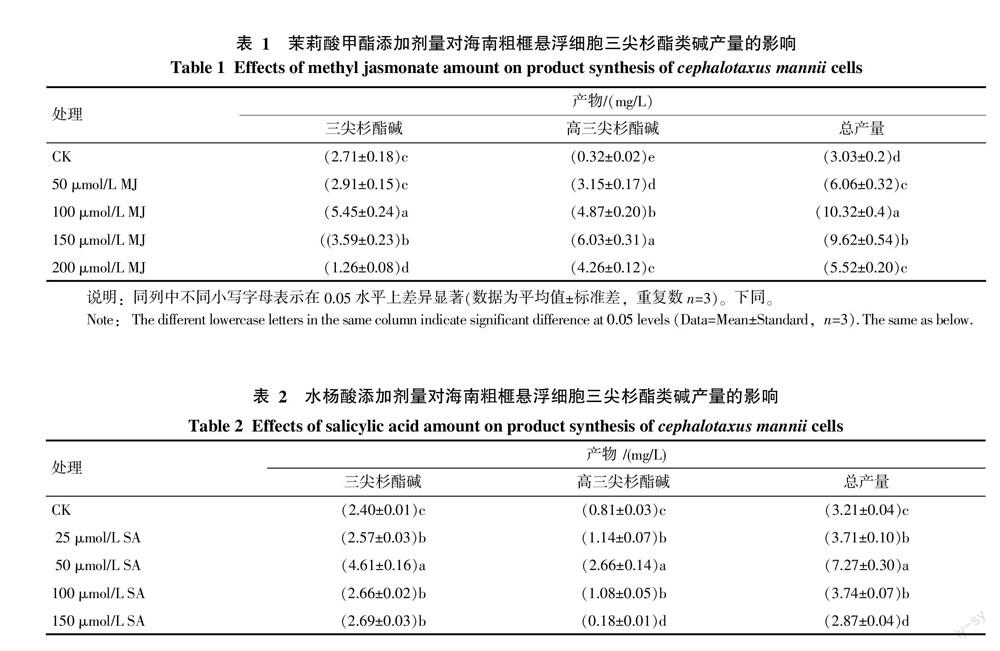
关于诱导子对PAL活力的影响,实验选取了最佳浓度的MJ(100 μmol/L)、SA(50 μmol/L)与空白做比较。由图3可知,添加MJ、SA后,PAL活力均呈先上升后下降趋势,并在添加后的24 h达到最大值。且细胞经MJ、SA处理后,PAL活力最大值均明显高于对照(p<0.05)。
综上所述,MJ、SA可激发细胞防御反应,增加PAL活力,促进酚类物质的积累,且MJ对PAL活力及褐化程度的影响要高于SA。
2.3 诱导子对6-磷酸葡萄糖脱氢酶活力的影响
6-磷酸葡萄糖脱氢酶是磷酸戊糖途径的关键酶,该途径产生的4-磷酸赤藓糖是合成三尖杉酯类碱的重要原料之一。由图4可知,添加MJ、SA后,6-磷酸葡萄糖脱氢酶活力变化与对照无显著差异(p>0.05),由此可见MJ、SA的作用点不是G6PDH。
2.4 茉莉酸甲酯、水杨酸对三尖杉酯类碱合成的影响
研究分别测定了三尖杉酯碱和高三尖杉酯碱的含量。结果表明,在一定范围内,三尖杉酯类碱含量随诱导子浓度增加而增加。统计分析表明:50、100、150、200 μmol/L茉莉酸甲酯和25、50、100 μmol/L 水杨酸,均可促进三尖杉酯类碱合成,且三尖杉酯类碱总量均与对照差异显著(p<0.05)。由表1可知,100 μmol/L MJ最有利于三尖杉酯类碱的合成,其含量为10.32 mg/L,其中包含5.45 mg/L三尖杉酯类碱和4.87 mg/L高三尖杉酯类碱,三尖杉酯类碱总量是对照的3.40倍。表2表明,SA浓度为50 μmol/L时,最能促进三尖杉酯类碱合成,其含量为7.27 mg/L,其中包含4.61 mg/L三尖杉酯碱和2.66 mg/L高三尖杉酯碱,三尖杉酯类碱总量是对照的2.26倍。
3 讨论与结论
诱导子作为有效促进次生代谢产物合成的方法之一,可激发植物形态、生理方面的反应,促进植物抗毒素的合成。此外,诱导子还可引起一系列防御反应,产生多种与植物防御相关的次生代谢产物。国内外关于诱导子的作用机制提出过不少观点,例如Ca2+信使影响细胞膜完整性,抑制或激活细胞内途径并改变胞内渗透压;诱导子通过影响次生代谢相关酶活性,从而调节代谢途径,改变代谢产物的积累等,但关于诱导机理的描述仍不完善[21]。酚类物质是植物防御反应中产生的主要次生代谢产物之一,PAL是合成酚类物质的关键酶。有研究表明[22-23],MJ、SA可提高植物细胞PAL活力,在本研究中,添加MJ、SA后,PAL活力和酚类物质含量均明显提高,说明MJ、SA激发了细胞防御反应。
培养液褐化程度与酚类物质含量有密切联系。苯丙氨酸在PAL作用下反应生成酚类物质,此外,PAL活力的增加,也有利于次生代谢产物的合成[24]。研究表明,添加诱导子有利于酚类的合成(图3、表1),但培养液中酚类含量并不是越多越好。当MJ浓度为200 μmol/L时,培养20 d时的褐化值明显高于其他处理(图3),但其三尖杉酯类碱含量却不是最高的(表1)。这是因为,苯丙氨酸是酚类和三尖杉酯类碱的共同前体物,酚类物质的过量合成不仅会消耗苯丙氨酸还会对细胞产生毒害作用。高浓度MJ(150、200 μmol/L),对细胞生长、细胞活力抑制作用明显,过低的生物量和细胞活力不利于产物的合成。因此,要确定诱导子的最佳浓度,使其激发细胞防御反应的同时又不过分抑制细胞生长。
G6PDH是磷酸戊糖途径的关键酶,对4-磷酸赤藓糖的合成有重0要作用。4-磷酸赤藓糖与磷酸烯醇式丙酮酸反应生成的莽草酸是合成生物碱和酚类的物质的重要前体物[25]。有研究表明[26],有些诱导子,如真菌诱导子可提高G6PDH活力。在本研究中,MJ、SA均没有这种作用,说明MJ、SA的作用位点不是G6PDH。
综上所述, 在海南粗榧悬浮培养第15天分别添加100 μmol/L茉莉酸甲酯和50 μmol/L水杨酸最有利于三尖杉酯类碱的合成,且100 μmol/L茉莉酸甲酯较50 μmol/L水杨酸对三尖杉酯类碱诱导效果更显著。
参考文献
[1] 刘进平, 党群帆. 海南粗榧扦插繁殖技术[J]. 中国热带农业, 2006(5): 63.
[2] 中国医学科学院药物研究所. 中草药现代研究[M]. 北京: 北京医科大学中国协和医科大学联合出版社, 1996. 143-128.
[3] 符文英, 杜道林, 邢诒旺. 海南粗榧保护和开发利用的研究[J]. 分子植物育种, 2003(5/6): 795-799.
[4] 刘进平, 吴佳静, 黄艳丽,等. 海南粗榧外植物灭菌与愈伤组织诱导[J]. 热带农业科技, 2010, 33(1): 39-41.
[5] Zhao J, Verpoorte R. Manipulating indole alkaloid production by Catharanthus roseus cell cultures in bioreactors: From biochemical processing to metabolic engineering[J]. Phytochemistry Reviews, 2007(6): 435-457.
[6] Wilson S A, Roberts S C. Recent advances towards development and commercialization of plant cell culture processes for the synthesis of biomolecules[J]. Plant Biotechnol J, 2012(10): 249-268.
[7] 王和勇, 罗 恒, 孙 敏. 诱导子在药用植物细胞培养中的应用[J]. 中草药. 2004, 35(8): 3-6.
[8] Creelman R A, Mullet J E. Biosynthesis and action of jasmonates in plants[J]. Annu Rev Plant Physiol Plant Mol Biol, 1997(48): 355-381.
[9] Raskin I. Role of salicylic acid in plants. Annu Rev Plant Physiol[J]. Plant Mol Biol, 1994(43): 439-463.
[10] Draper J. Salicyliate, superoxide synthesis and cell suicide in plant defense[J]. Trends Pi, 1997(2): 162-165.
[11] 余龙江, 朱 敏, 周 莹, 等. 茉莉酸甲酯对紫杉醇生物合成的诱导作用[J]. 天然产物研究与开发, 1998, 11(5): 1-7.
[12] 蔡长福. 三尖杉细胞培养及其三尖杉酯类碱次生代谢的研究[D]. 福州: 福建农林大学, 2007: 39-40.
[13] 梅兴国, 张舟宁, 苏湘鄂, 等. 水杨酸对红豆杉细胞的诱导作用[J]. 生物技术, 2000, 10(6): 18-20.
[14] Dong J, Wan G W, Liang Z S. Accumulation of salicylic acid-induced phenolic compounds and raised activities of secondary metabolic and antioxidative enzymes in Salvia miltiorrhiza cell culture[J]. Journal of Biotechnology, 2010(148): 99-104.
[15] 王成韬, 钟秋平, 李永成. 海南粗榧愈伤组织增殖及褐变现象的研究[J]. 广西师范大学学报: 自然科学版, 2013(31): 145-150.
[16] 刘 华, 梅兴国. TTC法测定红豆杉细胞活力[J]. 植物生理学通讯, 2001, 37(6): 537-539.
[17] Sistrunk W A, Morris J R. Influence of Cultivar, Extraction and Storage Temperature, and Time on Quality of Muscadine Grape Juice[J]. J Amer Soc Hort Sci, 1982(107): 1 110-1 113.
[18] Yuan Y J, Li C, Hu Z D, et al. A double oxidative burst for taxol production in suspension cultures of Taxus chinensis var. mairei induced by oligosaccharide from Fusarium oxysprum[J]. Enzyme Microbiol Technol, 2002(30): 774-778.
[19] Mehmet C, Oifran K, Mehmet G, et al. Effects of some antibiotics on enzyme activity of glucose-6-phosphate dehydrogenase
from humanerythrocytes[J]. Pharmacological Research, 2000(41): 109.
[20] 王成韬. 海南粗榧愈伤组织增殖及抗褐变研究[D]. 海口: 海南大学, 2013: 18.
[21] Namdeo A G. Plant Cell Elicitation for Production of Secondary Metabolites: A Review[J]. Pharmacognosy Reviews. 2007(1): 69-79.
[22] Chen J Y, Wen P F, Kong W F, et al. Effect of salicylic acid on phenylpropanoids and phenylalanine ammonialyase in harvested grape berries[J]. Postharvest Biol Technol, 2006(40): 64-72.
[23] Lafuente M T, Sala J M, Zacarias L. Active oxygen detoxifying enzymes and phenylalanine ammonia-lyase in the ethylene-induced chilling tolerance in citrus fruit[J]. Agric. Food Chem, 2004(52): 3 606-3 611.
[24] Zhao J, Lawrence C D, Verpoorte R. Elicitor signal transduction leading to production of plant secondary metabolites[J]. Res Rev Paper Biotechnol Adv, 2005(23): 283-333.
[25] Gitterman A, Parry R J, Dufresne R F, et al. Biosynthesis of the Cephalotaxus alkaloids. Investigations of the biosynthesis of deoxyharringtonine, isoharringtonine, and harringtonine[J]. J Amer Chem Soc, 1980(102): 2 074-2 081.
[26] Yu L J, Lan W Z, Qin W M, et al. Effects of salicylic acid on fungal elicitor-induced membrane-lipid peroxidation and taxol production in cell suspension cultures of Taxus chinensis[J]. Process Biochem, 2001(37): 477-482.
