高浓度葡萄糖对牙周膜干细胞成骨分化能力的影响
2015-05-24夏佳佳王岚章燕珍
夏佳佳王 岚章燕珍
高浓度葡萄糖对牙周膜干细胞成骨分化能力的影响
夏佳佳1王 岚2章燕珍1
目的 观察高浓度葡萄糖刺激下牙周膜干细胞(PDLSCs)的增殖能力和成骨分化能力。方法 组织块法体外培养非糖尿病患者PDLSCs,分别用0mg/L(正常对照组)、1100mg/L(低糖组)、4500mg/L(高糖组)浓度葡萄糖刺激,MTT法检测PDLSCs增殖能力,矿化诱导后茜素红染色观察矿化结节形成,实时定量聚合酶链反应(RT-PCR)检测Runt相关转录因子2(Runx-2)、碱性磷酸酶(ALP)和I型胶原(Col-1)成骨相关基因表达。结果 MTT法检测显示高糖组OD值较低糖组和正常对照组低(P<0.05);21天成骨诱导后,高糖组矿化结节面积少于低糖组和正常对照组(P<0.05,P<0.01);成骨诱导期间,高糖组ALP、Runx2和Col-1诱导前后相对倍增数低于低糖组和正常对照组(P<0.05,P<0.01)。结论 高浓度葡萄糖抑制PDLSCs增殖能力和成骨分化能力。
牙周膜干细胞;高浓度葡萄糖;分化能力;增殖能力
牙周膜由致密的结缔组织构成,能够为牙龈、牙槽骨等牙周支持组织提供组织再生的细胞,牙周组织包括血管上皮细胞、平滑肌细胞和成纤维细胞[1],目前大量研究表明牙周膜干细胞(periodontal ligament stem cells,PDLSCs)拥有自我更新和多项分化能力,包括分化成神经元细胞、肝细胞、成骨细胞、成软骨细胞和成脂细胞[2-5],同时PDLSCs还表达间充质干细胞的表面特异性标记物(STRO-1,CD-44,CD-73,CD-90和CD-105)[6]。
目前针对PDLSCs多项分化的研究中,很多学者在体外均能成功地将PDLSCs向成骨诱导分化[1-2,7],而葡萄糖能够影响机体间充质干细胞的复制衰老和线粒体的呼吸[8],能够为细胞分子及其代谢中间产物提供足够的能量[9]。笔者前期研究[10]也得出2型糖尿病患者来源的PDLSCs成骨能力较弱的结论,目前最佳的糖浓度(1100g/L、4500g/L)已经用来研究干细胞的分化功能[11]和牙周膜成纤维细胞多项分化能力[12-14],高浓度的葡萄糖(4500mg/L)可明显抑制牙周膜成纤维细胞成骨分化能力及其细胞活性。本实验研究在不同葡萄糖浓度刺激下,牙周膜干细胞成骨分化能力的表达。
1 材料与方法
1.1 主要试剂与仪器 α-MEM培养基、鼠抗人STRO-1单克隆抗体(R&D SYSTEMS公司,美国)、胶原酶、鼠抗人CD146单克隆抗体(Abcam公司,美国)、一步法RT-PCR试剂盒(Takara,日本)、MTT(Sigma,美国)、胎牛血清(四季青,杭州)、胰蛋白酶(Gibco,美国)、细胞总RNA提取试剂盒、倒置显微镜以及照相系统(OLYMPUS,日本)、real time PCR仪器(Applied biosystems,美国)。
1.2 细胞分离与培养 牙周组织来源于临床上因正畸治疗需要拔除的13~23岁非糖尿病患者,共8名,年龄(17.5±3.9)岁,均来自浙江大学医学院附属第二医院口腔外科门诊部,常规进行原代细胞培养[10]。
1.3 有限稀释法克隆化培养纯化PDLSCs[10]取对数生长期的第1代细胞,调整细胞密度至100~150个/mL,接种于直径10cm的一次性培养皿中,3mL/皿,培养贴壁后标记单个细胞并补液至8mL,常规培养7~10天,出现细胞克隆。
1.4 PDLSCs的初步鉴定[10]
1.4.1 克隆形成率 克隆形成数量/接种细胞数量× 100%
1.4.2 免疫荧光细胞检测波形丝蛋白、角蛋白、细胞表型分子CD146和STRO-1 分别取第二代克隆形成细胞5×103/孔接种于24孔板,4%多聚甲醛固定30min,加羊血清封闭30min,直接加鼠抗人CD146单克隆抗体(1:100稀释)37℃孵箱孵育2h,加山羊抗小鼠IgG(1:100稀释),37℃孵箱孵育40min,Hochest胞核衬染,洗尽后避光观察、拍照。STRO-1、波形丝蛋白、角蛋白染色方法同CD146。
1.5 实验分组 正常对照组:常规α-MEM培养液(含10%胎牛血清)组。低糖组:常规α-MEM培养液(含10%胎牛血清)中含1100mg/L葡萄糖组。高糖组:常规α-MEM培养液(含10%胎牛血清)中含4500mg/L葡萄糖组[14]。
1.6 MTT法检测不同浓度下细胞增殖能力[10]取第二代PDLSCs制成细胞悬液,1×104/孔接种于三个96孔板,常规培养2~3天后,每孔加MTT(5mg/mL)50μL,置37℃孵箱孵育4h,加150μL DMSO,避光震荡15min,每组细胞设置6个副孔,三个空白对照孔,选择490nm波长的酶标仪检测OD值。连续检测9天,绘制细胞生长曲线。
1.7 成骨诱导及茜素红染色[10]取第二代PDLSCs制成细胞悬液,2×104个细胞分别接种于三个6孔板中。常规培养,待细胞增殖到孔底的70%时,换为不同浓度葡萄糖培养液和成骨诱导液(10%胎牛血清的α-MEM培养液中含10mmol/mLβ-甘油酸钠、50μg/mL维生素C、1×10-8mol/L地塞米松、100μg/mL链霉素、100U/mL青霉素),连续培养21天后弃原诱导液,4%多聚甲醛固定,0.1%茜素红37℃孵箱染色,倒置显微镜下观察矿化结节。
1.8 RT-PCR检测Runx-2、Col-1和ALPmRNA表达[10]分别收集不同浓度葡萄糖刺激下成骨诱导7天后的三组PDLSCs,用细胞总RNA提取试剂盒提取培养细胞总RNA,β-actin为内参照。参照Gen-Bank数据库,采用Primer primer5.0计算机软件设计引物,设计基因序列见表1。由Takara公司合成,反应条件参考产品说明书。

表1 基因序列表
1.9 统计学方法 应用SPSS15.0软件进行统计分析,检测结果以均数±标准差(±s) 表示,单因素方差分析比较三组MTT值、矿化结节面积和相关mRNA表达的差异,以P<0.05为差异有统计学意义。
2 结 果
2.1 PDLSCs的分离及纯化 本实验用组织块法培养PDLSCs,7~12天组织块周围有细胞爬出,之后1~2周左右达到80%汇集,筛选出的克隆细胞大多呈长梭形,少数为椭圆形,胞体较小,胞浆丰满。
2.2 PDLSCs的初步鉴定
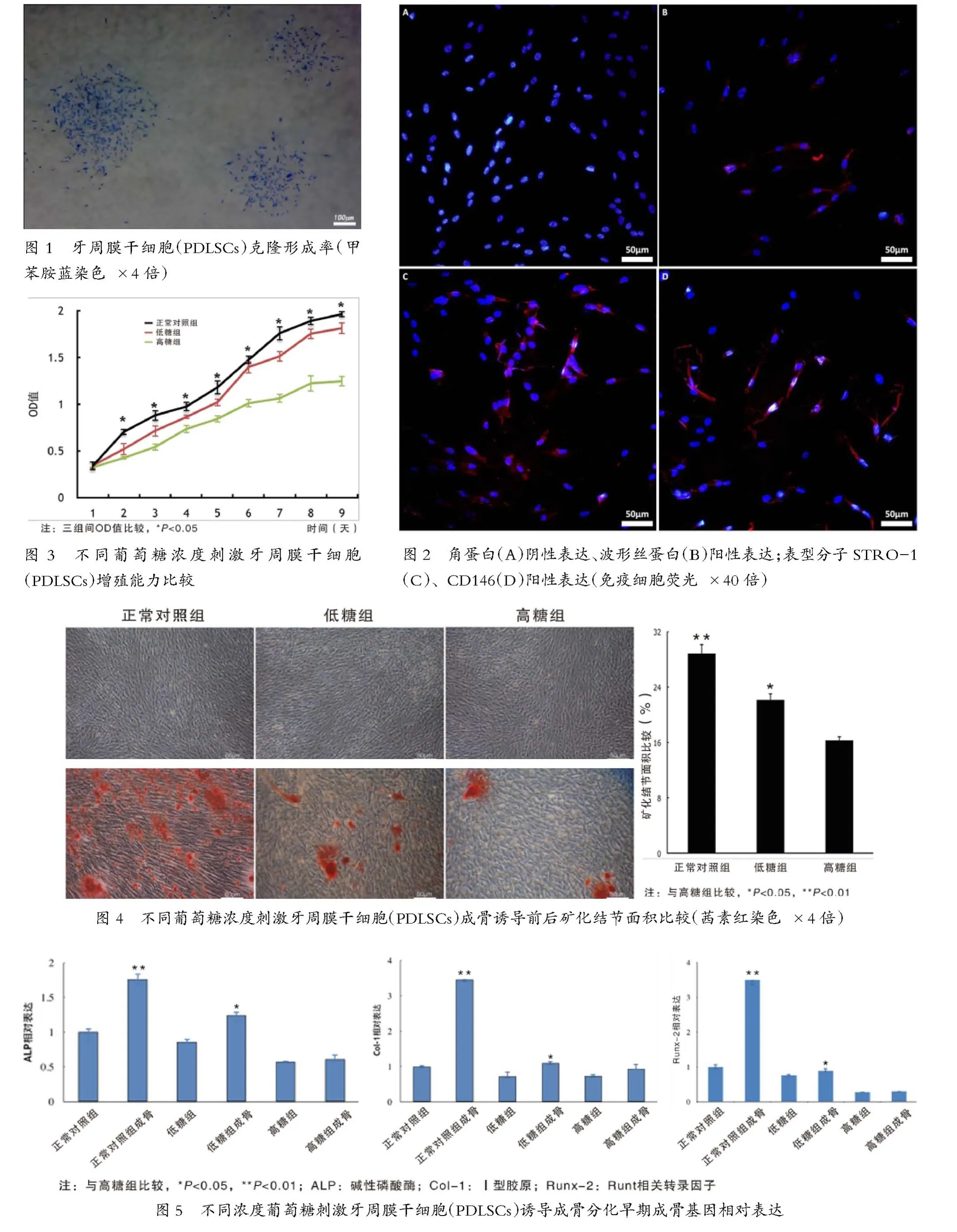
2.2.1 克隆形成率 有限稀释法克隆后的细胞克隆形成率为(25.63±2.53)%(图1,封二)。
2.2.2 波形丝蛋白、角蛋白、CD146和STRO-1的表达 免疫荧光细胞检测发现,有限稀释法克隆后细胞角蛋白阴性表达(图2A,封二),波形丝蛋白阳性表达(图2B,封二),说明PDLSCs来源于中胚层;同时,检测间充质干细胞表型标记分子STRO-1、CD146,均呈阳性表达(图2C、D,封二)。
2.3 细胞增殖能力 连续9天吸光光度值(OD值)检测,发现两组不同浓度血糖刺激后PDLSCs呈现出不同的细胞增殖能力和活性,三组细胞中,细胞的增殖曲线为“S”型,经统计学分析,第一天OD值组间比较无明显差异。而在2~9天中,高糖组细胞增殖能力与活性受到明显的抑制,正常对照组增殖能力最强,组间差异有统计学意义(P<0.05)(图3,封二)。
2.4 钙化结节形成 三组细胞成骨矿化液诱导后倒置显微镜下观察可见米粒大小灰白色的小结节,诱导第21天时,茜素红染色后镜下可见染成红色钙化结节,相同视野下,与正常对照组、低糖组比较,高糖组诱导后钙化结节面积形成最少,差异有统计学意义(P<0.05,P<0.01)(图4,封二)。
2.5 RT-PCR结果 三组PDLSCs经成骨诱导液诱导后,分别对早期成骨基因Runx-2、ALP和Col-1进行检测,结果显示三组均有较为明显的成骨分化的表现,高糖组的成骨相关基因诱导后的倍增数较低糖组、正常对照组低(P<0.05,P<0.01)(图5,封二)。
3 讨 论
机体的成纤维细胞作为一种组织细胞,具有维持组织结构、合成细胞外基质和参与细胞间信号传导等功能,PDLSCs作为牙周结缔组织中的重要细胞,能够合成不同的细胞外基质蛋白和胶原纤维,同时,PDLSCs还能够分化为成骨样细胞和成牙本质样细胞,参与组织的修复与再生[8-9],因此,PDLSCs的活性对牙周组织再生起着非常重要的作用。
糖尿病作为一种系统性疾病对机体其他的组织和器官具有很大的影响,高血糖能够抑制组织器官细胞增殖分化功能,包括肾小管上皮细胞、胚胎系膜细胞和脐静脉内皮细胞[13-14],同时可明显抑制成骨细胞的矿化能力[15]。
近年研究[16-17]发现,2型糖尿病是牙周炎发生发展的促进因素,加速牙周组织的破坏。牙周膜成纤维细胞(PDLCs)的增殖能力近年来也得到更多学者的重视,Nishimura等[12]研究发现不同葡萄糖浓度对细胞的增殖具有一定的影响,当血糖>18mmol/L时的高糖状态下PDLCs增殖能力呈现降低的现象,发现高糖状态培养下的PDLCs过度表达纤维蛋白受体,从而抑制了这些细胞向血小板来源的生长因子的趋化反应。Ohgi等[18]研究学者研究高血糖对牙龈成纤维细和PDLCs增殖能力的影响机制,发现高血糖对牙龈成纤维细胞的增殖能力并无明显的影响,而对PDLCs出现了明显的抑制作用;Kim等[19]通过高糖刺激得出高糖状态可以明显抑制PDLCs的细胞活性与成骨项分化,高糖刺激下可积累大量VLA-5促使细胞外基质和整合素的分泌,增强了PDLCs的自身吸附能力,从而导致PDLCs在牙周组织损伤中细胞活性能力(迁徙能力)的减弱,延长修复周期[12]。同时高糖状态可能通过激活caspase-3的信号转导通路,促进PDLCs的凋亡[20]。本实验中多次检测高糖刺激后PDLSCs的增殖情况,结果显示在高糖状态下PDLSCs的增殖能力和细胞活性受到明显的抑制,该结果表达趋势与前期研究学者研究PDLCs相似。而临床上血糖未控制的糖尿病患者血清中血糖含量均较高(大多高于4500mg/L),因此可以认为糖尿病患者牙周损伤严重的可能原因是高血糖状态下抑制了牙周组织中PDLSCs的细胞活性,减少了PDLSCs向PDLCs分化,最终影响组织修复。
很多学者研究长期的高血糖状态对骨组织的影响,发现血糖未控制的糖尿病患者,骨组织的改建和代谢能力降低[21],说明高血糖能够影响机体骨密度和骨代谢,容易引起骨质疏松等并发症,本实验的另外一个主要目的是观察高糖刺激下PDLSCs在骨形成过程中钙化结节面积及早期相关基因的表达,研究高糖对PDLSCs成骨能的影响。
与牙龈成纤维细胞比较,PDLCs具有更高的ALP活性、更高细胞表型分子骨涎蛋白表达和更多的细胞外基质分泌[22]。研究者利用成骨矿化液对PDLCs进行诱导,PDLCs能够向成骨样组织分化[19]。基于前期研究的诱导条件,本实验研究结果显示对照组和低糖组在诱导14天左右出现了早期颗粒样大小的矿化结节,随着天数的增加,矿化结节面积增加,第21天时,对照组和低糖组的矿化面积可以用肉眼辨认,而高糖组则不明显,实验结果与其他研究学者结果相一致。
Runx-2、ALP和Col-1都是成骨的早期基因,ALP是骨形成标志[23],Runx-2表达是成骨细胞分化的开始,也是骨形成过程中最早和最具特异性的标志[24],是ALP、Col-1等早期成骨基因的上游基因,正是因为Runx-2的作用刺激了ALP、Col-1等早期成骨细胞相关基因,促进成骨分化。从本实验的结果我们提出这样的假设:因高糖组PDLSCs细胞成骨分化过程中Runx-2基因倍增数明显较对照组和低糖组低,上游基因表达能力下降,从而影响下游的ALP、Col-1的表达,进而影响了PDLSCs成骨向分化的能力。该结果与 Sawangmake等[25]研究高糖状态对PDLSCs向神经元细胞分化趋势相似,但具体调控机制目前未见报道。因此,对于糖尿病患者,无论是1型糖尿病还是2型糖尿病,良好的血糖控制,能够使牙周组织更加健康,延长牙齿在牙槽骨上的使用时间[26]。
总之,本实验结果一方面说明了PDLSCs具有向成骨样细胞分化的潜能,另外方面则体现了不同葡萄糖浓度对PDLSCs功能的影响,在高葡萄糖浓度的诱导作用下,PDLSCs对诱导条件的刺激分化能力出现“反应性降低”,导致PDLSCs向成骨分化能力减弱,从而解释糖尿病状态可能是通过影响PDLSCs成骨能力,加速糖尿病患者牙周炎发生发展,抑制骨形成,加重病变程度。但由于本实验研究限于体外,未体现PDLSCs在体内的生物学特性,因此高浓度葡萄糖对PDLSCs影响的具体作用机制还需要进一步的研究。
[1]International Diabetes Federation.Facts&figures:diabetes prevalence[DB].http://www.diabetesatlas.org.
[2]Collin HL,Uusitua M,Niskanen L,et al.Periodontal findings in elderly patients with non-insulin dependent diabetes mellitus[J].JPeriodontol,1998,69(9):962-966.
[3]Sandberg GE,Sundberg HE,Fjellstrom CA,et al.Type 2 diabetes and oral health:A comparison between diabetic and non-diabetic subjects[J].Diab Res Clin Prac,2000,50(1):27-34.
[4]张建全,潘亚萍,马丽,等.2007年辽宁省2型糖尿病患者牙周炎患病情况调查[J].中华口腔医学,2009,44(11):668-671.
[5]桑晓红,张丽,刘健,等.墨玉县农村维吾尔族牙周炎与代谢综合征相关性的流行病学研究[J].中华内分泌代谢杂志,2010,26(9):745-748.
[6]Lǒe H.Periodontal disease The sixth complication of diabetesmellitus[J].Diabetes Care,1993,16(1):329-334.
[7]Krentz AJ,Bailey CJ.Oral antidiabetic agents:current role in type 2 diabetes mellitus[J].Drugs,2005,65(3):385-411.
[8]Seo BM,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet2004,364(9429):149-155.
[9]Liu Y,Zheng Y,Ding G,et al.Periodontal Ligament Stem Cell-Mediated Treatment for Periodontitis in Miniature Swine[J].STEM CELLS,2008,26(4):1065-1073.
[10]夏佳佳,王岚,刘琪,等.2型糖尿病伴牙周炎患者牙周膜干细胞骨向分化研究[J].实用口腔医学杂志,2011,27(5):624-629。
[11]Pihlstrom BL,Michalowicz BS,Johnson NW.Periodontal diseases[J].Lancet,2005,366(9499):1809-1820.
[12]Nishimura F,Naruishi K,Yamada H,et al.High glucose suppresses cathepsin activity in periodontal-ligament-derived fibroblastic cells[J].JDent Res,2000,79(8):1614-1617.
[13]Ziyadeh FN,Simmons DA,Snipes ER,et al.Effect ofmyoinositol on cell proliferation and collagen transcription and secretion in proximal tubule cells cultured in elevated glucose[J].JAm Soc Nephrol,1991,1(11):1220-1229.
[14]Moran A,Brown DM,Kim Y,et al.Effects of IGF-I and glucose on protein and proteoglycan synthesis by human fetalmesangial cells in culture[J].Diabetes,1991,40(10):1346-1354.
[15]García-Hernández A,Arzate H,Gil-Chavarría I,et al.High glucose concentrations alter the biomineralization process in human osteoblastic cells[J].Bone,2012,50(1):276-288.
[16]Noack B,Aslanhan Z,BouéJ,et al.Potential association of paraoxonase-1,type 2 diabetes mellitus,and periodontitis[J].JPeriodonto,2013,84(5):614-623.
[17]de Oliveira Diniz CK,Corrêa MG,Casati MZ,et al.Diabetesmellitusmay increase bone loss after occlusal trauma and experimental periodontitis[J].JPeriodontol,2012,83(10):1297-303.
[18]Ohgi S,Johnson P.Glucosemodulates growth of gingival fibrpblasts and periodontal ligament cells:correlation with expression of basic fibroblast growth factor[J].JPeriodontal Res,1996,31(8):579-588.
[19]Kim HS,Park JW,Yeo SI,et al.Effects of high glucose on cellular activity of periodontal ligament cells in vitro[J]. Diabetes Res Clin Pract,2006,74(1):41-47.
[20]Liu J,Jiang Y,Mao J,et al.High levels of glucose induces
a dose-dependent apoptosis in human periodontal ligament fibroblasts by activating caspase-3 signaling pathway[J].Appl Biochem Biotechnol,2013,170(6):1458-1471.[21]Follak N,Klöting I,Wolf E,et al.Improvingmetabolic control reverses the histomorphometric and biomechanical abnormalities of an experimentally induced bone defect in spontaneously diabetic rats[J].Calcif Tissue Int,2004,74(6):551-560.
[22]Ivanovski S,Haase HR,Bartold PM.Expression of bone matrix protein mRNAs by primary and cloned cultures of the regenerative phenotype of human periodontal fibroblasts[J].JDent Res,2001,80(7):1665-1671.
[23]Lind M,Deleuran B,Theserup-Pedersen K,et al.Chemotaxis of human osteoblasts effects of osteotropic growth factors[J].APMS,1995,103(2):140-146.
[24]Takeda S,Bonnamy JP,Owen MJ,et al.Continuous expression of Cbfa1 in nonhypertrophic chondrocytes uncovers its ability to induce hypertrophic chondrocyte differentiation and partially rescues Cbfa1-deficientmice[J].Genes Dev,2001,15(4):467-481.
[25]Sawangmake C,Pavasant P,Chansiripornchai P,et al.High Glucose Condition Suppresses Neurosphere Formation by Human Periodontal Ligament-Derived Mesenchymal Stem Cells[DB].JCell Biochem,2013 Dec 16.doi:10.1002/jcb. 24735.[Epub ahead of print]
[26]Demmer RT,Holtfreter B,Desvarieux M,et al.The influence of type 1 and type 2 diabetes on periodontal disease progression:prospective results from the Study of Health in Pomerania[J].Diabetes Care,2012,35(10):2036-2042.
(收稿:2015-03-02 修回:2015-03-30)
Effects of High Glucose on Proliferation and Osteogenic Differentiation of Periodontal Ligament Stem Cellsin Vitro
XIA Jiajia1,WANG Lan2,ZHANG Yanzhen1. 1 Department of Cosmetic Dentistry,Second Affiliated Hospital,Zhejiang University School of Medicine,Hangzhou(310000),China;2 Department of Conservative Dentistry and Endodontics,the Affiliated Hospital of Stomatology,Chongqing Medical University;Chongqing Research Center for Oral Disease and Biomedical Sciences,Chongqing(401147),China
Objective To investigate the effect of high glucose concentration on the cellular activity and osteogenic differentiation of periodontal ligament stem cells(PDLSCs)in vitro.M ethods PDLSCs from non-diabetic patients were obtained and cultured with tissue block method in a low glucose-concentration medium(1100mg/L of glucose)or in a high glucose-concentration medium(4500mg/L of glucose),respectively,for 14d.Zero mg/L of glucose group served as blank control.MTT assay was used to evaluate cellular viability.The osteogenic differentiation capacity of PDLSCs was determined by alizarin red staining after mineralization induction and real time PCR for detection of Runx-2,alkaline phosphatase(ALP),and collagen I genes.Results MTT assay results showed that the OD value in high glucose group was lower than that in low glucose group(P<0.05,P<0.01).After 21-day culturing,the calcified area was reduced and the expression of Runx-2,ALP,and collagen I genes to the toal culture dish of PDLSCs in high glucose group were lower than those in low glucose group(P<0.05,P<0.01).Conclusion High glucose inhibits the proliferation and differentiation of PDLSCs.
periodontal ligament stem cells;high glucose;differentiation;proliferatio
1浙江大学医学院附属第二医院综合牙科(杭州 310052);2重庆医科大学附属口腔医院牙体牙髓科,重庆市口腔疾病与生物医学重点实验室(重庆 401147)
夏佳佳,Tel:18857862012
