传染性造血器官坏死病毒液相芯片检测技术
2015-05-18尹伟力岳志芹
尹伟力,林 超,刘 宁,贾 鹏,岳志芹,孙 涛,刘 荭
(1.山东出入境检验检疫局检验检疫技术中心,山东 青岛 266002;2.深圳出入境检验检疫局动植物检验检疫技术中心,广东 深圳 518000;3.烟台出入境检验检疫局,山东 烟台 264000)
传染性造血器官坏死病(infectious haematopoietic necrosis,IHN)又名大鳞大马哈鱼病毒病(Chinook salmon virus disease)、红大马哈鱼病毒病(Sockeye salmon virus disease)等[1],是一种毒力很强能引起感染鱼类急性、全身感染的严重传染病。病原为传染性造血器官坏死病毒(infectious haematopoietic necrosis virus,IHNV),属弹状病毒科粒外弹状病毒属成员,可侵害多种淡水、海水养殖鱼类,对水产养殖业危害极大[2]。
IHN最早发现于二十世纪四十年代的北美洲鲑鱼养殖场[3],随后迅速蔓延至欧洲[4],1968年传入日本[5],1988年传至我国,并在局部地区暴发[6]。该病被列入世界动物卫生组织水生动物疫病名录,我国将其列为二类动物疫病。
细胞分离是检测IHNV的“金标准”,但该方法操作复杂、检测周期长[7-8]。液相芯片技术是一种新型快速检测技术,该方法集流式细胞术、纳米荧光微球、荧光信号数字处理和传统化学发光技术为一体[9-13],其优势在于所需检测样本量少,检测周期短,既可检测核酸也可检测抗体[14]。本试验采用RT-PCR检测方法与液相芯片检测技术结合,建立了IHNV的液相芯片快速检测方法,为IHNV检测提供了新手段。
1 材料与方法
1.1 毒株核酸
传染性造血器官坏死病毒(IHNV)、流行性造血器官坏死病毒(EHNV)、病毒性出血性败血症病毒(VHSV)和传染性胰脏坏死病毒(IPNV)核酸由深圳出入境检验检疫局动植物检验检疫技术中心提供;鲤春血症病毒(SVCV)株由本实验室保存。
1.2 试剂与设备
表面羧基化的荧光编码微球、鞘液、甲基咪唑(TE)、碳二亚胺购自美国BD公司;TMAC(tetramethyl-ammonium chloride)、Tris、SDS(10%solution)、链霉菌抗生物素蛋白-藻红蛋白(SAPE)购自美国Sigma公司;SPAE Streptavidin-R-phycoerythrin购自美国Prozyme公司;RNA提取试剂盒(Takara MiniBEST Viral RNA/DNA Extraction Kit Ver.3.0)、RT-PCR试 剂 盒(RT-PCR Kit II)、DL2000 Marker购自大连宝生物公司。
主要设备:BD FACSArray液相芯片仪(美国BD公司);Eppendorf Mastercycler Gradient梯度PCR扩增仪(德国Eppendorf公司);AlphamagerTM2200凝胶成像系统(美国AP公司);Eppendorf高速冷冻离心机(德国Eppendorf公司)等。
1.3 引物探针的设计
通过Internet登陆美国国家生物信息技术中心(NCBI),查询检索已公布的IHNV N基因序列(AY442518.1),利用Primer Premier5.0软件设计一对引物和探针,上、下游引物5’端进行生物素标记;探针5’端进行氨基化修饰(表1)。

表1 引物及探针序列
1.4 RT-PCR反应体系的建立
采用RNA提取试剂盒(大连宝生物公司)提取IHNV RNA。RT-PCR扩增的反应体系:在0.2mL PCR反应管中,依次加入10×RT-PCR buffer 2.5mL、dNTP(各 2.5mmol/L)2.5mL、10pmol/mL F10.5mL、10pmol/mL R10.5mL、Inhibiter 0.5mL、AMV XL 0.5mL、AMV Taq(5U/mL) 0.5mL、25mmol/L MgCl25.0mL、总 RNA 3.0mL,加入双蒸水使反应体积达到25mL。以上反应体系中,除了引物、总RNA和双蒸水,其它组分均为RT-PCR试剂盒的组分。RT-PCR反应程序:50℃ 30min;94℃ 2min;然后 94℃ 30s、58℃ 30s、72℃ 30s,30个循环;最后72℃延伸5min,4℃保温。
扩增产物用2%琼脂糖凝胶电泳,在紫外凝胶图像分析系统上观察、分析扩增产物。
1.5 液相芯片检测体系的建立
1.5.1 寡核苷酸探针与微球共价偶联
①将微球漩涡混合20s充分分散;取3×106个微球(75mL),于1.5mL离心管中10000×g离心1min,去上清;
②加入50mL 0.1mol/L甲基咪唑溶液(ph4.5),漩涡混合,超声波处理(0.5-1min);
③加入氨基化探针1.0nmol,漩涡混合;
④加入2.5mL碳二亚胺溶液(10mg的碳二亚胺粉末加入1.0mL的灭菌纯水,现用现配)充分混匀,室温避光孵育30min;
重复④一次。加入1.0mL 0.02% Tween-20,混匀,10000×g离心1min,弃上清;加入1.0mL 0.1% SDS,混匀,10000×g离心1min,弃上清;
用0.1mol/L甲基咪唑溶液(pH 4.5)100mL 重悬微球,2~8℃避光保存,待用。
1.5.2 杂交
杂交体系包括:1.5mL探针偶联微球、33mL 1.5×TMAC 杂 交 液、14.5mL TE、2.5mL RT-PCR产物,空白孔以5mL TE取代PCR产物。混合均匀后于98℃变性10min,在52℃温度下孵育15min,18000×g离心 2min 去上清;加入 50 mL用1×TMAC 杂交液稀释的SA-PE(1:500),选定温度下孵育10min,18000×g离心2min 去上清;加入50mL 1×TMAC 杂交液,漩涡混合使微球重悬,上机分析。
杂交温度的优化,杂交反应时间在15min条件下,根据探针的Tm值,选48℃、50℃、52℃、54℃、56℃等5个温度梯度为研究对象,考察不同杂交温度下液相芯片的检测效果。
1.6 液相芯片检测体系重复性分析
将IHNV的RT-PCR产物用于液相芯片检测试验,做3个重复,计算变异系数。
1.7 液相芯片检测体系特异性分析
将IPNV、SVCV、IHNV、EHNV、VHSV的RT-PCR产物或PCR产物,用液相芯片检测体系进行检测,判断整个液相芯片检测体系对非目标物有无检测信号。
1.8 液相芯片检测体系灵敏度分析
将IHNV病毒核酸进行系列稀释,得到10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8稀释度的模板RNA,用建立的液相芯片体系进行反应,检测方法的灵敏度。
1.9 样本检测
用建立的方法对30份实验室保存的样品进行检测,与世界动物卫生组织《水生动物疫病诊断手册》推荐的RT-PCR法[15]比较,评价其准确性。
2 结果
2.1 RT-PCR体系的建立
将IHNV RNA作为模板进行RT-PCR扩增,产物经2%琼脂糖凝胶电流分析,结果显示扩增出大小为126bp左右的目的条带,与预期扩增的片段大小一致(图1)。
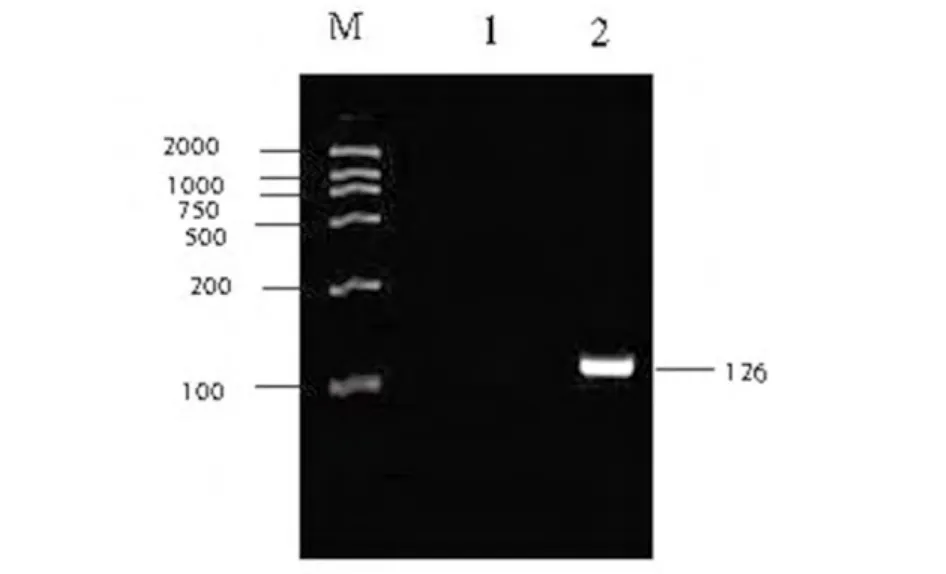
图1 IHNV RT-PCR电泳结果
2.2 液相芯片检测体系的建立
2.2.1 杂交温度的优化
参与计数的荧光编码和微球均在100个以上(图2a),表明用于计算的荧光编码微球数量有效,所产生的荧光强度中位值(MFI)可信,3个荧光编码微球的空白对照MFI值均小于500,试验可进行结果判断。试验结果表明48℃~56℃之间,荧光变动幅度都不大,显示52℃杂交良好,高于54℃时,检测荧光下降剧烈,因此最佳杂交温度选为52℃。
2.2.2 液相芯片检测体系的确立
液相芯片定性比值结果(LQRR)等于样品校正后的MFI值(MFIS)与空白对照MFI平均值(MFIB)的比值,即LQRR=MFIS/MFIB。如果LQRR≥3,判定为阳性样本;如果2≤LQRR<3,则判定为可疑;如果LQRR<2,则判定为阴性。参与计数的荧光编码微球均≥100个,表明用于计数的荧光编码微球数量有效,所产生的MFI值可信,各个荧光编码微球的空白对照MFI均<500,表明结果有效,试验可以进行结果判定。从图2b、2c、2d看出,偶联微球的探针与IHNV RT-PCR产物在Red-A、Yellow-A检测通道下均有荧光信号,表明IHNV液相芯片构建成功。
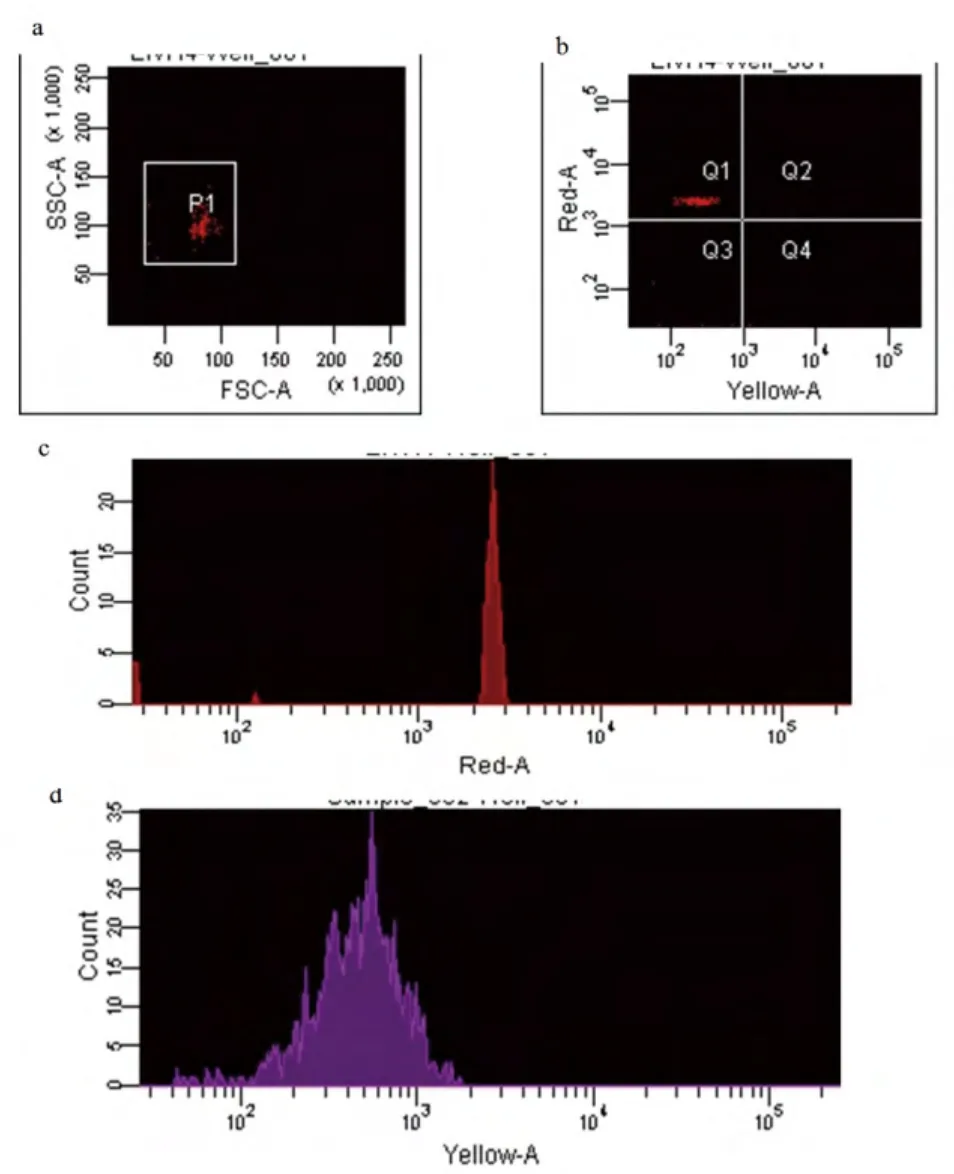
图2 IHNV液相芯片检测结果
2.3 液相芯片检测体系的重复性分析
将提取的IHNV RNA进行RT-PCR扩增,然后在相同的反应条件下进行液相芯片体系进行三次检测,计算各批次间检测的平均荧光强度值的变异系数,结果显示变异系数小于4%,表明该方法具有良好的重复性。
2.4 液相芯片检测体系特异性分析
分别以SVCV、IHNV、EHNV、VHSV和IPNV的RT-PCR产物或PCR产物模板,进行液相芯片检测。结果(表2)表明,对目标病毒的检测结果均为阳性,而对非目标病毒的扩增产物的检测值均为阴性,表明所建立的方法具有很好的特异性。
2.5 液相芯片检测体系灵敏性验证
将IHNV 病毒核酸进行10倍系列稀释,得到10-8、10-7、10-6、10-5、10-4、10-3、10-2、10-1等 不同稀释度的稀释液,用已经建立的液相芯片检测体系进行检测,灵敏度检测结果如表3,检测IHNV最低检测限为100pg。
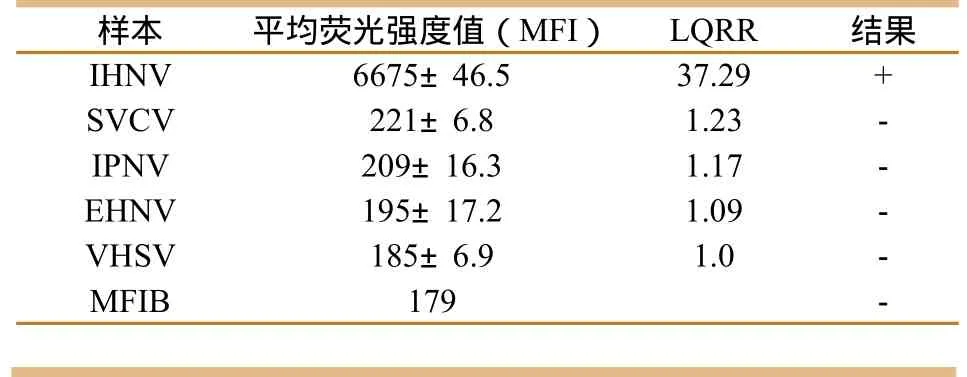
表2 液相芯片检测体系特异性验证
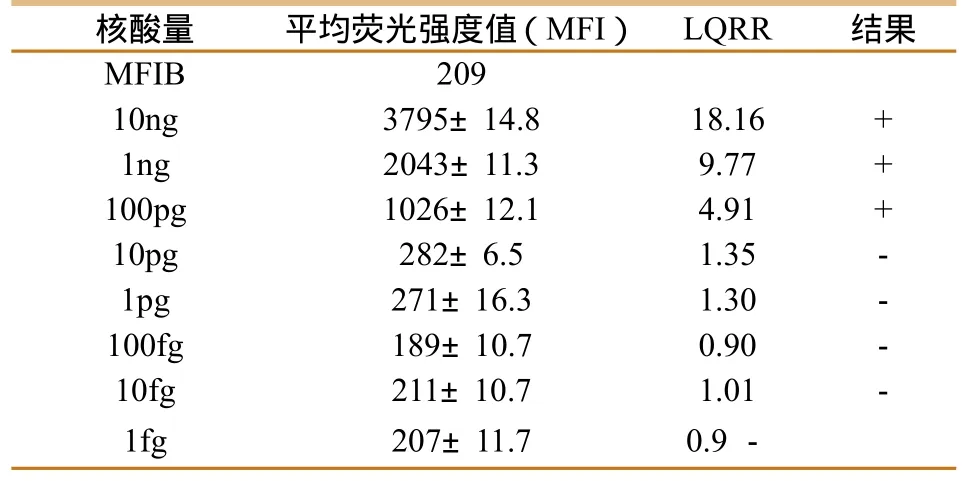
表3 液相芯片检测体系灵敏度验证
2.6 样本检测
对30份实验室保存的样品检测结果显示,5份样品为阳性,该法与OIE推荐的RT-PCR方法检测结果基本一致,但RT-PCR检测结果中有2份阳性样品电泳谱带较弱,较难辩别。液相芯片法比PCR要灵敏(表4)。
3 讨论
本研究建立了传染性造血器官坏死病毒的液相芯片快速检测技术,可应用于快速检测水生动物疫病、进行流行病学调查等工作。
与传统检测方法相比,液相芯片技术集合了核酸扩增、液相微球杂交、激光等诸多检测技术,具有快速、简便、高通量等优点[16]。杂交与检测过程中无需繁琐的洗涤步骤,且整个反应都在同一密闭反应管中进行,避免了开盖的交叉污染。与固相芯片相比,由于采用了流式悬浮微球杂交技术,其反应更为高效,操作也更为灵活。与常规PCR方法相比,由于液相芯片检测体系通过激光检测核酸杂交微球的集合体,有效避免了多种核酸扩增产物的相互干扰,提高了灵敏度。

表4 液相芯片检测体系与PCR对样品检测结果的比较
液相芯片检测的技术关键是设计多重扩增引物与探针[17]。本研究通过比对不同IHNV毒株的基因组序列,初步筛选多种引物,通过反复优化,选定适合检测IHNV的引物。在优化探针实验中发现,G、C碱基含量应该在40~60%,过少不易与PCR产物杂交,过多则会出现特异性杂交。探针内部的互补序列如果超过4个碱基则会出现发夹结构。此外,探针的每个碱基必须与扩增产物一一配对,因此,在设计探针时应选择IHNV高度保守的序列。
在方法建立过程中,本研究对杂交温度选择、碳二亚胺溶液浓度、探针与微球偶联次数等进行了探索。通过多次实验,发现杂交温度的主要根据探针Tm值而确定,一般选择Tm值上下各6℃范围进行摸索。碳二亚胺溶液最合适浓度为10mg/mL,低于此浓度会影响偶联。探针与微球偶联次数在2~3次较为合适,如果偶联不成功可以增加次数,但不要超过5次,否则本底值过高,会影响结果。同时研究表明,在分析结果时,首先要圈定微球范围(如图2a),尽量圈定微球集中地区域,分散于其他位置的微球可以忽略不计,否则会造成结果的偏差。
由本实验中对30样品临床检测结果可知,液相芯片检测结果与传统PCR方法基本一至,但PCR检测结果中有2份样品电泳带较弱,肉眼较难辩别,而液相芯片检测结果为阳性,说明灵敏度比传统PCR方法高。所建立的液相芯片检测体检测IHNV最低限量为100pg。
本方法能够对传染性造血器官坏死病毒进行快速检测,从样品处理到出结果仅需2.5小时左右。由于采用了接近生物反应体系的液相芯片系统和特异性的探针,使该方法的特异性高于传统检测方法,大大杜绝了非特异性扩增造成的假阴性结果。采用了液相反应体系,使该方法灵敏度高于PCR,避免了PCR检测中溴化乙锭对人员和环境的污染,非常适合对进出境水生动物进行高通量检测。
[1]陈红莲,王永杰,蒋业林,等.传染性造血器官坏死病研究进展[J].安徽农业科学,2012,40(21):11128-11132.
[2]徐立蒲,王小亮,杨丽文,等.传染性造血器官坏死病诊断及防控的研究进展[J].中国畜牧兽医,2013,40(3):209-215.
[3]Palmer A D,Emmenegger E J.Susceptibility of koi and yellow perch to infectious hematopoietic necrosis virus by experimental exposure[J].J Aquat Anim Health,2014,26(2):78-83.
[4]徐黎明,刘红柏,尹家胜,等.传染性造血器官坏死病毒糖蛋白原核表达及免疫原性分析[J].病毒学报,2013,29(5):529-534.
[5]Garver K A,Mahony A A,Stucchi D,et al.Estimation of parameters influencing waterborne transmission of infectious hematopoietic necrosis virus (IHNV) in Atlantic salmon(Salmo salar) [J].PLoS One,2013,05 (12).
[6]吉尚雷,李月红,卢玉婷,等.一株传染性造血器官坏死病毒(IHNV)的分离与鉴定[J].中国兽医杂志,2014,50(4):80-82,85.
[7]岳志芹,刘荭,梁成珠,等.实时定量RT-PCR检测鱼类传染性造血器官坏死病毒方法的建立与应用[J].水生生物学报,2008,32(1):91-95.
[8]杨映,陈进会,于辉等.鱼类传染性造血器官坏死病检测方法研究进展[J].广东畜牧兽医科技,2013,38(1):1-4.
[9]Hulse R E,Kunkler P E,Fedynyshyn J P,et al.Optimization of multiplexed bead-based cytokine immunoassays for rat serum and brain tissue[J].Neurosci Methods,2004,136(1):87-98.
[10]Maskos U,Southern E M.A study of oligonucleotide reassociation using large arrays of oligonucleotides synthesised on a glass support.[J].Nucleic Acids Res,1993,21(20):4663-4669.
[11]Peterson A W,Wolf L K,Georgiadis R M.Hybridization of mismatched or partially matched DNA at surfaces[J].J Am Chem Soc,2002,124(49):14601-14607.
[12]Gotoh M,Hasegawa Y,Shinohara Y,et al.A new approach to determine the effect of mismatches on kinetic parameters in DNA hybridization using an optical biosensor[J].DNA Res,1995,2(6):285-293.
[13]Alam M.Diagnostic limitations to accurate diagnosis of cholera[J].Clin Microbiol,2010,48(11) :3918 –3922.
[14]Bessede E,Delcamp A,Sifre E.New methods for detection of campylobacters in stool samples in comparison to culture[J].Clin Microbiol,2011,49(3):941–944.
[15]世界动物卫生组织.传染性造血器官坏死病毒[EB/OL].水生动物疾病诊断手册,2012,300-313.(http://www.oie.int/international-standard-setting/aquatic-code/access-online/)
[16]Baums IB.Luminex detection of fecal indicators in river samples,marine recreational water,and beach sand[J].Mar Pollut Bull,2007,54(5):521–536.
[17]Liu J,Meng C,Zhang SH,et al.Multiplex reverse transcription PCR Luminex assay for detection and quantitation of viral agents of gastroenteritis[J].Clin Virol,2011,50(4):308 –313.
