浅说活化能
2015-05-15王文林
王文林
摘要:通过文献研究澄清了活化能的概念,认为活化能不随温度的变化而改变。中学教材没给活化能下定义,是考虑到对于大多数非基元反应,它们的活化能其实是表观活化能。
关键词:活化能;基元反应;表观活化能
文章编号:1005–6629(2015)2–0081–03 中图分类号:G633.8 文献标识码:B
在中学化学教材中出现的科学概念,没有给出定义的并不多见,活化能就是一个特例。课程标准对活化能的要求是:知道活化能的涵义及其对化学反应速率的影响[1]。中学教材上:催化剂能加快反应速率,是因为它能改变反应的路径,使反应所需的活化能降低……就使反应体系中含有的活化分子百分数提高,从而使有效碰撞的几率提高,反应速率增大[2]。从课标的要求看,教材至少要对活化能给出定义,然而教材并未按课标的要求进行编写,只是对催化剂可降低活化能的作用给予了学生可接受的说明。回避给活化能下定义的原因何在?
1 活化能的定义
下边是几个文献上对活化能的定义。
通常把活化分子具有的最低能量与平均能量的差值叫做反应的活化能。即:要使普通分子(即具有平均能量的分子)变为活化分子(即能量超出一定值的分子)所需的最小能量,称为活化能[3]。
Ea(活化能)=E*(活化分子的平均能量)-E(普通分子的平均能量)[4]。
活化分子的平均能量与反应物分子的平均能量之差,称为活化能[5]。
以上对活化能的定义,只能是对基元反应的活化能而言,而常见的反应大多是非基元反应。 有不同的取值。这里的速率常数和活化能都不是基元反应的,它是指具体反应的,并且阿伦尼乌斯没有给反应的活化能做任何说明。随着科学的发展,人们对化学反应的历程有了认识,就对活化能给出了定义。对活化能的解释性定义是他人的工作。活化能的定义一定是对基元反应的研究结果,这可从速率方程得到证实。
有不同的取值。这里的速率常数和活化能都不是基元反应的,它是指具体反应的,并且阿伦尼乌斯没有给反应的活化能做任何说明。随着科学的发展,人们对化学反应的历程有了认识,就对活化能给出了定义。对活化能的解释性定义是他人的工作。活化能的定义一定是对基元反应的研究结果,这可从速率方程得到证实。
2 速率方程
根据质量作用定律,可写出各基元反应的速率方程;如果能求出每个基元反应的速率常数k和活化能,则可根据稳态近似推导出用反应物的浓度表示的速率方程。对于某一确定的反应来说,速率常数k随温度、催化剂的改变而变化,但不随浓度的改变而变化。
由阿伦尼乌斯公式可见,用反应物浓度表示的速率方程所对应的活化能应是各基元反应活化能的代数和。对于非基元反应(复合反应)的速率方程一定是通过实验测定的,其反应物浓度的次方与反应方程式的物质计量系数无关,它可以是整数、分数甚或是负数。一个反应只有一个速率常数,一个速率常数对应一个活化能。活化能可通过实验求得。
3 实验求得反应的活化能

有些大学教材上把复合反应的活化能叫作表观活化能,这一称谓摆脱了对活化能概念的意义追究,也厘清了活化能与温度的关系。
4 活化能与温度的关系
文献[6~8]对活化能的定义都无法回避温度对活化能数值的影响。在这些书中都有:一般认为温度对反应的活化能不影响,但在温度升高较大时还是会降低反应的活化能的。如此表述是对活化能概念的理性判断而已。
用阿伦尼乌斯公式求反应的活化能,其前提是假设活化能不随温度而改变。在一般的实验条件下,我们可以将活化能当作一个常数。实验结果也证明把活化能当成一个常数是正确的。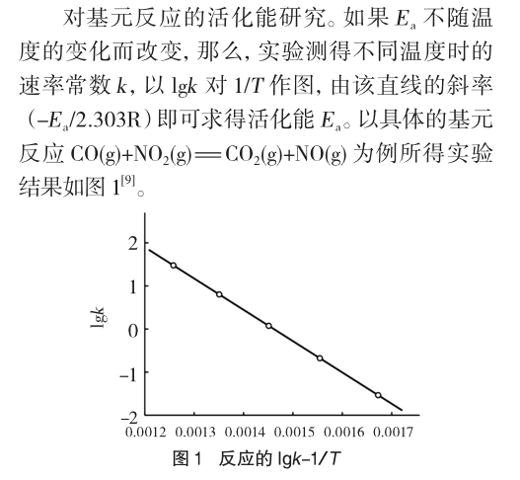
由所得直线可见,活化能是不因温度而改变的。图1实验温度高达870K,所得的点依然在直线上。撇开了实验事实,从活化能的定义看,温度会影响活化能。对如此矛盾的结论到底对学生该怎么讲?笔者认为应尊重事实,突出化学学科特点,讲温度不影响活化能为好。即便是基元反应也是如此,更何况复合反应呢?
温度对化学反应速率的影响解释:一是升高温度,分子运动速率加快,有效碰撞几率增大,从而使反应速率加快;二是升高温度,活化分子的百分数增大,单位时间有效碰撞次数增大,反应速率加快。不讲温度对反应活化能的影响是对的,因为表观活化能没有确切的物理意义可言。由此可见,文献[10]对活化能的定义,把一个反应的活化能看成是个定值,既简单又避开了反应的具体条件,让人不再纠结温度对活化能的影响问题。化学反应的过程就是反应物分子在发生碰撞时,旧化学键的断裂和新化学键的形成过程。旧化学键的断裂需要能量,但从化学键的定义看,这个能量绝非是旧化学键的键能,对于给定的一个化学反应,该能量一定可以视为定值。
这里还须要明确,反应的速率方程和根据阿伦尼乌斯公式求反应的活化能都是要用实验来完成的。一定是先通过实验求得具体反应的速率方程,再通过实验求得反应的表观活化能的。如此丰富的知识在中学并不讲,但中学知识不应与上述的大学知识产生矛盾冲突。
5 回到中学教材
从以上的分析讨论看,中学教材回避了对活化能下定义,既考虑了中学生的接受能力,又因现在流行的几种定义莫衷一是,也回避了温度对活化能影响的难以理解的问题。好在教材如此处理,虽未达到课标的要求,但学生能认识到:活化能是能量,活化能高反应的难度大,反应速率慢。
在催化剂降低活化能的图示说明上,与人教版教材形成鲜明对比的是苏教版和鲁科版教材。
如此图示凸显了催化剂参与化学反应,改变了反应的历程,出现了两个活化能峰值。搞清了活化能的意义,再看这两版教材的插图(如图2和图3),在有催化剂时,出现的两个活化能峰值,仅表示了基元反应的活化能,而并非是原反应的活化能。
6 发展中的化学动力学
对于CO(g)+NO2(g)=CO2(g)+NO(g)的反应,30年前认为:当温度高于225℃时,该反应是一步完成的简单反应;温度低于225℃时,测得其速率方程为ν=k[NO2]2,说明该反应是分步进行的复杂反应[11]。对此反应,不同文献观点有所不同[12][13],文献[14]认为该反应就是简单反应,不再是温度不同反应历程不同。可见,反应动力学的研究还在不断发展中,成熟的经典的反应机理案例并不多。
随着实验技术的发展以及对反应过程的微观认识的深入,实验对反应动力学的支撑作用在不断加强,人们对反应动力学的认识会逐渐走向成熟。
参考文献:
[1]中华人民共和国教育部制定.普通高中化学课程标准[S].北京:人民教育出版社,2003:24.
[2]宋心琦主编.普通高中课程标准实验教科书·化学反应原理(第3版)[M].北京:人民教育出版社,2007:22.
[3][6][9][11][12]傅献彩.大学化学[M].北京:高等教育出版社,1999:473~474,471.
[4][7][10][13][14]刘翊纶,董耐芳,刘达元.基础元素化学[M].北京:高等教育出版社,1992:153~154.
[5][8]北京师范大学,华中师范大学,南京师范大学无机化学教研室.无机化学(上册)(第4版)[M].北京:人民教育出版社,2002:286.
