微小RNA-92在上皮性卵巢癌患者血清中的筛查
2015-05-08郭凤军邹颖刚范丽梅田静岩崔满华
郭凤军,邹颖刚,范丽梅,田静岩,崔满华*
(1.吉林大学第二医院妇产科,吉林长春130041;2.吉林大学第一医院二部泌尿外科,吉林长春130031)
微小RNA-92在上皮性卵巢癌患者血清中的筛查
郭凤军1,邹颖刚1,范丽梅1,田静岩2*,崔满华1*
(1.吉林大学第二医院妇产科,吉林长春130041;2.吉林大学第一医院二部泌尿外科,吉林长春130031)
目的 检测微小RNA-92(microRNA-92,miR-92)在上皮性卵巢癌患者及健康人血清中的表达,分析miR-92与上皮性卵巢癌(epithelial ovarian cancer,EOC)病人的分期及预后的关系,为寻找一种新型的、无创的用于EOC患者早期筛查及判断预后的标志物提供理论依据。方法 采用实时定量PCR(qRT-PCR)的方法检测50例EOC患者和50例健康人群血清中miR-92表达,应用ROC曲线评价其临床诊断价值,并对miR-92的表达与临床病理特征之间的相关性进行分析,评价其判断预后的临床价值。结果 miR-92作为EOC筛查的标志物具有可行性,受试者工作特征曲线下面积达0.803;miR-92在EOC患者血清中的表达量显著高于正常对照组(P<0.05);其表达水平随EOC患者临床分期的进展呈上升趋势,有淋巴结转移组显著高于无淋巴结转移组(P<0.05)。其表达水平与EOC患者年龄等因素无关。结论 miR-92在EOC患者血清中的表达高于健康人群,提示其可能在EOC的发生发展过程中发挥致癌基因的作用,miR-92有望成为EOC早期筛查和评估预后的特异性生物标志物。
miR-92;生物标志物;血清;上皮性卵巢癌
(Chin J Lab Diagn,2015,19:1478)
卵巢癌的发病率在女性恶性肿瘤中位居第6位,而死亡率却位居第1位[1]。早期诊断,患者生存率可达90%以上,但由于本病早期缺乏明显的临床表现,超过三分之二的卵巢癌患者发现时己有远处转移,5年生存率在30%左右[2]。寻找一种无创的、有效的早期诊断卵巢癌的手段对于提高卵巢癌患者的生存率至关重要。近年来人们发现某些微小RNAs(microRNAs,miRNAs)在某些人类肿瘤患者的血液中异常表达,且血液中的miRNA容易获得,不易被内源性的RNA酶降解[3],所以检测循环血中的miRNA是一种很有前景的肿瘤诊断及预后评价方法。然而关于EOC患者循环血中miRNAs的报道很少。本研究检测了miR-92在EOC患者及健康人血清中的表达,旨在为EOC的早期诊断及预后评估提供新的生物标志。
1 对象与方法
1.1 对象及主要试剂
选择2010年3月至2012年5月因EOC在我院行手术治疗的患者50例,健康对照人群50例。患者年龄22-74岁,平均49.2岁。按FIGO的分期标准,Ⅰ期15例,Ⅱ期20例,Ⅲ期8例,Ⅳ期7例;有淋巴转移者24例。病人组术前均未接受过放疗、化疗或激素治疗,术后均经病理确诊。对照组患者年龄23-72岁,平均48.9岁。所有样本均经研究对象同意,并签署知情同意书。实验组术前和对照组均于清晨空腹抽静脉血5ml,离心分离血清后保存于-80℃冰箱中。
血浆miRNAs抽提试剂盒购自美国Qiagen公司,逆转录试剂盒购自美国Promega公司,SYBR qRT-PCR试剂盒购自TaKaRa-宝生物工程有限公司。
1.2 方法
1.2.1 提取血清总RNA 取0.5ml血清,加入1 ml Trizol试剂,按Trizol试剂盒说明提取总RNA。应用美国Thermo公司的NanoDropND-1000紫外分光光度仪检测RNA溶液的D260/D280比值,计算RNA的浓度和纯度,D260/D280比值在1.8-2.1者用于下一步实验检测。
1.2.2 逆转录合成cDNA 取2μg总RNA进行逆转录反应,反应条件为:16℃5min,42℃30min,85℃10min。miR-92PCR扩增的上游引物序列为5′-GCGGTAGCTTATCAGACTGA-3′,下游引物序列为5′-TGCGTGTCGTGGAGTC-3′。内参miR-16PCR扩增的上游引物序列为5′-CACTCCAGCTGGGTAGCAGCACGTAAATA-3′,下游引物序列为5′-TGGTGTCGTGGAGTCG-3′。
1.2.3 实时荧光定量反应 PCR反应条件为:95℃10s,95℃12s,62℃20s。40个循环。
每次循环结束执行溶解曲线进行分析,记录CT值,实验结果以2-△△CT表示miR-92的相对表达量,miR-16作为内参,美国ABI Prism 7300SDS软件进行分析。
1.2.4 统计学分析 采用SPSS17.0软件处理数据,t检验进行数据统计分析,P<0.05为差异有统计学意义。
2 结果
2.1 miR-92在EOC患者血清与对照组血清中的表达
结果表明,miR-92在EOC患者血清中的相对表达量显著高于健康对照组(P<0.05)。受试者工作特征曲线(receiver operator characteristic curve,ROC曲线)分析结果表明,miR-92诊断EOC的敏感性和特异性分别为79.7%和84.5%。ROC曲线下面积(the areas under the ROC curve AUC)为0.803,95%的可信区间为0.735-0.871。
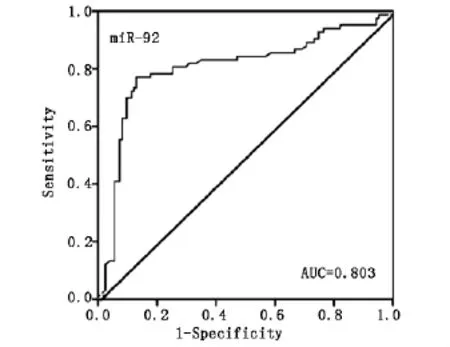
图1 miR-92做为筛查EOC的诊断方法的ROC工作曲线
2.2 EOC患者血清中miR-92表达与临床病理特征间的关系
由表1可见,随着EOC临床分期的进展,miR-92表达有上升的趋势,Ⅲ期和Ⅳ期EOC患者中miR-92的相对表达量显著高于Ⅰ期和Ⅱ期。血清miR-92表达与患者淋巴转移密切相关,有淋巴结转移组显著高于无淋巴结转移组(P<0.05)。血清miR-92表达与EOC患者年龄间无明显相关性。

表1 血清miR-92的表达与EOC患者临床病理特征间的关系
3 讨论
MiRNAs是一类长度为18-24nt的非编码蛋白质的小分子RNA序列,在转录后水平调控靶基因的表达。最近研究表明,miRNAs通过调控肿瘤相关基因表达及介导上皮细胞-间充质转化等多种途径参与肿瘤的发生发展过程[4-6]。文献报道[7],某些循环血液中的miRNAs同组织中的miRNAs一样具有肿瘤相关性和组织特异性。且循环中的miRNAs可以抵抗RNase的破坏,比较稳定,临床容易获得,便于推广应用,所以血液中的miRNAs可用于肿瘤相关研究的检测。
近年,关于血清中的miR-92与肿瘤之间关系的研究报道还不多。其在某些肿瘤患者血清中表达下调,在某些肿瘤患者血清中表达上调。Tanaka M[8]和Romilda C[9]等报道,肝癌和急性白血病患者血浆中的miR-92水平较对照组显著降低,miR-92与miR-618的比值可以有效区分白血病患者和正常人,推测血浆miR-92与miR-618的比值很可能成为一个非常有潜力的筛查白血病的生物指标。Adam L等人[10]的研究报道,血浆中miR-92的表达水平与膀胱癌患者的临床分期呈负相关,推测血浆中miR-92的水平可以作为判断膀胱癌患者预后的生物指标。学者们相继对血浆miR-92在结直肠癌患者早期筛查中的价值进行探讨,一致认为结肠癌患者血浆中的miR-92表达较正常人升高,miR-92可以作为一个无创性的早期诊断结直肠癌的标志物[11-14]。Resnick KE等[15]采用基因芯片的方法对28个卵巢癌患者,15个健康对照的血清进行分析,发现卵巢癌患者血液中miR-21、miR-92、miR-93、miR-126呈高水平,miR-155、miR-127呈低水平。有3例卵巢癌病人CA125表达正常,而miR-21、miR-92、miR-93水平却升高。
本研究进一步扩大样本量,采用qRT-PCR的方法,探讨了是否可以将miR-92作为诊断EOC的标志物。结果表明,miR-92作为EOC筛查的标志物,具有良好的敏感性和特异性,血清中的miR-92能有效区分EOC患者和健康人群。miR-92的高表达与EOC患者的高分期以及淋巴结转移等主要的预后相关因素密切相关。推测miR-92参与了EOC的发展与转移过程,对EOC具有重要的诊断和预测预后的价值。
本研究的样本数还不是很多,未来的研究应该扩大样本量,并进一步探讨miR-92与CA125等其它标志物联合应用对卵巢癌诊断及预后预测的价值,以及miR-92与卵巢癌患者对化疗药的反应间是否存在联系,探讨miR-92在卵巢癌发生发展过程中的作用机理和靶基因,以及可以针对miR-92对卵巢癌患者进行基因治疗。这对于未来卵巢癌患者的诊治将是非常有意义的研究方向。
[1]Permuth-Wey J,Sellers TA.Epidemiology of ovarian cancer[J].Methods Mol Biol,2009,472:413.
[2]Bast Jr RC,Hennessy B,Mills GB.The biology of ovarian cancer:new opportunities for translation[J].Nat Rev Cancer,2009,9(6):415.
[3]Mitchell PS,Parkin RK,Kroh EM.Circulating microRNAs as stable blood-based markers for cancer detection[J].PNAS,2008,105(30):10513.
[4]Aigner A.MicroRNAs(miRNAs)in cancer invasion and metastasis:therapeutic approaches based on metastasis-related miRNAs[J].J Mol Med,2011,89(5):445.
[5]Zhang L,Volinia S,Bonome T,et al.Genomic and epigenetic alterations deregulate microRNA expression in human epithelial ovarian cancer[J].Proc Natl Acad Sci USA,2008,105(19):7004.
[6]le Sage C,Nagel R,Egan DA,et al.Regulation of the p27(Kip1)tumor suppressor by miR-221and miR-222promotes cancer cell proliferation[J].Embo J,2007,26(15):3699.
[7]Ng EK,Li R,Shin VY,et al.Circulating microRNAs as Specific Biomarkers for Breast Cancer Detection[J].PLOS ONE,2013,8(1):e53141.
[8]Cardin R,Piciocchi M,Sinigaglia A,et al.Oxidative DNA damage correlates with cell immortalization and mir-92expression in hepatocellular carcinoma[J].BMC Cancer,2012,12:177.
[9]Tanaka M,Oikawa K,Takanashi M et al.Down-regulation of miR-92in human plasma is a novel marker for acute leukemia patients[J].PLoS ONE,2009,4(5):e5532.
[10]Adam L,Wszolek MF,Liu CG,Plasma microRNA profiles for bladder cancer detection[J].Urol Oncol,2013,31(8):1701.
[11]Ng EK,Chong WW,Jin H,et al.Differential expression of microRNAs in plasma of patients with colorectal cancer:apotential marker for colorectal cancer screening[J].Gut,2009,58(10):1375.
[12]Huang Z,Huang D,Ni S,et al.Plasma microRNAs are promising novel biomarkers for early detection of colorectal cancer[J].Int J Cancer,2010,127(1):118.
[13]Luo X,Stock C,Burwinkel B,et al.Identification and Evaluation of Plasma MicroRNAs for Early Detection of Colorectal Cancer[J].PLoS One,2013,8(5):e62880.
[14]Liu GH,Zhou ZG,Chen R.Serum miR-21and miR-92aas biomarkers in the diagnosis and prognosis of colorectal cancer[J].Tumour biology,2013,34(4):2175.
[15]Resnick KE,Alder H,Hagan JP,et al.The detection of differentially expressed microRNAs from the serum of ovarian cancer patients using a novel real-time PCR platform[J].Gynecol Oncol,2009,112(1):55.
Detection of Serum MicroRNA-92 in Patients with Epithelial Ovarian Carcinoma
GUO Feng-jun,ZOU Ying-gang,FAN Li-mei,et al.(Department of Obstetrics and Gynaecology,The Second Hospital,Jilin University,Changchun 130041,China)
Objective The present study prospectively detected the status of miRNA-92(miR-92)in the serum of EOC patients and healthy controls,and investigated the relationship between miR-92and the clinical staging and grading of EOC patients.Aim to provide theoretical basis for a new noninvasive screening and assessing prognosis method for EOC patients.Methods The relatively expression levels of miR-92in serum samples from 50EOC patients and 50 healthy controls were measured by using quantitative reverse transcription-polymerase chain reaction(qRT-PCR).ROC curve was applied to evaluate the clinical diagnosis value.In addition,the associations between serum miR-92concentrations and clinical characters were analysed to assesse the clinical prognosis value.Results As a maker of EOC,serum miR-92is feasible with 0.803the areas under the receiver operator characteristic curve.The serum concentration of miR-92in EOC patients was significantly higher than that in healthy controls(P<0.05).The expression of miR-92 was correlated to progression of the clinical stages and regional lymph nodes(P<0.05),There was no significant association between expression of miR-92and age.Conclusion These findings imply that expression of miR-92in EOC patients was significantly higher than healthy controls and miR-92may promote the initiation and progression of EOC.The detection of miR-92in serum might become a novel non-invasive tumor biomarker in early detection and assessment of prognosis of EOC.
MiR-92,Biomarker,Serum,Epithelial ovarian carcinoma
R737.31
A
2014-03-06)
1007-4287(2015)09-1478-03
吉林大学白求恩青年科研基金项目(2013206037)
*通讯作者
