共培养体系间充质干细胞对同源内皮祖细胞增殖和血管形成的影响
2015-05-07冯文磊徐芳洁王艳杰陈雪玲吴向未
冯文磊,张 猛,徐芳洁,王艳杰,陈雪玲,吴向未
0 引 言
心肌梗死后心肌细胞将不可逆丢失,被纤维瘢痕组织取代,最终导致心力衰竭。移植细胞在心肌损伤部位存活率低,对心脏功能的改善有限[1]。骨髓中至少存在3 种干/祖细胞系统:间充质干细胞系统、内皮祖细胞系统和造血干细胞系统,它们生物学行为密切耦联[2]。间充质干细胞(mesenchymal stem cells,MSCs)是中胚层来源的具有高度自我更新增殖能力和多向分化潜能的干细胞[3],在特定条件下能分化为骨、软骨、脂肪、内皮和心肌等多种组织细胞[4-8]。内皮祖细胞(endothelial progenitor cells,EPCs)是一类能高度增殖、特异分化为血管内皮细胞、但尚未表达成熟血管内皮细胞表型的祖细胞[9]。已有研究证实,MSCs 能分泌包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、成纤维细胞生长因子(fibroblast growth factor,FGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)、转 化 生 长 因 子-β(transforming growth factor-β,TGF-β)、肝细胞生长因子(hepatocyte growth factor,HGF)等在内的多种生长因子,这些生长因子在各种生理活动中扮演着重要的角色,可以调节多种细胞的功能和活性[10-12]。Transwell 小室是一种特殊的共培养工具,细胞分泌的生物活性物质通过微孔可以相互交通实现非接触共培养。本实验旨在通过分离培养鉴定骨髓源MSCs 和EPCs,并在Transwell 小室共培养以研究MSCs 对EPCs 增殖和血管形成的影响。
1 材料与方法
1.1 材料 健康清洁型C57B/L6 小鼠,4 ~6 周龄,20 ~22 g,雌雄不拘,购自新疆医科大学实验动物中心,动物合格证号:SCXK(新)2011-0001,小鼠于光照良好、温度22 ℃、湿度50%~70%环境下饲养,自由饮水、饮食。通风和湿度适宜的清洁级动物房内常规饲养,自由摄食饮水。胎牛血清(Gilbco,美国),LG-DMEM 培养基(Gilbco,美国),PBS(Hy-Clone,美国),EGM2-MV 培养基(Lonza,瑞士),青霉素、链霉素(Solarbio,中国),2.5 g/L 胰蛋白酶(HyClone,美国),人纤连蛋白(BD,美国),MTT(Sigma,美国),二甲基亚砜(Sigma,美国),多聚甲醛固定液(赛驰生物,中国),成骨、成软骨、成脂诱导培养基及茜素红、阿利新蓝、油红O 染料(Cyagen Biosciences,美国),基质胶(BD Biosciences,美国),抗小鼠sca-1-FITC、CD29-APC、CD45-PerCP-Cy5.5、CD11b-PE、CD34-FITC、CD133-PE、VEGFR2-APC 及抗IgG 同型对照(eBioscience,美国),EdU 试剂盒(锐博,中国),96 孔、24 孔Transwell 小室(Coning,美国),细胞培养皿、培养板(Coning,美国),酶标仪(Bio-Rad,美国),荧光倒置相差显微镜及图像采集系统(Leica,德国),激光共聚焦显微镜(Zeiss LSM510,德国),流式细胞仪(BD,美国)。
1.2 方法
1.2.1 MSCs 和EPCs 的分离培养 取小鼠1 只,脱颈处死,75%乙醇浸泡5 min,分离小鼠下肢,剔除股骨与胫骨肌肉组织与筋膜,置于PBS 中。剪去长骨两端骨骺,以含10%FBS 的LG-DMEM 培养基反复冲洗骨髓腔直至发白,冲出骨髓于60 mm 培养皿中,吹打均匀放入37 ℃、体积分数为5%的CO2饱和湿度培养箱内培养,48 h 后轻轻晃动培养皿,换新鲜含10%FBS 的LG-DMEM 培养基继续培养MSCs,同时收集离心未贴壁细胞,以EGM-2MV 培养基在预先包被人纤连蛋白的60 mm 培养皿中继续培养,48 h 后吸除旧培养基和未贴壁细胞换新鲜EGM-2MV 培养基继续培养来扩增EPCs。MSCs 和EPCs均为48 h 换液1 次。原代培养的MSCs 与EPCs 至80%~90%融合时皆按1∶2 传代。
1.2.2 MSCs 和EPCs 的表面标记物检测 分别取处于对数生长期的第3 代MSCs 和EPCs,待细胞80%~90%融合时,2.5 g/L 胰蛋白酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,弃上清,PBS 清洗2 遍,PBS 重悬细胞,吹打均匀调整细胞密度为1×106/mL,分装每管100 μL,分别加入直接荧光标记MSCs 抗小鼠sca-1-FITC、CD29-APC、CD45-PerCP-Cy5.5、CD11b-PE 和直接荧光标记EPCs 抗小鼠CD34-FITC、CD133-PE、VEGFR2-APC。分别以IgG-FITC、IgG-APC、IgGPerCP-Cy5.5、IgG-PE 为同型对照,不标记细胞为空白对照。4 ℃孵育1 h,每15 min 轻摇1 次。PBS 洗除未标记上的抗体,10 g/L 多聚甲醛固定,流式细胞仪检测表面标记物表达情况。
1.2.3 MSCs 和EPCs 的功能鉴定 ①MSCs 成骨诱导分化:第2 代细胞80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,调整细胞密度以3×104个/cm2在6 孔板用成骨诱导分化培养基培养3 周,茜草色素红染色,镜下观察钙结节形成情况。②MSCs 成软骨诱导分化:第2 代细胞80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,调整细胞密度3×104个/cm2在,用成软骨诱导分化培养基培养3周,阿利新蓝染色,镜下观察。③MSCs 成脂诱导分化:第2 代细胞80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,调整细胞密度3×104个/cm2,培养至100%铺满,成脂诱导分化培养基培养3 d,更换为LG-DMEM 培养基,24 h后再次更换为诱导培养基,循环3 ~5 次,最后LGDMEM 培养基培养7 d,油红O 染色,镜下观察脂滴形成情况。④EPCs 的体外成血管能力检测:在96孔板的每孔中铺50 μL 基质胶,消化第3 代EPCs,EGM-2MV 培养基制成单细胞悬液,细胞计数,按1×104个/孔细胞密度接种于基质胶上,轻轻拍打,使细胞接种均匀。倒置显微镜观察小管形成情况。
1.2.4 MTT 比色法检测共培养MSCs 对EPCs 增殖影响 第2 代EPCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于96 孔Transwell 培养板内下室,每孔EGM-2MV 培养基加至250 μL,共接种48 孔。第2 代MSCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于96 孔Transwell培养板上室,然后每小室EGM-2MV 培养基加至80 μL,共接种24 孔。以上室接种MSCs 下室接种EPCs 为实验组,以仅下室接种EPCs 为对照组。培养24 h 后,每组按顺序各取3 孔去掉Transwell 小室,每孔加入10 μL MTT(5 mg/mL),培养4 h 后弃去上清液,每孔加入150 μL 二甲基亚砜,震荡仪低速震荡10 min,酶标仪检测492 nm 波长吸光度值(A值)。连续测定8 d。各组设与试验平行不加细胞只加培养液的空白对照孔。
1.2.5 EDU 荧光标记法检测共培养MSCs 对EPCs DNA 合成的影响 第2 代EPCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于预先放置有盖玻片的24 孔Transwell 培养板内下室,每孔EGM-2MV 培养基加至600 μL,共接种6 孔。第2 代MSCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于24 孔Transwell 培养板上室,然后每小室EGM-2MV 培养基加至100 μL,共接种3 孔。培养72 h 后吸弃旧培养基,加现配50 μmol/L EdU培养基500 μL,孵育4 h。取出盖玻片,严格按照使用说明书对细胞进行固定、脱色、透膜、Apollo 染色及DNA 染色。激光共聚焦显微镜观察镜下荧光染色情况并选取5 个视野(中央、3、6、9、12 点位置)拍照,最后用Aim Image Examiner 软件分析细胞核染色重合的面积比例。
1.2.6 体外成血管实验检测共培养MSCs对EPCs成血管影响 第2 代EPCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于预先铺有250 μL 基质胶的24 孔Transwell 培养板内下室,每小室EGM-2MV 培养基加至600 μL,共接种6 孔。第2 代MSCs 达到80%~90%融合时,胰酶消化3 ~5 min,以离心半径14 cm、1000 r/min 离心5 min,用含5%胎牛血清的EGM-2MV 培养基制备细胞悬液,以1×104个/cm2接种于24 孔Transwell 培养板上室,每小室EGM-2MV 培养基加至100 μL,共接种3 孔。10 h后移去Transwell 小室,倒置显微镜观察小管形成情况并选取5 个视野(中央、3、6、9、12 点位置)拍照。
1.3 统计学分析 采用SPSS 17.0 软件进行统计分析,计量资料以均数±标准差表示,所有实验结果重复3 次。组间均数比较采用独立样本t 检验。以P≤0.05 为差异有统计学意义。
2 结 果
2.1 MSCs 和EPCs 细胞形态的观察 MSCs 于48 h内贴壁,细胞形态不均一,以成纤维样细胞为主,4 d 可见集落形成,细胞沿集落周边呈放射形生长,8 ~10 d 铺满,以纺锤形细胞为主,经传代培养后形态渐趋均一呈“漩涡”状。所收集上清液中EPCs 48 h 后贴壁,伸展成长梭形,4 d 左右有细胞集落形成,中央为圆形细胞群,周边有梭形细胞放射形生长,10 ~12 d 细胞可达到80%~90%融合,晚期呈“铺路石”状。见图1。
2.2 流式细胞仪检测MSCs 和EPCs 的表面标记物表达 结果显示第3 代MSCs 高表达Sca-1 和CD29,阳性率分别为(97.30±0.85)%和(98.47±1.57)%;而低表达CD45 和CD11b,阳性率分别为(1.98±0.23)%和(1.42±0.39)%,符合MSCs 特性。第3 代EPCs 均高表达CD34、CD133 和VEGFR2,阳性率分别为(90.72±1.43)%、(90.02±2.21)%和(91.67±1.65)%,符合EPCs 特性。见图2。
2.3 MSCs 和EPCs 的功能鉴定结果 第3 代MSCs 可诱导分化成骨细胞:经成骨诱导后形态由梭形变为不规则形,诱导14 d 时可见散在分布小褐色结节,诱导21 d 后结节中心的细胞逐渐融合失去细胞结构,钙结节形成明显,经茜草色素红染色呈红色。第3 代MSCs 可诱导分化成软骨细胞:经成软骨诱导后细胞形态变化不大,诱导21 d 后行阿利新蓝染色,镜下观察可见诱导分化形成的软骨细胞胞被染成浅蓝色。第3 代MSCs 可诱导分化成脂肪细胞:细胞成脂诱导后细胞中有小脂滴形成,诱导21 d 后融合成大脂滴,经油红O 染色,脂滴被染成亮红色。第3 代EPCs 体外形成血管腔样结构:2 ~4 h后细胞变形拉长,6 ~8 h 细胞迁移聚集,首尾相接,形成血管腔样结构,10 ~12 h 达到顶峰。见图3。
2.4 MTT 比色法检测共培养MSCs 对EPCs 增殖影响 实验组24、48 h A492值均较对照组高,但差异无统计学意义(P >0.05);实验组第3-8 天A492值均高于对照组,差异均有统计学意义(P <0.05)。见表1。
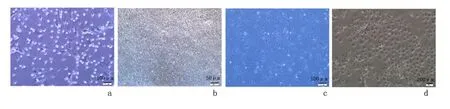
图1 显微镜下观察MSCs 和EPCs 形态学动态观察结果Figure 1 Morphological characteristics of MSCs and EPCs
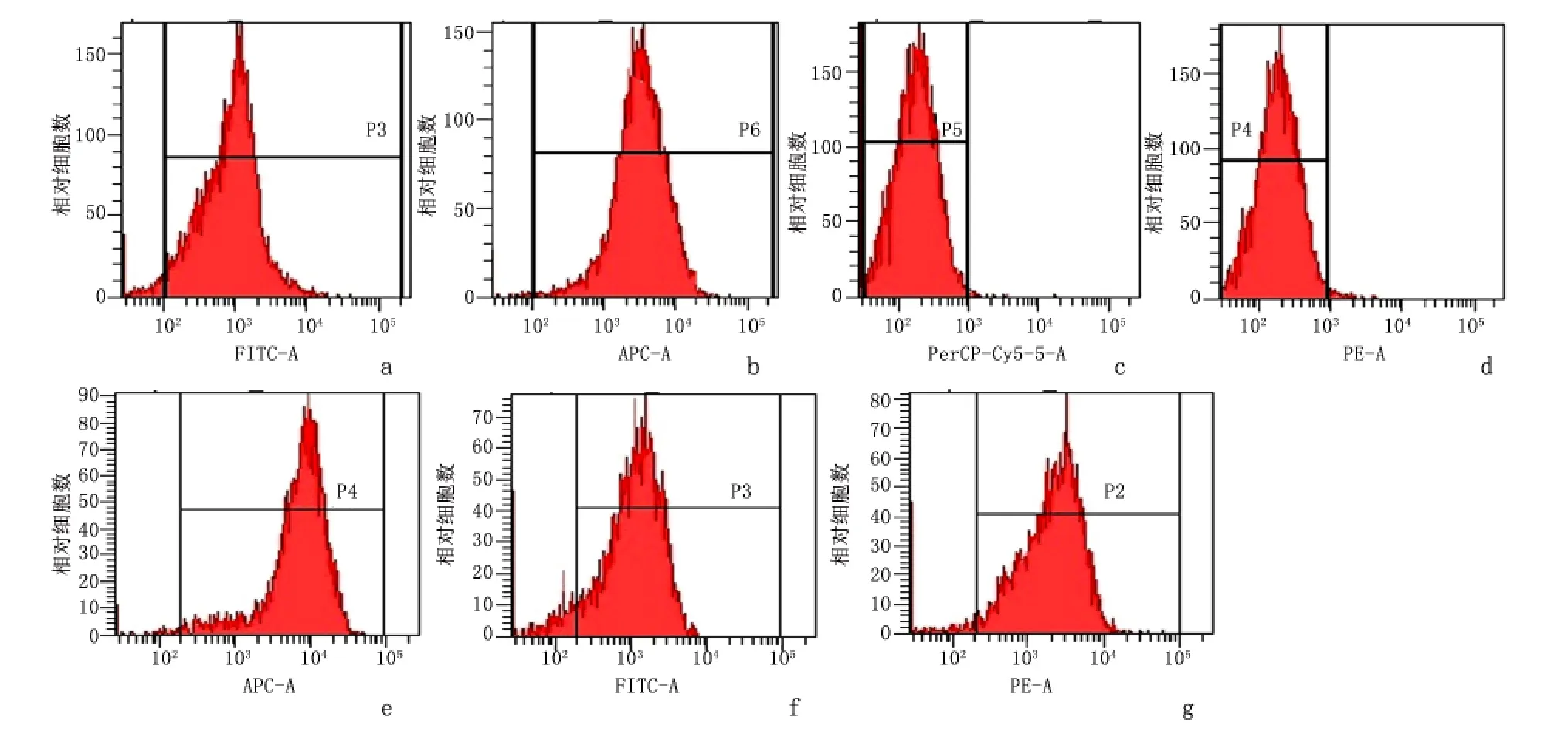
图2 MSCs 和EPCs 的表面标记物阳性率流式检测结果Figure 2 Cellular surface antigens on MSCs and EPCs detected by FCM
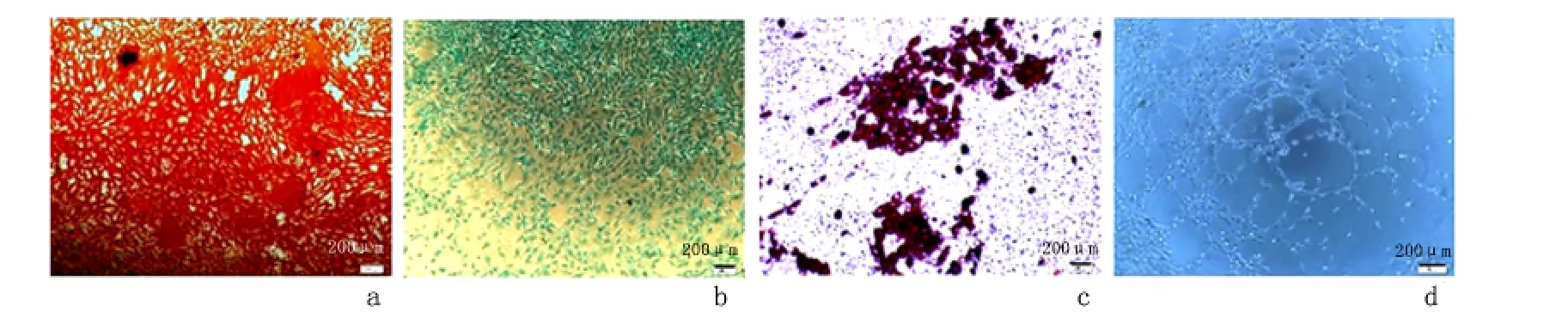
图3 MSCs 成骨成软骨成脂诱导分化和EPCs 成血管功能鉴定结果Figure 3 Differentiation of MSCs into osteoblasts,chondrocytes and adipocytes and angiogenesis of EPCs under the light microscope
表1 MTT 比色法检测共培养MSCs 对EPCs 增殖影响,n=3)Table 1 Trained MSCs effects on EPCs proliferation defermined by MTT,n=3)

表1 MTT 比色法检测共培养MSCs 对EPCs 增殖影响,n=3)Table 1 Trained MSCs effects on EPCs proliferation defermined by MTT,n=3)
与对照组比较,*P <0.05
组别 第1 天 第2 天 第3 天 第4 天不 同时间A第492 5值 天 第6 天 第7 天 第8天对实照验组组 00..22 34 69±±00..00 3206 00..22 4599±±00..00 22 69 00..3462 24±±00..00 32 20 * 00..4555 93±±00..00 23 95 * 00..5675 62±±00..00 34 91 * 00..6754 59±±00..00 42 29 * 00..6767 52±±00..00 33 31 * 00..67 77 25±±00..00 22 9 9*
2.5 EdU 荧光标记法检测共培养MSCs 对EPCs DNA 合成的影响 激光共聚焦显微镜不同通道下观察到处于细胞增殖期即DNA 合成期的EPCs 细胞核被染成绿色,而所有细胞核被染成红色,同一细胞核如果双染重合后则为黄色。经过Aim Image Examiner 软件分析结果显示同样经过72 h 培养,实验组处于DNA 合成期的比例[(89.00±5.30)%]高于对照组[(76.00±3.38)%],差异有统计学意义(P <0.01)。
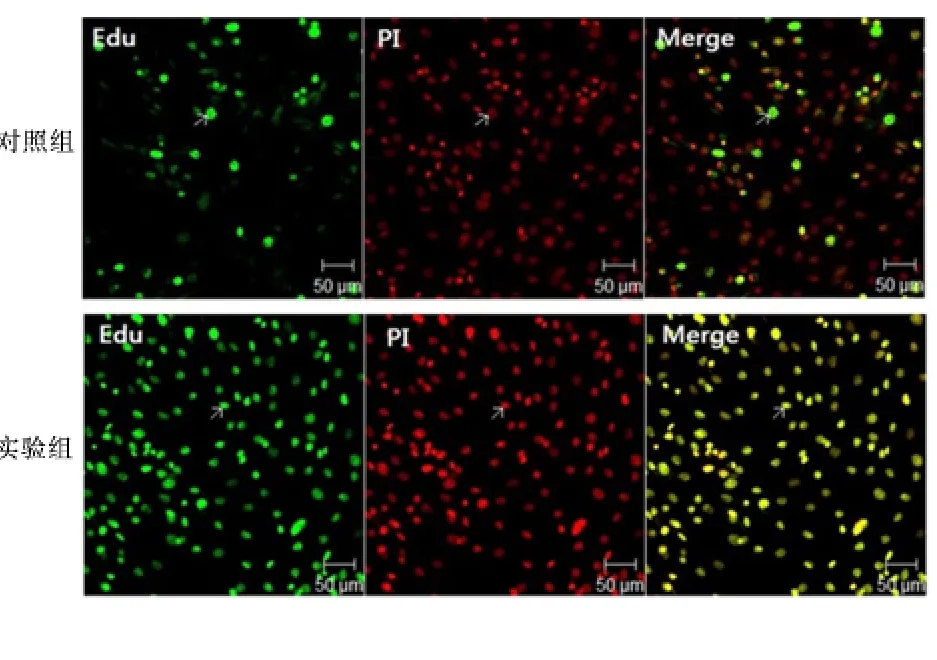
图4 EdU 荧光标记法检测共培养MSCs 对EPCs DNA 合成影响结果Figure 4 EPCs co-cultured with MSCs by EdU fluorescent assay
2.6 体外成血管实验检测共培养MSCs 对EPCs 血管形成影响 实验组血管腔样结构数目和联结点(13.53±2.33 和16.60±2.23)均较对照组(10.80±1.82和13.07±2.81)升高,差异有统计学意义(P <0.05)。见图5。
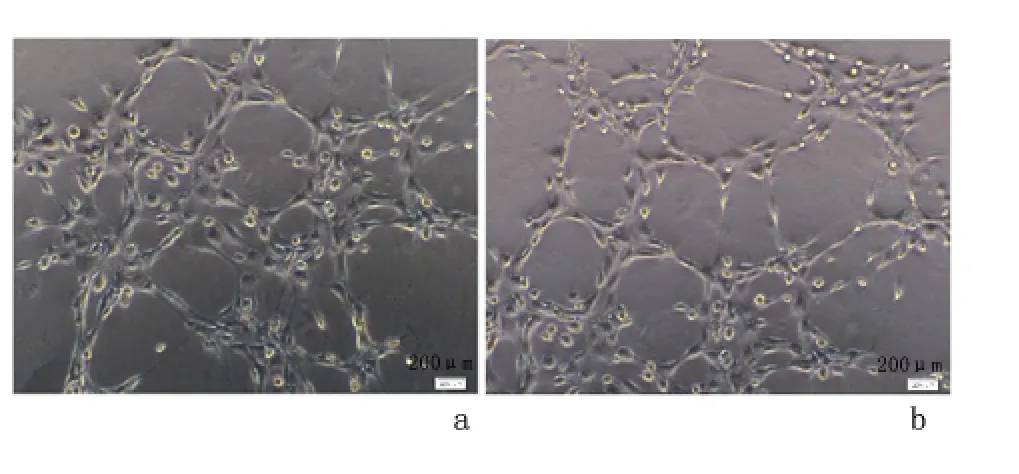
图5 体外成血管实验检测共培养MSCs 对EPCs 血管形成影响结果Figure 5 Tube-like structures and connection points of EPCs co-cultured with MSCs
3 讨 论
1976 年,Friedenstein 等[13]首次从骨髓中分离出MSCs,1997 年,Asahara 等[14]首次从外周血中分离出EPCs,但随后研究证实EPCs 源于骨髓[15]。相较于其他组织来源,骨髓中的MSCs 和EPCs 含量更为丰富且增殖能力更强[16]。本实验利用MSCs与EPCs 差时贴壁的特性[17]从一份骨髓中一次性将2 种细胞分离出来,此法简单易行,避免了分选和反复离心造成的细胞损伤和丢失,最大程度保存了MSCs 和EPCs 生长所需的微环境,可使其保持旺盛的增殖能力。结果表明骨髓中的MSCs 贴壁时间较快,2 ~4 h 即可贴壁,而EPCs 贴壁较慢,实验在贴壁培养48 h 后收集未贴壁细胞另行用专用培养基培养,可粗略地将MSCs 与EPCs 分离。但差时贴壁的细胞成分仍较复杂,结合多次传代以逐渐提高细胞纯度。
MSCs 和EPCs 细胞形态无特异性,国内外普遍采用检测细胞表面标志物和细胞分化功能进行鉴定。MSCs 较为公认的是高表达Sca-1、CD29、CD73、CD90、CD105、CD44,同时低表达或不表达CD45、CD11b、CD34 等[18-19],EPCs 普遍认为高表达CD34、CD133、VEGFR2[20-21]。MSCs 功能鉴定的金标准是向骨细胞、脂肪细胞、软骨细胞的分化潜能[19,22-23];EPCs的功能鉴定是能在基质胶上形成血管腔样结构[22,24]。本实验所分离培养的MSCs 和EPCs 经流式检测分别呈现Sca-1+CD29+CD45-CD11b-与CD34+CD133+VEGFR2+细胞群体特征,MSCs 经诱导可向成骨细胞、脂肪细胞、软骨细胞方向分化,EPCs 可在基质胶上形成血管腔样结构。
5-乙炔基-2'脱氧尿嘧啶核苷是一种胸腺嘧啶核苷类似物,能够在细胞增殖时期代替胸腺嘧啶(T)渗入正在复制的DNA 分子中,通过基于EdU 与Apollo®荧光染料的特异性反应快速检测细胞DNA复制活性。与BrdU 检测方法相比,EdU 的荧光染料Apollo 的分子只有BrdU 抗体的1/500,在组织和细胞内更容易扩散,检测方法更快速、更灵敏、更准确,且无需进行化学处理,可有效避免样品损伤,故近年取代Brd 用来检测DNA 复制及细胞增殖[25]。标记整个细胞的过程与细胞增殖活性有关,而染色率与细胞活性有关[26],所以本实验根据EPCs 的生长曲线选取处于对数生长期的细胞进行研究。用激光共聚焦显微镜拍照后,我们发现如果按照说明书运用Image-Pro plus 软件来计算EPCs 的增殖率,肉眼计数会有一定的主观性,所以采用了Aim Image Examiner 软件计算,只要有DNA 合成的EPCs 细胞核部位就会被染上绿色,而全部细胞核则被染上红色,然后计算所有被染上绿色部位的面积所占红色部位的面积比例来检测EPCs 的增殖能力。统计结果显示,与对照组相比实验组的EPCs 细胞核被染上绿色的部分更多,说明实验组的EPCs 的DNA 合成能力更强,这与传统检测细胞增殖能力的MTT 比色法结果一致,说明当EPCs 与MSCs 共培养时其增殖能力更强。
已有研究显示,对心肌梗死和心肌病患者或动物模型植入干细胞后能够显著改善心功能,减少恶性心律失常的发生并降低死亡率[27-28]。传统观点认为,植入的干细胞可以在心脏组织中分化为心肌样细胞和血管内皮细胞,从而逆转心室重构的过程[29]。遗憾的是,近年来的研究表明只有少数移植的干细胞能够到达梗死部位并分化为心肌样细胞或血管内皮细胞,所以难以用移植后干细胞分化为正常心肌细胞来解释心功能改善的结果[30]。新的观点认为,干细胞除了定向分化为特定的细胞,旁分泌的多种细胞因子和富含microRNA 的囊泡才可能是改善梗死后心功能的主要因素[31-32]。而且,MSCs 旁分泌的生长因子及其他生物活性物质才是促进血管形成的主要因素与细胞分化相关不大[33]。本实验中接种在上室的MSCs 旁分泌VEGF、IGF-1、FGF、PDGF、TGF-β、HGF等生长因子及其它生物活性物质可通过小室底部的滤膜进入下室,实验结果显示,实验组EPCs 形成的小管样结构不论是数目还是联结点都比对照组多,说明MSCs 旁分泌的生物活性物质对EPCs 的血管形成能力有促进作用。
本实验只是在体外利用共培养体系证实MSCs对EPCs 的增殖和血管形成能力有促进作用,后续实验将进行心肌梗死动物模型体内联合移植MSCs和EPCs,观察治疗作用并探讨机制,以期为临床细胞治疗心肌梗死寻找到新的治疗靶点或靶向药物。
[1] Wei H,Ooi TH,Tan G,et al.Cell delivery and tracking in post-myocardial infarction cardiac stem cell therapy:an introduction for clinical researchers[J].Heart Fail Rev,2010,15(1):1-14.
[2] Laine SK,Hentunen T,Laitala-Leinonen T.Do microRNAs regulate bone marrow stem cell niche physiology[J].Gene,2012,497(1):1-9.
[3] Ghannam S,Bouffi C,Djouad F,et al.Immunosuppression by mesenchymal stem cells:mechanisms and clinical applications[J].Stem Cell Res Ther,2010,15,1(1):2.
[4] Heino TJ,Hentunen TA.Differentiation of osteoblasts and osteocytes from mesenchymal stem cells[J].Curr Stem Cell Res Ther,2008,3(2):131-145.
[5] Matsuda C,Takagi M,Hattori T,et al.Differentiation of human bone marrow mesenchymal stem cells to chondrocytes for construction of three-dimensional cartilage tissue[J].Cytotechnology,2005,47(1-3):11-17.
[6] Gao Y,Xue J,Li X,et al.Metformin regulates osteoblast and adipocyte differentiation of rat mesenchymal stem cells[J].J Pharm Pharmacol,2008,60(12):1695-1700.
[7] Silva GV,Litovsky S,Assad JA,et al.Mesenchymal stem cells differentiate into an endothelial phenotype,enhance vascular density,and improve heart function in a canine chronic ischemia model[J].Circulation,2005,111(2):150-156.
[8] Yan X,Lv A,Xing Y,et al.Inhibition of p53-p21pathway promotes the differentiation of rat bone marrow mesenchymal stem cells into cardiomyocytes[J].Mol Cell Biochem,2011,354(1-2):21-28.
[9] Peichev M,Naiyer AJ,Pereira D,et al.Expression of VEGFR-2 and AC 133 by Circulating human CD34(+)cells identifies a population of functional endothelial precursors[J].Blood,2000,95:952-958.
[10] Tang YL,Zhao Q,Qin X,et al.Paracrine action enhances the effects of autologous mesenchymal stem cell transplantation on vascular regeneration in rat model of myocardial infarction[J].Ann Thorac Surg,2005,80(1):229-236.
[11] Centeno CJ,Schultz JR,Cheever M,et al.Safety and complications reporting on the re-implantation of culture-expanded mesenchymal stem cells using autologous platelet lysate technique[J].Curr Stem Cell Res Ther,2010,5(1):81-93.
[12] Kwon HM,Hur SM,Park KY,et al.Multiple paracrine factors secreted by mesenchymal stem cells contribute to angiogenesis[J].Vascul Pharmacol,2014,63(1):19-28.
[13] Friedenstein AJ,Gorskaja JF,Kulagina NN.Fibroblast precursors in normal and Irradiated mouse hematopoietic organs[J].Exp Hematol,1976,4(5):267-274.
[14] Asahara T,Murohara T,Sullivan A,et al.Isolation of putative progenitor endothelial cells for angiogenesis[J].Science,1997,275(5302):964-967.
[15] Asahara T,Masuda H,Takahashi T,et al.Bone marrow origin of endothelial progenitor cells responsible for postnatal vasculogenesis in physiological and Pathological neovascularization[J].Circ Res,1999,85(3):221-228.
[16] Tongers J,Roncalli JG,Losordo DW.Role of endothelial progenitor cells during ischemia-induced vasculogenesis and collateral formation[J].Microvasc Res,2010,79(3):200-206.
[17] Casamassimi A,Balestrieri ML,Fiorito C,et al.Comparison between total Endothelial progenitor cell isolation versus enriched CD133+culture[J].J Biochem,2007,141(4):503-511.
[18] Lee JW,Gupta N,Serikov V,et al.Potential application of mesenchymal stem cells in acute lung injury[J].Expert Opin Biol Ther,2009,9(10):1259-1270.
[19] Wu X,Pang L,Lei W,et al.Inhibition of sca-1 positve skeletal stem cell recruitment by alendronate blunts the anabolic effects of parathyroid hormone on bone remodeling[J].Cell Stem Cell,2010,7(5):571-580.
[20] Sen S,McDonald S,Coates P,et al.Endothelial progenitor cells:novel biomarker And promising cell therapy for cardiovascular disease[J].Clin Science,2011,120(7):263-283.
[21] Navarro-Sobrino M,Hernández-Guillamon M,Fernandez-Cadenas I,et al.The angiogenic gene profile of circulating endothelial progenitor cells from ischemic stroke patients[J].Vascular cell,2013,5(1):3.
[22] Li Q,Wang Z.Influence of mesenchymal stem cells with endothelial progenitor cells in co-culture on osteogenesis and angioge nesis:an in vitro study[J].Arch Med Res,2013,44(7):504-513.
[23] 朱迎兰,朱瑞乔,史小蕾,等.三维联通纳米氧化锆多孔支架对犬骨髓间充质干细胞附着生长的实验研究[J].医学研究生学报,2014,27(6):564-567.
[24] Harris LJ,Zhang P,Abdollahi H,et al.Availability of adipose derived stem cells in Patients undergoing vascular surgical procedures[J].J Surg Res,2010,163:e105-e112.
[25] Kiel MJ,He S,Ashkenazi R,et al.Haematopoietic stem cells do not asymmetrically segregate chromosomes or retain BrdU[J].Nature,2007,449(7159):238-242.
[26] Zeng C,Pan F,Jones LA,et al.Evaluation of 5-ethynyl-2'-deoxyuridine staining as a sensitive and reliable method for studying cell proliferation in the adult nervous system[J].Brain Res,2010,1319:21-32.
[27] Wollert KC,Drexler H.Cell therapy for the treatment of coronary heart disease:a critical appraisal[J].Nat Rev Cardiol,2010,7(4):204-215.
[28] 黄 懿,丁留成,卫中庆.间充质干细胞成平滑肌分化治疗应用的研究进展[J].医学研究生学报,2014,27(3):317-320.
[29] Schulman IH,Hare JM.Key developments in stem cell therapy in cardiology[J].Regen Med,2012,7(6 Suppl):17-24.
[30] Gnecchi M,He H,Noiseux N,et al.Evidence supporting paracrine hypothesis for Akt-modified mesenchymal stem cell-mediated cardiac protection and functional improvement[J].FASEB J,2006,20(6):661-669.
[31] Chen TS,Lai RC,Lee MM,et al.Mesenchymal stem cell secretes microparticles enriched in pre-microRNAs[J].Nucleic Acids Res,2010,38(1):215-224.
[32] Lai RC,Chen TS,Lim SK.Mesenchymal stem cell exosome:a novelstem cell-based therapy for cardiovascular disease[J].Regen Med,2011,6(4):481-492.
[33] Schumann P,Tavassol F,Lindhorst D,et al.Consequences of seed-ed cell type on vascularization of tissue engineering construction in vivo[J].Microvasc Res,2009,78(2):180.
