脑脉1 号胶囊对移植骨髓间充质干细胞存活的影响
2015-05-07黄一挚伍小燕郭建文
陈 朝,黄一挚,伍小燕,黎 奔,陶 文,郭建文
0 引 言
干细胞治疗缺血性脑血管病是目前最前沿的研究课题之一,骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)可以直接诱导为神经干细胞,然后再转化为具有各种功能的神经元、神经胶质细胞,替代由于缺血缺氧坏死的神经细胞,促进神经功能的修复[1]。但当脑组织缺血缺氧时,组织内兴奋性氨基酸、氧自由基、黏附分子、炎症因子分泌增多等因素,导致新移植的BMSCs 在缺血组织存活率和分化率较低,致使其治疗效果受到限制[2-3]。因此,寻找一种有效的促进BMSCs 增殖、提高BMSCs 存活率的方法成为当前研究的热点[4-5]。调节脑中血海的中药复方脑脉1 号(NMYH)在临床上已被证实是治疗缺血中风一有效方剂[6],不仅能改善脑组织微循环,还可抑制炎症反应,促进机体形成有利于移植细胞存活的微环境。本研究将BMSCs 移植于大脑中动脉栓塞模型大鼠,同时给予NMYH,探讨其对移植BMSCs 存活的影响。
1 材料与方法
1.1 实验动物 SPF 级SD 大鼠,3 ~4 月龄,60 只,雄性,体重250 ~330 g,由南方医科大学实验动物中心提供,实验动物的合格证号:0051720。所有大鼠置于清洁级动物房内饲养,光照明暗各12 h,温度20 ℃~25 ℃,湿度45%~55%。
1.2 主要试剂与仪器 NMYH 胶囊(由炙天麻、水蛭、黄芪、制南星、半夏、川芎、益母草组成,广州中医药大学第二附属医院制剂室提供,批号090702),氯甲基苯甲酰氨(Chloromethyl-benzamidodialkylcarbocyanine,CM-Dil)(美国Molecular Probes 公司,批号V22888),兔抗大鼠CD34 抗体(北京博奥森生物技术有限公司,批号BS-0646R),SABC 试剂盒、DAB试剂盒(北京中杉金桥生物技术有限公司,批号分别为SP-9001、ZLI-9032),细胞培养箱(美国Thermo Scientific 公司),脑立体定位仪(美国STOELTING公司),荧光显微镜(瑞士Leica 公司),Image-Pro Plus 6.0 图像分析软件(美国Media Cybernetics 公司,型号41M60032-00032)。
1.3 实验方法
1.3.1 BMSCs 的培养、鉴定及标记 参照文献[7]中的方法进行BMSCs 培养,鉴定及CM-Dil 标记。
1.3.2 大脑中动脉栓塞模型的建立 参照Zea Longa 方法[8]并加以改进。行大脑中动脉栓塞后2 h,拔出栓线长度3 ~4 mm,形成再灌注。模型成功的标志为栓塞对侧肢体偏瘫,行走时向对侧转圈。
1.3.3 分组与用药 手术后按随机区组法将大鼠分为4 组,即模型组、BMSCs 组、NMYH 组、BMSCs+NMYH 组,每组根据取材时间点又分为7、14、21 d组,每组每个时间点均为5 只大鼠。
缺血再灌注24 h 后,BMSCs+NMYH 组大鼠右侧纹状体区(AP=0 mm,MR=2.0 mm,DV=4.5 mm)通过立体定向仪注射10 μL(5×104/mL)细胞悬液,给予NMYH 1.5 g/kg 灌胃(按动物系数折算,相当于70 kg 成人临床剂量的3 倍),1 次/d;BMSCs 组注射等量细胞悬液,等渗盐水灌胃;NMYH 组注射等体积无血清L-DMEM,NMYH 灌胃;模型组注射等体积无血清L-DMEM,等渗盐水灌胃。每周根据大鼠体质量调整灌胃药物的用量和灌胃体积,直至取材。
1.3.4 取材 各组分别于移植后第7、14、21 天灌注取脑,置于4%多聚甲醛中固定24 h。选取前囟后2 mm 的脑组织,转入20%蔗糖溶液中脱水至脑组织下沉,待作冰冻切片检查移植细胞存活情况。其余组织继续置于4%多聚甲醛中,待作石蜡切片用于CD34 免疫组化。
1.4 观察指标
1.4.1 移植细胞在脑内存活情况 取出脑组织,仔细辨认针道位置,去除额极部分,以OCT 包埋,-20 ℃预冻15 min。在距离硬脑膜4.5 mm 处,垂直于进针方向作水平横断面的连续冰冻切片,厚度为20 μm,连切5 片。在荧光显微镜下观察、拍照,于Image-Pro Plus 6.0 图像分析系统中自动测定不同时间点供体细胞所占积分吸光度[9]。
1.4.2 免疫组织化学法检测CD34表达 标本切片常规脱蜡、水化,枸橼酸盐缓冲液(pH 6.0)微波加热修复,3%的过氧化氢阻断内源性过氧化酶活性,正常山羊血清封闭15 min 后滴加一抗(1∶50 的兔抗大鼠CD34),4 ℃过夜,经冷PBS 洗2 次后滴加生物素标记的羊抗兔IgG,室温孵育60 min 后滴加辣根酶标记链酶卵白素工作液,DAB 显色,苏木精复染,梯度酒精脱水,二甲苯透明,中性树胶封固。高倍镜下(×400 倍)在纹状体区随机各取5 个视野计数阳性细胞。
1.5 统计学分析 采用SPSS 11.0 统计软件进行分析,计量资料以均数±标准差表示,所有数据经正态性和方差齐性检验,采用多因素方差分析方法分析。以P≤0.05 为差异具有统计学意义。
2 结 果
2.1 移植细胞在脑内存活情况 BMSCs 组和BMSCs+NMYH 组的BMSCs 移植后第7 天,CM-Dil阳性细胞主要位于针道附近,发出明亮的红色荧光,多为梭形。移植后第14 天,移植细胞进一步向周围迁移,且趋向于缺血周边区,梭形细胞减少,椭圆形或不规则细胞增多。移植后第21 天,CM-Dil 阳性细胞逐渐减少,但荧光依然清晰明亮,主要呈椭圆形或不规则形,见图1。BMSCs 组和BMSCs+NMYH组BMSCs 移植后不同时间点荧光吸光度见表1。与BMSCs 组比较,BMSCs+NMYH 组的荧光吸光度在第14、21 天时均显著增加(P <0.05)。
2.2 CD34 表达结果 BMSCs 移植、NMYH 和时间点对CD34 表达的效应均有显著性意义(FBMSCs=63.280,P=0.000;FNMYH=86.260,P=0.000;F时间=11.069,P=0.000),NMYH 与BMSCs 移植的交互作用有统计学意义(F=8.258,P=0.000);与模型组比较,其余各治疗组在各时间点CD34 的表达均显著增加(P <0.01);与BMSCs 组同时间点比较,NMYH 组在各时间点CD34 的表达差异无统计学意义(P >0.05),而BMSCs+NMYH 组在各时间点CD34 的表达均显著增加(P <0.05)。见表1,图2。

图1 CM-Dil 标记的BMSCs 的立体定向移植后脑内示踪(×100)Figure 1 Tracing in brain of BMSCs labeled by CM-Dil after stereotactic imlantion(×100)
表1 各组大鼠BMSCs 荧光吸光度和CD34 阳性细胞数,n=5)Table 1 Fluorescent integral absorbance of BMSCs and Numbers of CD34 positive cells of rats in different groups,n=5)

表1 各组大鼠BMSCs 荧光吸光度和CD34 阳性细胞数,n=5)Table 1 Fluorescent integral absorbance of BMSCs and Numbers of CD34 positive cells of rats in different groups,n=5)
与BMSCs 组同时间点比较,*P <0.05;与模型组同时间点比较,#P <0.01;与BMSCs 组同时间点比较,△P <0.05
组别 荧光吸光度(×106,A)CD34 阳性细胞(个)模型组第7 天 - 15.20±2.77第14 天 - 19.20±3.11第21 天 - 14.20±2.17 BMSCs 组第7 天 2.15±0.15 23.40±2.07#第14 天 1.23±0.17 27.40±3.44#第21 天 0.23±0.09 23.80±2.49#NMYH 组第7 天 - 24.80±2.39#第14 天 - 27.80±3.96#第21 天 - 25.20±3.70#BMSCs+NMYH 组第7 天 2.40±0.25 27.40±3.21#△第14 天 1.61±0.25* 33.20±4.02#△第21 天 0.36±0.09* 29.40±3.05#△
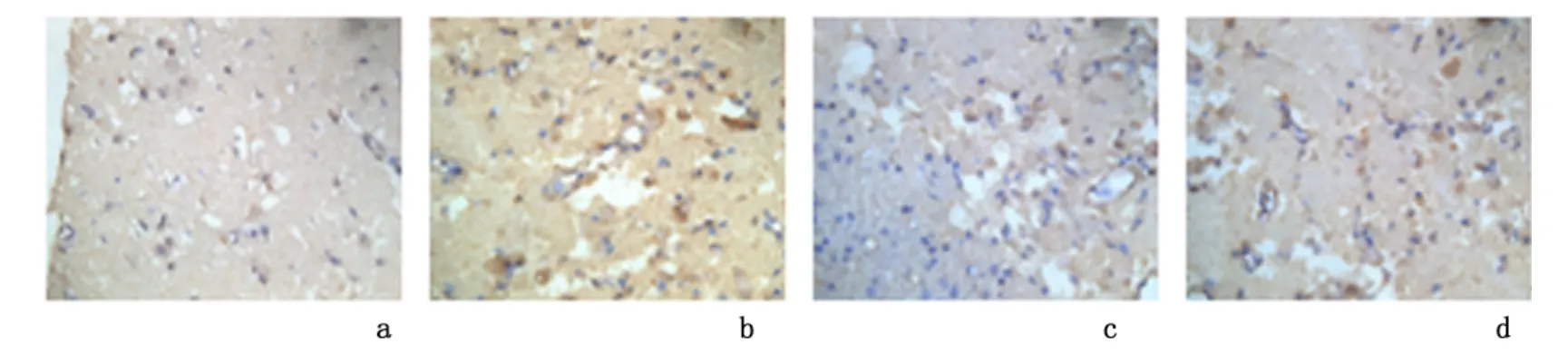
图2 第21 天大鼠脑组织CD34 表达(SABC 染色 ×400)Figure 2 Expression of CD34 in brain of rats in different groups at the 21th day(SABC staining ×400)
3 讨 论
细胞移植后的细胞存活数量与治疗效果密切相关,而移植细胞要面对的是受损器官和组织由于缺血、炎症反应和促凋亡因子等因素所形成的恶劣微环境。目前提高细胞存活的方法主要有以下3 种:①对宿主组织进行干预,从而更好地接受移植细胞。②对移植细胞进行体外预适应。③基因修饰移植细胞[10]。近几年来中医药通过对宿主的干预,研究是否影响BMSCs 在宿主体内的存活已取得一定进展。已发现黄芪皂甙Ⅳ[11]、芒果苷[12]和薯蓣皂甙[13]通过抑制凋亡基因蛋白酶活性对BMSCs 缺氧损伤诱发的凋亡具有保护作用;大黄苷元通过降低炎性因子的表达和减低血脑屏障的通透性[14],形成有利于移植细胞存活的微环境。中药复方NMYH 由制天麻、水蛭、黄芪、制天南星、半夏、川芎、益母草等7 味药组成,以黄芪益气,充盈血海为君药;制南星、半夏、天麻化痰通络为臣药;川芎、水蛭、益母草破血活血利水以通调脉道为佐使。诸药共奏调节脑中血海之功效。大样本、前瞻性、多中心、随机对照临床研究证明,该制剂治疗急性缺血中风病安全有效,可显著降低患者的病死率和致残率[6]。方中黄芪、川芎、制南星、水蛭等中药及其有效成分可抑制炎症反应[15],减少细胞凋亡[16],清除氧自由基,改善微循环[17]。因此NMYH 与BMSCs 移植联合应用,可改善移植细胞生存的微环境,促使更多的移植细胞存活下来。本研究结果显示,CM-Dil 标记的BMSCs 脑内定向移植后,随着时间的延长,荧光吸光度显著减少,BMSCs 移植联合使用NMYH 可显著增加CM-Dil荧光吸光度,提示BMSCs+NMYH 组BMCSs 存活数量较单独移植组显著增多。
促进功能性血管生成是脑缺血损伤后恢复脑血流、改善功能恢复的关键。目前已发现很多中药复方和有效成分能通过上调相关细胞因子如VEGF、bFGF 等的表达,进而促进内皮细胞的增生,新生血管形成[18-19]。本研究前期研究表明[20-21],NMYH可促进BMSCs 移植治疗大鼠缺血再灌注损伤的作用,保护神经元,促进缺血区血管生成。CD34 为相对分子质量105 000 ~120 000 的跨膜细胞表面糖蛋白,可在血管内皮细胞及其它组织中表达,具有黏附、加速血管前内皮细胞聚集形成血管以及调控造血细胞增殖和分化的功能。由于其在新生血管内皮中表达远大于非新生血管内皮[22],因此本研究采用CD34 作为脑缺血部位血管新生的效应指标。本研究结果显示,与模型组比较,BMSCs 组、NMYH 组可显著增加CD34 表达,且BMSCs 移植和NMYH 联合使用存在交互效应,表明NMYH 中药复方可促进脑缺血损伤后微血管再生,而NMYH 可提高BMSCs移植后的微血管再生作用,从而能增加移植细胞区域的血供,促进BMSCs 移植后的存活。但由于中药复方制剂NMYH 胶囊化学成分较多,可具有较多的作用靶点。研究发现,基质细胞衍生因子1 除参与趋化干细胞定向迁移途径,还可能通过增强E2F6基因,负性调控E2F1 基因抑制缺血缺氧导致的BMSCs 凋亡[23]。范慧慧等[24]根据中医“生新”等理论认为活血化瘀中药通过调控BMSCs 旁分泌可促进血管再生。因此,本研究将在调控BMSCs 旁分泌通路、基质细胞衍生因子1 基因表达等方面进一步研究NMYH 与BMSCs 移植的联合效应,阐明调节脑中血海法作用的靶点和机制,为中医药辅助干细胞技术治疗脑梗死提供新的思路和方法。
[1] Chang YC,Shyu WC,Lin SZ.Regenerative therapy for stroke[J].Cell Transplant,2007,16(2):171-181.
[2] Mangi AA,Noiseux N,Kong D,et al.Mesenchymal stem cells modified with Akt prevent remodeling and restore performance of infarcted hearts[J].Nat Med,2003,9(9):1195-1201.
[3] 冉黎婧,史明霞,洪 敏.间充质干细胞归巢机制研究进展[J].医学研究生学报,2014,27(4):423-426.
[4] 赵 芳,吴飞俊,裴 路.间充质干细胞归巢机制研究进展[J].医学研究生学报,2013,26(6):573-576.
[5] 包翠芬,包翠芳,李 磊,等.人参皂苷Rg1 联合BMSCs 对大鼠脑缺血再灌注损伤的保护作用[J].山东医药,2012,52(25):9-11.
[6] Huang Y,Pei J,Wang X,et al.outcome and safety assessment of Yin pattern of acute ischemic stroke treated with an herbal medicine protocol[J].Cerebrovasc Dis,2007,24:483-494.
[7] 陈 朝,黎 奔,郭建文.大鼠骨髓间充质干细胞的分离培养及CM-Dil 标记的脑内示踪[J].解放军医学杂志,2010,35(8):946-949.
[8] Longa EZ,Weinslein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[9] 陈 曦,王楚怀,丰岩清,等.以CM-Dil 作为骨髓干细胞移植示踪剂的可行性[J].中国组织工程研究与临床康复,2009,13(19):3611-3615.
[10] Haider HK,Ashraf M.Strategies to promote donor cell survival:combining preconditioning approach with stem cell transplantation[J].J Mol Cell Cardiol,2008,45(4):554-566.
[11] 王 莹,李文媛,贾 桦,等.黄芪皂甙Ⅳ联合骨髓间充质干细胞对脑缺血/再灌注大鼠血管生成的影响[J].解剖学研究,2011,33(5):323-326.
[12] 朱延辉,王国贤.芒果苷对大鼠骨髓间充质干细胞缺氧损伤的保护作用[J].解剖科学进展,2013,19(2):159-162.
[13] 于 勤,方唯一,邹云增,等.薯蓣皂甙对骨髓间充质干细胞凋亡保护的研究[J].中国临床医学,2008,15(6):904-905.
[14] 李建生,刘敬霞,孙 捷,等.大黄苷元对骨髓间充质干细胞移植脑缺血大鼠基质金属蛋白酶的影响[J].中西医结合学报,2008,6(8):810-816.
[15] 李克明,武继彪,隋在云,等.水蛭微粉对脑缺血再灌注损伤大鼠ICAM、VCAM、PDGF 的影响[J].中药新药与临床药理,2009,20(2):136-138.
[16] 王景霞,邓文伟,李 尧,等.黄芪对脑缺血再灌注损伤cfos 表达和细胞凋亡的影响[J].解剖学研究,2007,29(3):206-208.
[17] 蔡旭兵,潘立群.黄芪微乳载人修饰后胶原对大鼠血管生成的影响[J].医学研究生学报,2009,22(10):1016-1019.
[18] 周永红,王新陆,胡怀强.中药对大脑中动脉闭塞模型大鼠脑血管发生的作用[J].中国神经免疫学和神经病学杂志,2006,13(6):351-354.
[19] 董海燕,杨建刚,肖志强,等.4 种中药和3 个方剂促血管新生作用及有效成分的研究[J].中药材,2013,36(8):1297-1300.
[20] 潘 峰,郭建文,李俊雅,等.调节“脑中血海”法中药联合骨髓间充质干细胞移植对缺血再灌注大鼠的保护作用[J].中国中医基础医学杂志,2012,18(5):506-509.
[21] 伍小燕,陈 朝,郭建文.骨髓间充质干细胞移植联合脑脉1 号对大鼠缺血组织血管生成的影响[J].时珍国医国药,2012,23(2):485-488.
[22] Ding S,Li C,Lin S,et al.Comparative evaluation of microvessel density determined by CD34 or CD105 in benign and malignant gastric lesions[J].Hum Pathol,2006,37(7):861-866.
[23] 束 波,刘志江,范 芳.基质细胞衍生因子1 预处理抑制大鼠骨髓间充质干细胞的凋亡[J].中国组织工程研究,2012,16(32):5903-5908.
[24] 范慧慧,许二平.活血化瘀法调控骨髓间充质干细胞旁分泌促血管再生研究述评[J].中医学报,2013,28(177):258-260.
