不同生长时期牛血清对细胞培养效果的影响
2015-04-20王伟
王 伟
(甘州区畜牧兽医工作站,734000)
本实验将以上两组不同的血清对Sp2/0—Ag14细胞进行培养,通过测定细胞在培养过程中的生长曲线,得出细胞在不同时期的生长密度并以此为依据来判断不同血清培养的细胞生长效果。生长曲线包括三个时期:滞留期:此期为分种后的初期,不分裂繁殖,细胞数目不增加,甚至略减,一般需24~96小时,指数期:这是细胞繁殖的旺盛期,一般为3~5天有时也把它叫潜伏期,平台期:此时细胞已达饱和浓度,停止生长繁殖,要及时分种传代,否则将逐渐衰亡[2]。在测定细胞生长曲线的同时,取细胞达到最大浓度前的细胞数与达到这一数量所需的时间计算出细胞的倍增时间[3],这种方法相对于细胞计数法[4]来说,能有效的减少实验误差对实验结果的影响,从而使获得的数据更加客观,可靠。
1 材料
1.1 设备与仪器
100 ml螺口培养瓶,10ml刻度吸管,1ml刻度吸管,弯头吸管,二氧化碳培养箱,10ml注射器,长针头,1000ul移液器,移液尖,恒温培养箱,倒置显微镜烧杯,100ml玻璃瓶,三角瓶(带玻璃珠),镊子,眼科剪,平皿,解剖板,大头针,漏斗(带纱布),超净工作台。
1.2 试剂
RPMI1640培养液,DMEM培养液,3%谷氨酰胺,1.1%丙酮酸钠,7.5%碳酸氢钠,0.25%胰蛋白酶,0.4%乳欧液,酶稀释液,庆大霉素,75%酒精,Hanks’液。3月龄采血牛血清,14日龄采血牛血清。
2 方法及步骤
2.1 方法
2.1.1 细胞计数法
细胞计数法是用血细胞计数板计数细胞数目。首先取待测及对照的细胞悬液各0.1ml,然后滴于血细胞计数板上,于低倍镜下计数四角的4个大方格内的细胞。计数过程中,对大方格的边缘压线细胞按数上不数下、数左不数右的原则进行计数。计数时,两次反复计算误差不超过10%。细胞浓度按下列公式进行计算:
细胞浓度=4个大方格内细胞数/4×104×稀释倍数=细胞数/ml[7]
2.1.2 细胞倍增时间法
细胞倍增时间的测定:按生长曲线计算细胞的倍增时间。取细胞峰值前一天计的得数(Y),接种细胞数(X),及生长时间(T)计算。
倍增时间=T/A A=log2Y/X[6]
2.2 步骤
将3%谷氨酰胺和1.1%丙酮酸钠按1%比例加入RPMI 1640培养液中,用7.5%碳酸氢钠调培养液的PH值为7.2-7.4。取Sp2/0-Ag14种细胞一瓶,用弯头吸管反复吹打培养瓶细胞面,制成细胞悬液,分种到两个100ml培养瓶中,9ml培养液/瓶,分别加入两组牛血清(10%)1ml,放入5%二氧化碳恒温培养箱拧松瓶盖进行开放式培养,对细胞进行计数,待细胞浓度达到104/ml时将细胞接种至96孔板中,每隔24h计数一次,连续计数一周,纪录实验数据[5]。细胞的最大增值浓度不低于106/ml。将记录的实验数据汇总,绘制出细胞生长曲线,根据公式计算出细胞倍增时间。
3 结果及分析
从表1和图1可以看出,在细胞接种24-48h之内,由于细胞适应性及培养液的理化特征不稳定等因素的影响,A组血清培养的细胞浓度小于B组血清,但当培养液特性及细胞适应性达到稳定之后,A组血清培养的细胞浓度开始上升,在对数期已检血清的细胞浓度上升较快,在达到峰值前后,细胞浓度已明显高于B组血清,在细胞浓度达到峰值之后,由于细胞培养液中有毒物质的积累,及细胞之间的条件抑制[8]细胞浓度开始下降,A组血清细胞的生长曲线下降相对较慢。据图表可得:Y对=417500/mlX对=10000/mlT对=120h峰值对=1332500/ml;Y检=485000/mlX检=10000/mlT检=120h峰值检=1465000/ml;倍增时间对=T/log2Y/X=17.8h;倍增时间检=T/log2Y/X=17.1h。数据显示经过检测后的血清在培养细胞过程中的增值时间低于未经过检测的血清。
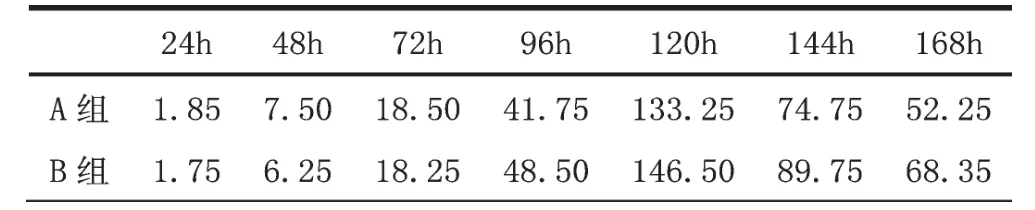
表1 24-168h细胞浓度(单位:万/ml)
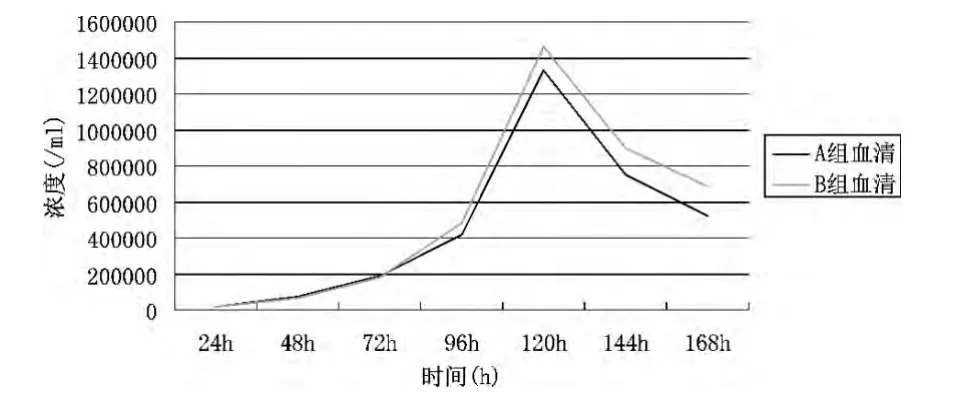
图1Sp2/0-Ag14细胞生长曲线图
4 讨论
通过以上数据可以看出:B组的细胞培养倍增时间为17.1小时,低于A组的细胞培养倍增时间17.8小时,倍增时间越短说明细胞生长的越快。
细胞计数法虽然简便,宜行,但在细胞计数过程中,需要借助于倒置显微镜进行观察,细胞在培养时,在培养液中同时存在死细胞及其它一些杂质,容易造成误差,且细胞计数要使用细胞计数器,长时间进行显微镜下的观察,容易造成视疲劳,从而导致误差。而采用细胞生长曲线测定法,虽然也要进行细胞计数,但细胞生长曲线的测定是对细胞生长趋势的测定,实验产生的误差对实验结果的影响较小,从而使结果更加客观,精确。对细胞倍增时间测定时的细胞计数,往往是用细胞生长的峰值,但实际所记得的峰值往往与理论上的不一致,且此时期细胞也不一定处于良好的生长期。我们用峰值前一天细胞生长基本处于良好的对数生长期时计得的数来计算倍增时间,其结果更近于理论上的值[10]
5 结论
以上实验结果证明:采用14日龄采血牛血清进行细胞培养优于采用3月龄血清;采用细胞倍增时间法进行细胞培养效果评价要优于细胞计数法。
[1]GibcoBRLCatalogusandReferenceGuide.1990.4:68.
[2]张卓然.培养细胞学与细胞培养技术[M].上海科学技术出版社,2004.8:41.
[3]张卓然.实用细胞培养技术[M].人民卫生出版社,1999:34.
[4]P1ye.D.,J.BiolStand.1975.3:83-87.
[5]Balokova,h&Starek.M.,J.BiolStand,1979.7:275-284.
[6]Dvorakova.M&Starek.M.,J.BiolStand,1980.8:107-113.
[7]中国生物学制品标准化委员会.中国生物制品主要原辅材料质控标准[M].化学工业出版社,2000.56-5765.
[8]姜述德.细胞生物学杂志,1985.7(2):80.
[9]章静波.组织和细胞培养技术.人民卫生出版社,2002.
[10]鄂征.组织培养技术.人民卫生出版社,1995.
