紫檀芪诱导人视网膜母细胞瘤WERI-Rb-1细胞的细胞凋亡及其机制研究
2015-04-18沈永青智利彩
张 静,沈永青,智利彩,常 亮,仇 炜
1.石家庄市第四医院产前诊断中心,河北 石家庄 050011;2.河北中医学院护理学院,河北 石家庄 050020;3.北京大学第三医院妇产科,北京 100191;4.石家庄市鹿泉区人民医院外科,河北 石家庄 050020;5.首都医科大学附属北京友谊医院泌尿外科,北京 100050
紫檀芪诱导人视网膜母细胞瘤WERI-Rb-1细胞的细胞凋亡及其机制研究
张 静1,沈永青2,智利彩1,常 亮3,仇 炜4,5
1.石家庄市第四医院产前诊断中心,河北 石家庄 050011;2.河北中医学院护理学院,河北 石家庄 050020;3.北京大学第三医院妇产科,北京 100191;4.石家庄市鹿泉区人民医院外科,河北 石家庄 050020;5.首都医科大学附属北京友谊医院泌尿外科,北京 100050
背景与目的:紫檀芪是一种天然抗氧化剂,其抗视网膜母细胞瘤的效果仍不明确。拟探讨紫檀芪对人视网膜母细胞瘤WERI-Rb-1细胞的细胞增殖、细胞凋亡及细胞自噬的作用,并初步阐明其作用机制。方法:采用细胞计数试剂盒(cell counting kit-8,CCK-8)法测定细胞的增殖活力,Annexin V/PI流式细胞术检测细胞凋亡,吖啶橙染色观察细胞内自噬囊泡的变化,蛋白[质]印迹法(Western blot)检测LC3B及P62蛋白的表达。结果:紫檀芪显著抑制WERI-Rb-1细胞的增殖活力(P<0.01),以25、50和100 μmol/L的药物浓度作用细胞24 h时,细胞增殖活力分别为(93.02±0.47)%、(55.10±2.04)%和(30.33±1.45)%;50 μmol/L紫檀芪处理细胞12、24和48 h时,细胞增殖活力分别为(88.38±3.70)%、(53.37±1.17)%和(29.60±1.05)%。紫檀芪显著诱导细胞凋亡(P<0.01),对照组、24和48 h细胞的凋亡率分别为(4.08±0.79)%、(13.44±2.12)%和(23.49±2.01)%。紫檀芪能够激活WERI-Rb-1细胞发生细胞自噬,上调LC3蛋白的表达,下调P62蛋白的表达,增加细胞内自噬囊泡的数量(P<0.01)。3-MA及Beclin1 siRNA抑制细胞自噬后能够部分逆转紫檀芪的抗肿瘤作用(P<0.01)。3-MA抑制细胞自噬后,紫檀芪处理组的细胞凋亡率为(12.97±2.09)%,3-MA+紫檀芪组为(8.35±1.11)%。siRNA敲低Beclin1后,紫檀芪处理组和siRNA+紫檀芪组的细胞凋亡率分别为(13.80±2.19)%和(9.62±0.52)%。结论:紫檀芪可以显著抑制WERI-Rb-1细胞的细胞增殖并激活细胞自噬促进细胞凋亡。
紫檀芪;视网膜母细胞瘤;细胞凋亡;细胞增殖;自噬
视网膜母细胞瘤是发病率最高的儿童眼内恶性肿瘤,发病率约为1∶18 000至1∶21 000[1]。治疗以手术和化疗为主,虽然目前的疗效已经有明显改善,患儿的生存率已有很大提高,但是视网膜母细胞瘤作为一种恶性疾病,仍旧危害着广大患儿的健康。紫檀芪是一种从植物中提取的天然化合物,其主要存在于蓝莓和葡萄中,毒性低,安全性高[2-3]。该化合物属多羟基二苯乙烯类化合物,其本身是一种天然抗氧化剂,具有显著的抗氧化、抗炎和神经保护作用[4]。在肿瘤研究方面,目前已知紫檀芪能够抗口腔癌、乳腺癌、肝癌和恶性黑素瘤等多种恶性肿瘤[5-8],具有显著的抗肿瘤活性。紫檀芪的生物学活性多样,在某些方面甚至强于其同系物白藜芦醇[9-10],所以对紫檀芪进行深入的基础研究,有助于未来紫檀芪的开发应用。本研究以人视网膜母细胞瘤WERI-Rb-1细胞作为研究对象,探讨紫檀芪对其的细胞增殖和细胞凋亡的作用,并初步阐明作用机制,从而为该化合物的临床应用提供实验依据。
1 材料和方法
1.1 实验材料
人视网膜母细胞瘤WERI-Rb-1细胞系购自中国医学科学院基础医学研究所基础医学细胞中心,紫檀芪(规格:10 mg,纯度≥97%)、吖啶橙(acridine orange,AO)及LC3B抗体购自美国Sigma-Aldrich公司,RPMI-1640培养基及胎牛血清购自美国Hyclone公司,细胞计数试剂盒(cell counting kit-8,CCK-8)购自南京凯基生物科技发展有限公司,P62及GAPDH抗体购自美国Cell Signaling Technology公司,Annexin V/PI凋亡检测试剂盒购自美国BD公司,3-MA及人Beclin1 siRNA购自美国Santa Cruz公司,LipofectamineTM2000购自美国Invitrogen公司。
1.2 方法
1.2.1 细胞培养及转染
培养基使用体积分数为10%的胎牛血清、体积分数为1%的青链霉素双抗的RPMI-1640培养基,在37 ℃、CO2体积分数为5%的饱和湿度的细胞培养箱中对WERI-Rb-1细胞进行培养。细胞转染时使用无血清无抗生素的培养基,按照LipofectamineTM2000使用说明制备脂质体-siRNA转染复合物,滴加入细胞后6 h换成完全培养基继续培养。
1.2.2 CCK-8细胞增殖试验
取对数生长期的WERI-Rb-1细胞,传代至96孔细胞培养板内,每孔约10 000个细胞,过夜后给予相应药物处理,给药时间足够后,更换培养基(100 μL/孔),每孔加入10 μL CCK-8试剂,37 ℃继续温育2 h,酶标仪比色,比色波长为450 nm。
1.2.3 Annexin V/PI凋亡试验
细胞常规消化,100×g离心5 min,PBS洗涤细胞2次后,缓慢加入500 μL结合缓冲液,轻柔振荡重悬细胞,加入Annexin V和PI各5 μL于细胞悬液内,混匀后室温避光染色15 min,使用流式细胞仪检测。
1.2.4 蛋白[质]印迹法(Western blot)检测
收集细胞,采用细胞裂解液冰上操作裂解细胞,BCA法蛋白定量,与上样缓冲液混匀后加热变性,取等量蛋白进行SDS-PAGE电泳分离,300 mA恒流转膜1 h,5%脱脂奶粉封闭后,一抗过夜,次日洗膜后,二抗37 ℃温育1 h,ECL化学发光。本研究所用一抗浓度均为1∶1 000。
1.2.5 AO染色试验
将AO(1 μg/mL)缓慢滴加入待测细胞,避光室温染色5 min,吸出AO,PBS缓冲液小心洗涤两遍,在倒置荧光显微镜下观察并拍照存档。随机计数,每组最少计数300个细胞。
1.3 统计学处理
2 结 果
2.1 紫檀芪对人视网膜母细胞瘤WERI-Rb-1细胞的细胞增殖和细胞凋亡的影响
为了检测紫檀芪是否有抗人视网膜母细胞瘤的作用,本研究使用了CCK-8细胞增殖实验,DMSO组细胞增殖活力较对照组未见明显变化,差异无统计学意义(P=0.337),紫檀芪给药组细胞随着给药浓度的不同,细胞增殖活力均出现了不同程度的下降,药物浓度在25、50及100 μmol/L时,细胞增殖活力分别为(93.02±0.47)%、(55.10±2.04)%和(30.33±1.45)%,细胞增殖活力下降具有量效关系,差异有统计学意义(P<0.01,图1A)。使用50 μmol/L紫檀芪处理WERI-Rb-1细胞,分别在12、24和48 h时对细胞增殖活力进行检测,紫檀芪的增殖活力分别为(88.38±3.70)%、(53.37±1.17)%和(29.60±1.05)%,较对照组明显下降,其变化具有时效关系,差异有统计学意义(P<0.01,图1B)。进一步使用Annexin V/PI流式细胞仪对紫檀芪的细胞凋亡诱导作用进行检测,结果表明,紫檀芪对WERI-Rb-1细胞具有明显的细胞凋亡诱导作用,药物作用24和48 h时,细胞凋亡率分别由对照组的(4.08±0.79)%上升至(13.44±2.12)%和(23.49±2.01)%,差异有统计学意义(P<0.01,图1C)。上述结果表明,紫檀芪具有显著的抗人视网膜母细胞瘤WERIRb-1细胞的细胞增殖、诱导细胞凋亡的作用。
2.2 紫檀芪对于WERI-Rb-1细胞的细胞自噬的影响
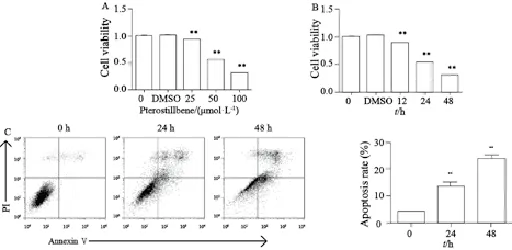
图 1 紫檀芪对WERI-Rb-1细胞增殖及细胞凋亡的影响Fig. 1 Pterostilbene inhibits proliferation of WERI-Rb-1 cells and induces cell apoptosis
LC3是检测细胞自噬的标志蛋白之一,LC3前体在合成、加工修饰之后成为LC3-Ⅰ型蛋白,当细胞自噬激活时,LC3-Ⅰ型蛋白酯化成LC3-Ⅱ型蛋白并定位于自噬囊泡上。使用Western blot对细胞进行检测结果表明,在给予了紫檀芪(50 μmol/L)作用12及24 h之后,细胞的LC3-Ⅱ型蛋白的含量明显上升(图2A)。P62蛋白是细胞自噬的关键蛋白之一,其本身是细胞自噬的特异性底物,通过细胞自噬进行降解。P62蛋白的检测结果表明,紫檀芪(50 μmol/L)作用WERI-Rb-1细胞12和24 h后,细胞的P62蛋白的含量明显下降(图2A)。我们又进一步使用AO对细胞染色观察,结果表明,在紫檀芪(50 μmol/L,12 h)处理细胞后,细胞内自噬囊泡的数量明显上升,差异有统计学意义(P<0.01,图2B、C)。上述结果说明,紫檀芪能够明显激活WERI-Rb-1细胞的细胞自噬活动。
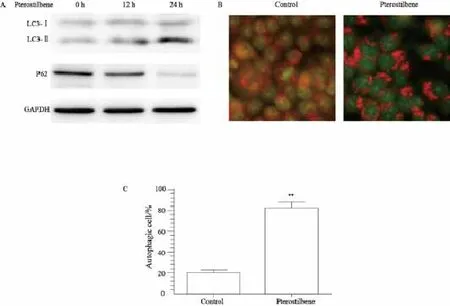
图 2 紫檀芪诱导WERI-Rb-1细胞发生细胞自噬Fig. 2 Pterostilbene induces autophagy in WERI-Rb-1 cells
2.3 紫檀芪诱导的细胞自噬与细胞凋亡之间的关系
3-MA是细胞自噬的抑制剂。本研究使用该抑制剂抑制了WERI-Rb-1细胞的细胞自噬活动后进行细胞凋亡检测,紫檀芪处理组的细胞凋亡率为(12.97±2.09)%,而3-MA+紫檀芪组的细胞凋亡率为(8.35±1.11)%,3-MA能够显著逆转紫檀芪对肿瘤细胞的细胞凋亡作用(P<0.01,图3A)。Beclin1是细胞自噬发生的关键蛋白之一,我们又进一步使用了siRNA敲低Beclin1后进行检测,紫檀芪处理组和siRNA+紫檀芪组的凋亡率分别为(13.80±2.19)%和(9.62±0.52)%,干扰自噬能够显著影响紫檀芪的抗肿瘤作用(P<0.01,图3B)。上述结果说明,紫檀芪的细胞凋亡诱导效应部分依赖于激活细胞自噬发挥作用。
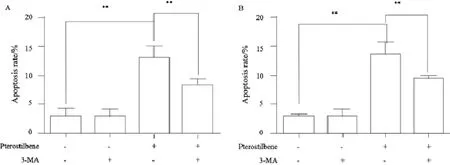
图 3 紫檀芪(50 mmol/L, 24 h)通过诱导细胞自噬促进细胞凋亡Fig. 3 Pterostilbene (50 mmol/L, 24 h) induces cell apoptosis via autophagy induction
3 讨 论
视网膜母细胞瘤是最常见的儿童恶性肿瘤之一,未经治疗的儿童通常会在1~2年内死亡[11]。目前视网膜母细胞瘤的治疗原则是在保障患者生存的前提下尽最大可能保留患眼及患者残存的视功能。治疗手段主要为手术、化疗和放疗。随着治疗技术的提高,近年来完全通过眼球摘除手术治疗的方法已经较少采用。化疗和放疗是最常用的保守治疗方法,但是化疗存在导致肿瘤耐药、化疗不敏感的问题,放疗在视网膜母细胞瘤的应用中也存在着导致严重并发症的可能性,所以找到更好的保守治疗方法是临床面临的巨大挑战。
紫檀芪是安全性很高的天然化合物,其结构类似物白藜芦醇在肿瘤方面的研究已经很多,而关于紫檀芪的研究相对较少。目前已知紫檀芪的抗肿瘤作用多样,是一种多靶点的抗肿瘤化合物。Pan等[6]的研究显示,紫檀芪能够靶向抑制雌激素受体α36从而诱导雌激素受体阳性的乳腺癌细胞死亡。Suganya等[7]的研究显示,紫檀芪能够使肝癌细胞的细胞周期阻滞于G2/M期,诱导肝癌细胞的细胞凋亡。Schneider等[8]在恶性黑素瘤中也发现紫檀芪能够抑制肿瘤细胞的细胞增殖,激活Caspase系统从而诱导细胞凋亡。本研究检测了紫檀芪对视网膜母细胞瘤的作用,并发现了相同的作用效果,紫檀芪处理WERI-Rb-1细胞后,细胞增殖活性明显下降,细胞凋亡率明显上升。细胞自噬是细胞正常的生理活动之一,在维持细胞内环境稳态和能量代谢方面具有重要作用。细胞自噬在肿瘤中的具体作用目前还不是十分清楚。已有研究显示,白藜芦醇能够激活乳腺癌细胞自噬[12],推测紫檀芪可能也具有类似的功能,实验结果也表明,在给予了紫檀芪后,WERIRb-1细胞的LC3-Ⅱ型蛋白明显上升,P62蛋白显著下降,进一步进行形态学观察也发现紫檀芪处理后的细胞的细胞质内自噬囊泡数量较对照组明显增加。上述结果证实紫檀芪能够激活WERI-Rb-1细胞的细胞自噬。细胞自噬与细胞凋亡的关系目前还不是很清楚,有研究表明细胞自噬显著激活或抑制时均能够触发细胞发生细胞凋亡[13]。本研究发现紫檀芪的细胞凋亡诱导效应与细胞自噬相关,在抑制了细胞自噬后,细胞凋亡率也明显下降,紫檀芪的抗肿瘤作用被部分逆转。
本研究从体外水平对紫檀芪的抗人视网膜母细胞瘤的效果进行了验证,并初步阐明其抗肿瘤作用与细胞自噬激活有关,拓宽了紫檀芪的抗肿瘤谱,丰富了紫檀芪的抗肿瘤作用机制,为其未来的临床应用提供了科学依据。
[参 考 文 献]
[1] 赵堪兴, 杨培增, 主编. 眼科学 [M]. 8版, 北京: 人民卫生出版社, 2013: 228.
[2] ROUPE K A, REMSBERG C M, YANEZ J A, et al. Pharmacometrics of stilbenes: seguing towards the clinic[J]. Curr Clin Pharmacol, 2006, 1(1): 81-101.
[3] RIMANDO A M, KALT W, MAGEE J B, et al. Resveratrol,pterostilbene, and piceatannol in vaccinium berries [J]. J Agric Food Chem, 2004, 52(15): 4713-4719.
[4] BRISDELLI F, D’ANDREA Q, BOZZI A. Resveratrol: a natural polyphenol with multiple chemopreventive properties[J]. Curr Drug Metab, 2009, 10(6): 530-546.
[5] LIN C W, CHOU Y E, CHIOU H L, et al. Pterostilbene suppresses oral cancer cell invasion by inhibiting MMP-2 expression [J]. Expert Opin Ther Targets, 2014, 18(10): 1109-1120.
[6] PAN C, HU Y, LI J, et al. Estrogen receptor-α36 is involved in pterostilbene-induced apoptosis and anti-proliferation in in vitro and in vitro breast cancer [J]. PLoS One, 2014,9(8):e104459.
[7] SUGANYA N, BHAKKIYALAKSHMI E, SUBIN T S, et al. Proteomic identification of pterostilbene-mediated anticancer activities in HepG2 cells [J]. Chem Res Toxicol, 2014, 27(7): 1243-1252.
[8] SCHNEIDER J G, ALOSI J A, MCDONALD D E. Effects of pterostilbene on melanoma alone and in synergy with inositol hexaphosphate [J]. Am J Surg, 2009, 198(5): 679-684.
[9] LANGCAKE P, PRYCE R J. A new class of phytoalexins from grapevines [J]. Experientia, 1977, 33(2): 151-152.
[10] LIN H S, YUE B D, HO P C. Determination of pterostilbene in rat plasma by a simple HPLC-UV method and its application in pre-clinical pharmacokinetic study [J]. Biomed Chromatogr, 2009, 23(12): 1308-1315.
[11] SHIELDS C L, FULCO E M, ARIAS J D, et al. Retinoblastoma frontiers with intravenous, intra-arterial, periocular, and intravitreal chemotherapy [J]. Eye (Lond), 2013, 27(2): 253-264.
[12] FU Y, CHANG H, PENG X, et al. Resveratrol inhibits breast cancer stem-like cells and induces autophagy via suppressing Wnt/β-catenin signaling pathway [J]. PLoS One, 2014,28; 9(7): e102535.
[13] LALAOUI N, LINDQVIST L M, SANDOW J J, et al. The molecular relationships between apoptosis, autophagy and necroptosis [J]. Semin Cell Dev Biol, 2015, 39: 63-69.
Pterostilbene induces retinoblastoma WERI-Rb-1 cell apoptosis via autophagy induction
ZHANG Jing1, SHEN Yongqing2, ZHI Licai1, CHANG Liang3, QIU Wei4,5(1.Prenatal Diagnosis Center, Fourth Hospital of Shijiazhuang, Shijiazhuang 050011, Hebei, China; 2.College of Nursing, Hebei University of Chinese Medicine, Shijiazhuang 050200, Hebei, China; 3.Department of Gynaecology and Obstetrics,Peking University Third Hospital, Beijing 100191, China; 4.Department of Surgery, the People’s Hospital of Luquan District, Shijiazhuang 050200, Hebei, China; 5.Department of Urology, Beijing Friendship Hospital, Beijing 100050, China)
QIU Wei E-mail: qiuwei618@163.com
Background and purpose: Pterostilbene is a natural antioxidant, whose role in retinoblastoma remains unclear. The aim of this study is to probe the effects of pterostilbene on the proliferation, apoptosis and autophagy in retinoblastoma WERI-Rb-1 cell lines. Methods: Cell counting kit-8 (CCK-8) assays were used toanalyze the effects of pterostilbene on the proliferation of WERI-Rb-1 cells. Apoptosis rate was determined by Annexin V/PI. Autophagic vacuoles were observed by acridine orange staining. LC3 and P62 protein expressions were determined using Western blot. Results: Pterostilbene significantly inhibited the proliferation of WERI-Rb-1 cells (P<0.01). The cell viability were (93.02±0.47)%, (55.10±2.04)% and (30.33±1.45)% after WERI-Rb-1 cells were treated with 25, 50 and 100 μmol/L pterostilbene for 24 h, and the cell viability were (88.38±3.70)%, (53.37±1.17)%,(29.60±1.05)% after WERI-Rb-1 cells were treated with 50 μmol/L pterostilbene for 12, 24 and 48 h. Pterostilbene induced cell apoptosis (P<0.01), the apoptosis rates of control group, 24 h treated group and 48 h treated group were(4.08±0.79)%, (13.44±2.12)% and (23.49±2.01)%. Pterostilbene induced autophagy of WERI-Rb-1 cells, increased LC3 expression, downregulated P62 expression and increased the number of autophagic vacuoles in WERI-Rb-1 cells(P<0.01). 3-MA and Beclin1 were able to rescue pterostilbene-induced cell death (P<0.01). After 3-MA was used to blunt autophagosome formation, the apoptosis rate markedly decreased in 3-MA+pterostilbene-treated cells compared with cells treated with pterostilbene alone [(12.97±2.09)% vs (8.35±1.11)%], and after siRNA was used to knockdown Beclin1, the apoptosis rate had the same change [(13.80±2.19)% vs (9.62±0.52)%]. Conclusion: Pterostilbene can inhibit the proliferation of WERI-Rb-1 cells and induce cell apoptosis via autophagy activation.
Pterostilbene; Retinoblastoma; Cell apoptosis; Cell proliferation; Cell autophagy
10.3969/j.issn.1007-3969.2015.11.010
R739.7+2
A
1007-3639(2015)11-0900-06
2015-05-15
2015-07-27)
河北省医学科学研究重点课题(ZD20140032)。
仇炜 E-mail:qiuwei618@163.com
