不同基因型玉米耐铝特性比较
2015-04-17邵继锋车景董晓英等
邵继锋 车景 董晓英 +等
摘要:以相对根伸长率为指标,对26个玉米基因型进行耐铝特性筛选。结果表明:26个供试基因型中,农大4967相对根伸长率最大,郑单2201相对根伸长率最小。比较了铝处理下农大4967、郑单2201根尖铝和胼胝质含量,发现农大4967根尖铝和胼胝质含量显著小于郑单2201。苏木精染色及桑色素荧光染色观察表明,农大4967根表和横切面铝的分布都低于郑单2201,且铝主要积累在根表。以上结果表明,农大4967为铝耐受型基因型,郑单2201是铝敏感型基因型,玉米耐铝机制以外排机制为主。
关键词:玉米;铝毒害;铝敏感型;铝耐受型
中图分类号: S513.034文献标志码: A文章编号:1002-1302(2015)01-0061-04
收稿日期:2014-03-29
基金项目:国家自然科学基金(编号:41025005)。
作者简介:邵继锋(1983—),男,浙江建德人,博士研究生,从事植物铝毒害和耐铝机制研究。E-mail:brianshao888@gmail.com。
通信作者:沈仁芳,研究员,从事植物营养和逆境生理研究。E-mail:rfshen@issas.ac.cn。全世界酸性土壤有39.5亿hm2,其中可耕种面积为1.8亿hm2,主要分布在热带、亚热带及温带地区[1]。我国酸性土壤遍及南方15个省区,总面积为 2 030万hm2[2]。酸性土壤往往同时存在多种限制作物生长的因子,如铝毒害、锰毒害、磷缺乏等[3],其中铝毒是酸性土壤对作物生长和产量的主要限制因子之一,世界粮食作物产量特别是谷类作物产量,严重受到铝毒影响。因此,铝对植物的毒害和植物的耐铝机制受到国内外学者关注,对酸性土壤中铝毒害的调控措施主要有施用石灰、有机肥、绿肥等土壤改良措施以及选育耐铝性强的基因型品种[4]。其中从基因工程角度筛选和培育耐铝品种已经成为研究热点。
玉米(Zea mays L.)是世界第三大粮食作物,玉米不适宜在酸性土壤上种植,主要原因就是铝毒害。不同基因型玉米的耐铝毒特性存在明显差异,筛选、培育出耐铝毒的玉米品种,可以扩大玉米种植带,解决南方地区酸性土壤发展玉米生产的限制问题,对提高粮食产量具有重大意义[5]。刁锐琦等对26个基因型玉米苗期株高、吸氮量、氮素转化率等进行比较,筛选出耐低氮的种质材料3个[6]。许玉凤等通过对7个玉米品种研究指出,可以通过比较生物量来筛选耐铝材料[5]。有多种方法可用于评价植物的耐铝性,包括量取根的伸长、测定根尖铝含量以及评价生物量等[7-9]。由于铝对植物毒害作用的最明显特征就是抑制根伸长,因此其常被用来衡量植物受到铝毒害程度的参数[10-11]。本研究通过比较26个推广范围较大的玉米基因型在铝胁迫下的相对根伸长率,筛选出铝的不同耐受型,并比较获得的玉米基因型的耐铝特性,探索其耐铝特性,旨在为揭示玉米耐铝机制提供研究材料,并为耐铝品种选育提供理想的种质资源。
1材料与方法
1.1供试材料
供试玉米品种为推广种植面积较大的农大4967、农大86、豫玉32等26个玉米品种(表1)。
表1供试玉米基因型编号及名称
编号名称编号名称编号名称编号名称1纪元一号8中金36815华珍229982郑单9589浙糯玉5号16俊达00123喜玉123光玉33510东糯4号17郑单220124郑农72784京单6811科甜2号18费玉三号25秦龙145京单2812科糯98619偃单8号26豫玉326农大496713郑单2220浚单227农大8614花甜糯07221栗玉2号
1.2试验方法
选择饱满一致的玉米种子,用5%次氯酸钠消毒30 min,经蒸馏水冲洗3次后,25 ℃下用蒸馏水浸泡2 h,然后将种子置于湿润滤纸上25 ℃避光催芽2 d,移至漂浮在0.5 mmol/L CaCl2溶液 (pH值4.5)中的浮板上培养1 d。选取长势一致的幼苗,用含0、25 μmol/L AlCl3的0.5 mmol/L CaCl2溶液(pH值4.5)处理1 d。处理前后用直尺量取根长,计算相对根伸长率,重复10次。相对根伸长率(RRE)计算方法如下:
RRE=(RLAl,t-RLAl0)/(RLC,t-RLC0)×100% 。
式中:RLAl,t为铝处理t时间后的根长;RLAl0为铝处理前的根长;RLC,t为对照处理t时间后的根长;RLC0为对照处理前根长。
1.3测定项目与方法
1.3.1根尖铝含量测定根尖总铝含量测定方法参照文献[12]。切取铝处理1 d后的玉米根尖(0~1 cm)10条,用 0.5 mmol/L CaCl2溶液冲洗3次后,放入装有1 mL 2 mol/L HCl的离心管中,间断摇动。放置1 d后用ICP-AES(IRIS-Advantage,Thermo Element)分析仪测定,每个处理重复3次。
1.3.2胼胝质含量测定胼胝质含量测定方法参照文献[13]。切取铝处理后的玉米根尖(0~1 cm)10条,放入95%乙醇溶液中4 ℃保存过夜后,用1 mol/L NaOH溶液 1 mL研磨提取并转移至1.5 mL Eppendorf管中,80 ℃水浴20 min,冷却至室温,12 500 r/min离心10 min,吸取上清液400 μL于10 mL离心管中,并加入2.5 mL苯胺蓝混合液,另吸取 400 μL 上清液于10 mL离心管加入2.5 mL苯胺蓝空白混合液,混匀后于50 ℃水浴20 min,室温冷却,于激发光波长 400 nm 和发射光波长485 nm条件下用荧光分光光度法测定荧光值。标准曲线配制如下:以20 μg/mL Pachyman(PE)作为标准溶液,测定前同样品一起80 ℃水浴20 min后,冷却至室温,分别吸取0、50、100、150、200、250、300、350、400 μL各2个平行于10 mL离心管,补充1 mol/L NaOH至500 μL,于1组标准曲线中加入2.5 mL苯胺蓝混合液,另1组标准曲线加入2.5 mL苯胺蓝空白混合液,其他后续工作同样品,测定其荧光值。计算样品胼胝质含量时,用所测苯胺蓝浓度减去空白液所测浓度即为样品胼胝质浓度,根据体积换算至每条根的含量,单位为 PE μg/根。
1.3.3苏木精染色苏木精染色法作为组织化学的指示物,常被用来观察根尖铝分布情况[14]。配制0.2%苏木精加002% KIO3溶液,然后加入1滴0.1 mol/L NaOH。幼苗经铝处理后,用蒸馏水冲洗,室温下将植物根系放入装有苏木精溶液的培养皿中浸泡40 min,中间间断摇动溶液,以便染色均匀。然后用蒸馏水冲洗浸泡,去掉过量的苏木精,每次浸泡10 min,冲洗2~3次。在体视显微镜(Olympus-SZX7)下观察。所得图像用DT2000通用图像分析软件进行分析处理。
1.3.4桑色素荧光染色选取桑色素(Morin)为荧光物质,进行桑色素荧光染色[15]。切取铝处理后的幼苗根尖(2 cm左右),徒手切片,在根尖2 mm处横切,将切得的横切面放入配制好的桑色素溶液中染色15~30 min。取出后用蒸馏水冲洗3遍。在激光共聚焦上观察(激发波长420 nm,发射波长510 nm,Axivoert 40 CFL,Carl Zeiss,Germany)。用AxioVision-Ac图像软件处理图像。桑色素溶液母液配制:称取2 mg桑色素溶于 2 mL 二甲亚枫(DMSO),加水稀释至10 mL。
2结果与分析
2.1相对根伸长率比较
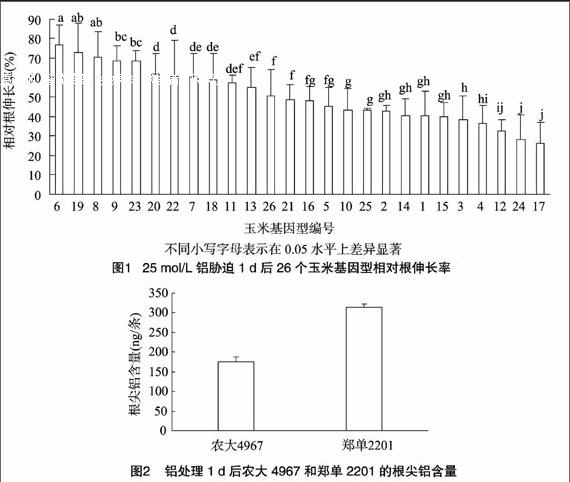
植物铝毒害最容易识别的形态症状就是根生长受到抑制,铝毒抑制根的生长可以在1 h甚至更短时间内测量出来[16]。肉眼可见的铝毒害症状包括根伸长生长的抑制、根尖膨大、表皮脱落等[17]。因此通过比较根在铝胁迫下的伸长量是筛选不同耐铝性植物品种的重要指标。由图1可见,在 25 μmol/L 铝胁迫下,不同玉米基因型相对根伸长率有很大差异,农大4967根伸长受抑制程度最轻,其次是偃单8号,郑单2201根伸长受抑制最重,其相对根伸长率不到农大4967的50%。通过比较相对根伸长率,农大4967、郑单2201分别被选为耐铝基因型和铝敏感基因型进行下一步试验。
2.22个玉米基因型耐铝特性比较
2.2.1根尖铝含量比较根尖是对铝最敏感的区域,是铝毒害的首要发生位点[18]。因此根尖铝含量可被用于直观比较2种材料对铝的累积差异。由图2可知,在25 mol/L铝处理下,郑单2201根尖积累了大量的铝,显著高于农大4967,t检验结果发现,F=1.697,P<0.05,说明2种材料在铝累积方面存在较大差异,且在耐铝机制上可能以排斥机制为主。
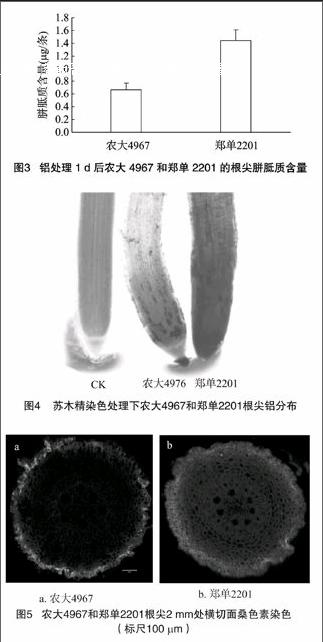
2.2.2胼胝质含量作为铝毒害的重要生理指标之一,铝胁迫诱导生成胼胝质可以在根系生长受抑制前被检测出来,同时胼胝质的生成可以用作铝敏感基因型差异的指标[19-20]。由图3可见,在25 μmol/L铝胁迫下,郑单2201根尖胼胝质含量显著大于农大4967,t检验结果发现,F=1.043,P<005,说明郑单2201对铝的毒害更加敏感。
2.2.3苏木精染色苏木精易与根系结合的铝形成蓝紫色复合物,染色程度越深,代表根尖铝积累量也越多, 苏木精染
色法因此被广泛应用于观察根系铝的累积情况[21-22]。由图4可见,经25 μmol/L铝处理后,在体视显微镜下观察的根尖影像中,农大4967根表颜色较浅,而郑单2201根表整体颜色很深,整个根表都被染色。说明有更多的铝结合在郑单2201根表,而农大4967则相对少很多。因此, 铝处理后积累在郑
单2201根尖表面的铝远多于农大4967根尖表面积累的铝,这和实际测出根尖的铝含量一致。
2.2.4桑色素荧光染色苏木精染色旨在观察铝在玉米根系表面的积累情况,而不能有效观察进入根内部的铝。桑色素荧光染色法对观察铝在植物内部微观分布独具功效,许多研究采用荧光染色法研究铝的微观分布状况[23-24.]。从图5-b可见,郑单2201根尖2 mm处横切面从外层细胞到内层中柱荧光强度逐渐减弱,说明根的皮层、内皮层甚至中柱也有一定量铝进入,离根表越远进入的铝越少。而农大4967则不同,荧光强度在外表层最强,然后逐渐减弱,虽然在切面内部可以看到零星荧光,但强度很弱(图5-a)。说明农大4967根尖积累的铝主要分布在根的表层,只有极少部分铝进入了根内部,进一步验证了玉米耐铝的排斥机制。
3结论与讨论
通过比较铝处理1 d玉米根的相对伸长率,初步区分不同基因型玉米对铝的耐受能力,从26个基因型中筛选出1个铝耐受基因型和1个铝敏感基因型。并通过测定根尖铝和胼胝质的含量,定量铝对根尖的伤害程度;通过苏木精染色和荧光染色定性观察根尖表面和根横切面铝的分布,由此确定所筛选玉米基因型的耐铝特性及可能的耐铝策略为外排机制。
许玉凤等比较了京八、沈137、齐139等7个玉米品种在铝胁迫下的主根长、生物量,筛选出1个耐铝基因型和2个敏感基因型[5]。李德华等比较了9个基因型玉米根相对伸长率、苏木精染色指数、根系TTC相对还原强度,得出以上指标与植株的耐铝性显著相关[25]。根尖铝含量和胼胝质含量都可以在一定程度上反映植物或品种间的耐铝性差异[26]。本研究表明,无论是根尖铝含量还是胼胝质含量,农大4967都显著低于郑单2201,进一步表明2个品种在耐铝性方面的显著差异。
根据解毒位点的不同,可将植物的耐铝机理分为外部排斥机制和内部忍耐机制。其中植物耐铝的外部排斥机制是指植物根系吸收铝的过程中能够通过一定的策略把铝阻留在根表、根尖或根质外体,或吸收铝后再将其排出,使之不能与共质体中的代谢位点结合,达到耐铝毒害的目的[3]。本研究表明,吸附在郑单2201表面的铝远多于吸附在农大4967根表的铝;铝可透过郑单2201根的表层细胞到达中柱,而农大4967则相对较少;同时铝主要集中在农大4967的根表细胞,说明2种材料在对铝的排斥方面存在很大差异。自Miyasaka等[27]首次证明根系分泌有机酸是植物耐铝的重要机理以来,越来越多的证据表明有机酸在植物解铝毒的内部和外部机制中有重要作用[27-29]。有机酸能够与铝形成稳定无毒的螯合物,从而降低铝的生物毒性,阻止铝在细胞内的固定,达到解毒目的[30-31]。铝胁迫下,耐铝型玉米根尖分泌大量柠檬酸和草酸,而敏感型玉米则很少分泌甚至不分泌有机酸。Pellet等[32]、Jorge等[33]认为柠檬酸等有机酸和铝螯合,阻止铝进入根内部是耐受型玉米较耐铝毒害的原因。本研究中农大4967根表苏木精染色很浅,桑色素染色的荧光强度主要集中在根横切面的外圈,说明农大4967有阻止铝进入根的能力。这可能和根尖分泌有机酸(柠檬酸、苹果酸)有关。
改良品种、挖掘耐铝基因潜力一直是科研工作方向之一。玉米品种自交系和杂交种的耐铝性均存在广泛的遗传变异,具有耐铝性遗传改良的基因潜力[34]。在小麦、大麦、水稻、燕麦、高粱等作物中已发现了大量耐铝基因[35-40],而在玉米中至少发现5个基因组区域和玉米耐铝毒害有重要关系[41]。如何利用好基因的潜力以及如何培育适宜我国酸性土壤种植的玉米品种,是未来科研人员努力的方向。
参考文献:
[1]Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1995,46:237-260.
[2]熊毅,李庆逵. 中国土壤[M]. 北京:科学出版,1987.
[3]Kochian L V,Hoekenga O A,Pineros M A. How do crop plants tole-rate acid soils? Mechanisms of aluminum tolerance and phosphorous efficiency[J]. Annual Review of Plant Biology,2004,55:459-493.
[4]郑爱珍,李春喜. 酸性红壤铝毒对植物的影响及其改良[J]. 湖北农业科学,2004(6):41-43.
[5]许玉凤,曹敏建,王文元,等. 玉米耐铝毒的基因型筛选[J]. 玉米科学,2004,12(1):33-35.
[6]刁锐琦,钱晓刚. 利用水培筛选玉米氮高效种质资源的研究[J]. 种子,2008,27(4):28-30.
[7]Samac D A,Tesfaye M. Plant improvement for tolerance to aluminum in acid soils-a review[J]. Plant Cell Tissue and Organ Culture,2003,75(3):189-207.
[8]林咸永,章永松,罗安程.不同小麦基因型耐铝性的差异及筛选方法的研究[J]. 植物营养与肥料学报,2001,7(1):64-70.
[9]万延慧,年海,严小龙. 大豆种质耐低磷与耐铝毒部分指标及其相互关系的研究[J]. 植物营养与肥料学报,2001,7(2):199-204.
[10]Blancaflor E B,Jones D L,Gilroy S. Alterations in the cytoskeleton accompany aluminum-induced growth inhibition and morphological changes in primary roots of maize[J]. Plant Physiology,1998,118(1):159-172.
[11]Kochian L V,Pineros M A,Hoekenga O A. The physiology,genetics and molecular biology of plant aluminum resistance and toxicity[J]. Plant and Soil,2005,274(1/2):175-195.
[12]Osawa H,Matsumoto H. Possible involvement of protein phosphorylation in aluminum-responsive malate efflux from wheat root apex[J]. Plant Physiology,2001,126(1):411-420.
[13]Kohle H,JeblickW,Poten F,et al. Chitosan-elicited callose synthesis in soybean cells as a Ca2+-dependent process[J]. Plant Physiology,1985,77(3):544-551.
[14]Rincon M,Gonzales R A. Aluminum partitioning in intact roots of aluminum tolerant and aluminum sensitive wheat (Triticum aestivum L.) cultiars[J]. Plant Physiology,1992,99:1021-1028.
[15]Ticek R,Parker D R,Demason D A. Operationally defined apoplastic and symplastic aluminum fractions in root tips of aluminum-intoxicated wheat[J]. Plant Physiology,1992,100:309-318.
[16]Llugany M,Poschenrieder C,Barcelo J. Monitoring of aluminum-induced inhibition of root elongation in four maize cultivars differing in tolerance to aluminum and proton toxicity[J]. Physiologia Plantarum,1995,93(2):265-271.
[17]Delhaize E,Ryan P R. Aluminum toxicity and tolerance in plants[J]. Plant Physiology,1995,7:315-321.
[18]Ryan P R,Ditomaso J M,Kochian L. Aluminum toxicity in roots:an investigation of spatial sensitivity and the role of the root cap[J]. Journal of Experimental Botany,1993,44(259):437-446.
[19]Wissemeier A H,Horst W J. Effect of Calcium supply on aluminum-induced callose formation,its distribution and persistence in roots of soybean (Glycine-Max (L) Merr)[J]. Journal of Plant Physiology,1995,145(4):470-476.
[20]Zhang G,Hoddinott J,Taylor G J. Characterization of 1,3-β-D-glucan(callose)synthesis in roots of Triticum aestivum in response to Aluminum toxicity[J]. Plant Physiology,1994,144:229-234.
[21]Rincon M,Gonzalesr A. Aluminum partitioning in intact roots of aluminum tolerant and aluminum sensitive wheat(Triticum aestivum L.)cultivars[J]. Plant Physiology,1992,99:1021-1028.
[22]Giaveno C D,Miranda J B. Rapid screening for aluminum tolerance in maize(Zea mays L.)[J]. Genetics and Molecular Biology,2000,23:847-850.
[23]Wagatsuma T. Characterization of absorption sites for aluminum in the roots[J]. Soil Science and Plant Nutrition,1983,29(4):499-515.
[24]Zheng S J,Yang J L,He Y F,et al. Immobilization of aluminum with phosphorus in roots is associated with high aluminum resistance in buckwheat[J]. Plant Physiology,2005,138(1):297-303.
[25]李德华,贺立源,李建生,等. 不同基因型玉米根系对铝胁迫反应的差异研究[J]. 华中农业大学学报,2003,22(4):365-369.
[26]孙清斌,沈仁芳,赵学强. 不同参数评价植物耐铝性的研究[J]. 植物营养与肥料学报,2008,14(5):1017-1022.
[27]Miyasaka S,Bute J,Howell R,et al. Mechanisms of aluminum tolerance in snapbeans. root exudation of citric acid[J]. Plant Physiology,1991,96:737-743.
[28]Delhaize E,Ryan P R,Randall P J. Aluminum tolerance in wheat(Triticum aestivum L.):Ⅱ.Aluminum-stimulated excretion of malic acid from root apices[J]. Plant Physiology,1993,103:695-702.
[29]Zheng S J,Ma J F,Matsumoto H. High aluminum resistance in buckwheat:Al-induced specific secretion of oxalic acid from root tips[J]. Plant Physiology,1998,117:745-751.
[30]Pellet D M,Papernik L,Kochian L. Multiple aluminum-resistance mechanisms in wheat. Roles of root apical phosphate and malate exudation[J]. Plant Physiology,1996,112:591-597.
[31]Papernik L A,Bethea A S,Singleton T E,et al. Physiological basis of reduced Al tolerance in ditelosomic lines of Chinese Spring wheat[J]. Planta,2001,212(5/6):829-834.
[32]Pellet D M,Grunes D L,Kochian L V. Organic acid exudation as an aluminum tolerance mechanism in maize(Zea mays L.)[J]. Planta,1995,196:788-795.
[33]Jorge R,Arruda P. Aluminum-induced organic acid exudation by roots of an aluminum-tolerant tropic Al maize[J]. Phytochemistry,1997,45(4):675-681.
[34]Cancado G A,Loguercio I L,Martins P R,et al. Hematoxylin staining as a phenotypic index for aluminum tolerance selection in tropical maize(Zea mays L.)[J]. Theor Appl Cenet,1999,99(5):747-754.
[35]Aniol A,Gustafson J P. Chromosome location of genes controlling aluminum tolerance in wheat,rye and triticale[J]. Canadian Journal of Genetics and Cytology,1984,26(6):701-705.
[36]Luo M,Dvorak J. Molecular mapping of an aluminum tolerance locus on chromosome 4D of Chinese Spring wheat[J]. Euphytica,1996,91(1):31-35.
[37]Minella E,Sorrells M E. Aluminum tolerance in barley genetic relationships among genotypes of diverse origin[J]. Crop Science,1992,32:593-598.
[38]Nguyen B D,Brar D S,Bui B C,et al. Identification and mapping of the QTL for aluminum tolerance introgressed from the new source,Oryza rufipogon Griff.,into indica rice (Oryza sativa L.)[J]. Theoretical and Applied Genetics,2003,106(4):583-593.
[39]Gallego F J,Benito C. Genetic control of aluminium tolerance in rye (Secale cereale L.)[J]. Theoretical and Applied Genetics,1997,95(3):393-399.
[40]Mullet J,Klein R,Klein P. Sorghum bicolor—an important species for comparative grass genomics and a source of beneficial genes for agriculture[J]. Current Opinion in Plant Biology,2001,5:118-121.
[41]Ninamango C,Guimaraes C T,Martins P R,et al. Mapping QTLs for aluminum tolerance in maize[J]. Euphytica,2003,130:223-232.孙明法,严国红,唐红生,等. 籼型光温敏两用核不育系盐221S及其新组合盐两优2218的选育[J]. 江苏农业科学,2015,43(1):65-67.