促性腺激素释放激素类似物对人乳腺癌细胞的影响
2015-04-17张晓娟董士中马艳庆杨鹿鸣
张晓娟, 董士中, 马艳庆, 杨鹿鸣
(平煤神马医疗集团总医院内分泌科,河南 平顶山 467000)
促性腺激素释放激素类似物对人乳腺癌细胞的影响
张晓娟△, 董士中, 马艳庆, 杨鹿鸣
(平煤神马医疗集团总医院内分泌科,河南 平顶山 467000)
目的: 探讨促性腺激素释放激素 (gonadotropin-releasing hormone, GnRH)类似物曲普瑞林(triptorelin)对人乳腺癌细胞株MCF-7、MDA-MB-231细胞生长及细胞外信号调节蛋白激酶(extracellular signal-regulated kinase, ERK)/丝裂原活化蛋白激酶(mitogen-activated protein kinases, MAPK)和磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase, PI3K)/蛋白激酶B(protein kinase B, Akt)信号通路中重要信号分子ERK1/2和Akt活化的影响。方法: 使用不同浓度、不同时间的曲普瑞林刺激人乳腺癌MCF-7及MDA-MB-231细胞株,MTT法检测细胞增殖,流式细胞术检测细胞周期的分布,Western blotting检测Akt和ERK1/2的磷酸化程度。结果: 曲普瑞林(10-5mol/L)作用人乳腺癌MCF-7细胞192 h、曲普瑞林(10-4mol/L)作用人乳腺癌MCF-7细胞168 h、192 h或曲普瑞林(10-4mol/L)作用人乳腺癌MDA-MB-231细胞192 h可明显抑制细胞生长(P<0.05);曲普瑞林(10-4mol/L)作用人乳腺癌MCF-7和MDA-MB-231细胞192 h,ERK1/2的磷酸化程度均较正常对照组低,Akt的磷酸化程度较正常对照组高,但差异无统计学意义(P>0.05)。结论: GnRH类似物曲普瑞林对人乳腺癌细胞的抑制作用,不仅仅是通过对垂体激素的降调节机制,还可能产生直接抑制作用。但该抑制作用未涉及ERK/MAPK和PI3K/Akt信号通路。
MCF-7细胞; MDA-MB-231细胞; 促性腺激素释放激素; 细胞外信号调节蛋白激酶1/2; PI3K/Akt信号通路
内源性促性腺激素释放激素 (gonadotropin-releasing hormone, GnRH)是由下丘脑特殊分化的神经分泌细胞所合成并以脉冲方式释放的十肽激素,储存于神经末梢的分泌颗粒中,当受到生理或中枢神经递质刺激后,即通过门脉系统特异性地结合垂体前叶的GnRH受体。其主要生理功能为促使垂体合成和释放促黄体生成素(luteotrophic hormone,LH)和卵泡刺激素(follicle stimulating hormone,FSH)。GnRH类似物是人工合成的GnRH衍生物,可以与GnRH竞争GnRH受体,对垂体有双相作用,小剂量短期应用表现为促LH、FSH的刺激效应,当大剂量长时间给予GnRH尤其是GnRH类似物后,体内将产生促性腺功能的抑制效应,从而抑制睾丸和卵巢的功能。由于其对垂体激素降调节作用,GnRH及其类似物的研究和应用领域主要包括内分泌依赖性肿瘤,如治疗促性腺发育不良、乳腺癌、前列腺癌、胰腺癌、子宫内膜癌和卵巢癌等。
GnRH类似物治疗乳腺癌的机制,一般被认为是由于经负反馈作用抑制下丘脑-垂体-性腺轴的功能,继而降低血中雌激素的水平,抑制了乳腺癌的生长。但除此之外,GnRH类似物是否能够对乳腺癌细胞产生直接的作用以及作用机制是什么,到目前仍存在着分歧,关于其它作用机制及合理用药研究也较少,对该机制的研究将为临床用药的安全性提供重要的理论依据和科研价值。
材 料 和 方 法
1 主要实验用品及化学试剂
人乳腺癌细胞株MCF-7和MDA-MB-231购自中国科学院上海生科院细胞资源中心;GnRH类似物曲普瑞林(辉凌制药);四甲基偶氮唑盐(MTT)、Akt、磷酸化Akt(ser473)、ERK1/2、磷酸化ERK1/2抗体和辣根过氧化物酶标记山羊抗兔、鼠IgG(上海碧云天生物技术公司)。
2 细胞培养
人乳腺癌MCF-7细胞培养于含10%小牛血清和1×105U/L青、链霉素的RPMI-1640培养基中,在37 ℃、5% CO2湿润的环境中培养。
3 主要方法
3.1 MTT法检测细胞增殖 取对数生长期MCF-7和MDA-MB-231人乳腺癌细胞,调整细胞浓度为2×107/L,接种于96孔板中,待细胞贴壁后分别加入含不同浓度(10-7、10-6、10-5、10-4mol/L)曲普瑞林培养液200 μL,每组设6个复孔,分别作用细胞48 h、96 h、168 h、192 h,以上均设未处理对照组。每孔加入MTT液(5 g/L) 10 μL,振荡后继续37 ℃、5% CO2孵育4 h,吸去上清液,每孔加入DMSO 150 μL,振荡5 min,用酶标仪在490 nm波长处测定各孔的吸光度(A)值,实验重复3次。
3.2 流式细胞仪测细胞周期 将处于对数生长期的MCF-7和MDA-MB-231人乳腺癌细胞以每孔8×104个接种于6孔板,贴壁48 h,分别用 10-4mol/L曲普瑞林作用于细胞,设立阴性对照组,培养192 h,收集细胞,PBS洗涤2次,离心后的细胞沉淀用70%乙醇2 mL重悬,4 ℃过夜,50 g/L PI染液染色,4 ℃避光30 min,流式细胞仪检测细胞周期分布。
3.3 Western blotting检测ERK1/2和Akt的表达 将处于对数生长期的MCF-7和MDA-MB-231人乳腺癌细胞以每孔1×105个接种于6孔板,贴壁48 h,10-4mol/L曲普瑞林作用192 h,设立对照组,提取细胞总蛋白;BCA法测定蛋白浓度;每泳道上样100 μg蛋白,SDS-PAGE分离蛋白,转膜,封闭,Ⅰ抗(1∶600)摇床4 ℃孵育过夜,TBST洗膜5 min 3次,加HRP标记的Ⅱ抗(1∶1 000)孵育1 h,以免疫印迹化学发光试剂进行放射自显影。
4 统计学处理
采用SPSS 17.0统计软件对数据进行分析,实验数据以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,两组比较采用两独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 不同浓度、作用时间的曲普瑞林对人乳腺癌MCF-7和MDA-MB-231细胞增殖的影响
浓度为10-5mol/L的曲普瑞林作用于人乳腺癌MCF-7细胞192 h或浓度为10-4mol/L的曲普瑞林作用168 h、192 h均可明显抑制细胞生长,与对照组相比较差异有统计学意义(P<0.05),且抑制作用呈现出时间依赖性关系;而浓度为10-6mol/L、10-7mol/L的曲普瑞林作用48 h、96 h、168 h、192 h均未表现出明显抑制作用, 与对照组相比较差异均无统计学意义;浓度为10-5mol/L曲普瑞林作用48 h、96 h、168 h及10-4mol/L的曲普瑞林作用48 h、96 h也未表现出明显抑制作用,与对照组相比较差异均无统计学意义,见图1。
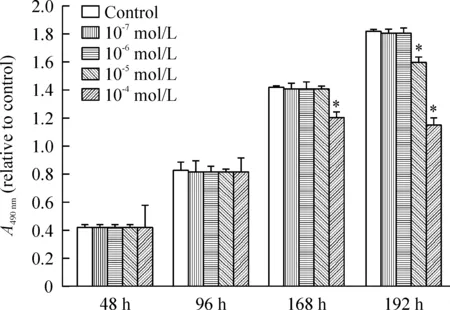
Figure 1.Comparison of absorbance in MCF-7 cells treated with different concentration of triptorelin at different time points. Mean±SD. n=3.*P<0.05 vs control group.
浓度为10-4mol/L的曲普瑞林作用人乳腺癌MDA-MB-231细胞192 h可明显抑制细胞生长,与对照组相比较差异有统计学意义(P<0.05)。浓度为10-7mol/L、10-6mol/L和10-5mol/L的曲普瑞林分别作用人乳腺癌 MDA-MB-231细胞48 h、96 h、168 h、192 h或浓度为10-4mol/L曲普瑞林作用人乳腺癌MDA-MB-231细胞48 h、96 h、168 h与对照组相比较差异均无统计学意义,见图2。

Figure 2.Comparison of absorbance in MDA-MB-231 cells treated with different concentrations of triptorelin at diffe-rent time points. Mean±SD. n=3. *P<0.05 vs control group.
2 曲普瑞林对人乳腺癌MCF-7和MDA-MB-231细胞对细胞周期的影响
浓度为10-4mol/L的曲普瑞林作用人乳腺癌MCF-7细胞192 h,反映细胞增殖活性的G2/M+S期细胞数目占(54.822±1.597)%,较对照组(84.228±0.962)% 明显减少,差异有统计学意义(P<0.05),说明曲普瑞林能够抑制人乳腺癌MCF-7细胞的生长,见表1。
浓度为10-4mol/L的曲普瑞林作用人乳腺癌MDA-MB-231细胞192 h,反映细胞增殖活性的G2/M+S期细胞数目占(63.731±1.388)%,较对照组(87.686±0.830)%明显减少,差异有统计学意义(P<0.05),说明曲普瑞林能够抑制人乳腺癌MDA-MB-231细胞的生长,见表2。

表1 曲普瑞林作用MCF-7细胞192 h后的细胞周期分析
*P<0.05vscontrol group.

表2 曲普瑞林作用MDA-MB-231细胞192 h后的细胞周期结果
*P<0.05vscontrol group.
3 曲普瑞林对人乳腺癌MCF-7和MDA-MB-231细胞ERK1/2和Akt磷酸化的影响
浓度为10-4mol/L的曲普瑞林作用于人乳腺癌MCF-7细胞192 h,对照组的ERK1/2磷酸化程度即p-ERK1/2/ERK1/2为(47.018±1.218)%,曲普瑞林组的ERK1/2磷酸化程度为(43.912±2.044)%,较对照组降低,但差异无统计学意义。对照组的Akt磷酸化程度即p-Akt/Akt为(56.295±0.790)%,曲普瑞林组Akt磷酸化程度为(58.343±1.057)%,较对照组升高,但差异无统计学意义,见图3。
浓度为10-4mol/L的曲普瑞林作用于人乳腺癌MDA-MB-231细胞192 h,对照组的ERK1/2磷酸化程度为44.381±1.255)%,曲普瑞林组的ERK1/2磷酸化程度为(42.656±0.795)%,较对照组降低,但差异无统计学意义;对照组的Akt磷酸化程度为(60.219±0.826)%,曲普瑞林组的Akt磷酸化程度为(61.764±0.698)%,较对照组升高,但差异无统计学意义,见图4。
讨 论
乳腺癌是全世界女性最常见的恶性肿瘤之一,严重威胁着人类的生命和生活质量,死亡率占女性癌症总死亡率的14%[1]。而对于乳腺癌的治疗方法是以手术为主,放疗、化疗、激素治疗为辅的综合治疗。目前临床上应用最多的治疗乳腺癌的激素类药物有抗雌激素类、孕激素类、芳香化酶抑制剂和GnRH类似物。醋酸曲普瑞林是GnRH的强力激动剂,其血浆半衰期延长,与GnRH受体亲和力为天然GnRH的数十倍。目前临床上应用的GnRH类似物治疗乳腺癌,主要是针对绝经期前的乳腺癌患者,其有效率可达31%~63%。对于绝经期后的患者,虽然疗效不及绝经期前的乳腺癌患者,但也可达到22%左右[2]。而GnRH类似物治疗乳腺癌的机制,一般被认为是由于其抑制了下丘脑-垂体-性腺轴的功能,继而降低靶腺分泌雌激素的水平,抑制了乳腺癌的生长。显然,GnRH类似物此种作用机制并不能解释对绝经后患者的疗效。

Figure 3.The effects of triptorelin on the expression of p-Akt and p-ERK1/2 in MCF-7 cells. Mean±SD. n=3.
MAPK和PI3K/Akt信号通路是人体内重要的信号通路,能够促进肿瘤细胞增殖和肿瘤血管形成,抑制肿瘤细胞凋亡,增强肿瘤侵袭性,在肿瘤发生、发展和转移中起重要作用[3-4]。 MAPK属于丝氨酸/苏氨酸蛋白激酶, 可被多种因素(细胞因子、生长因子、神经递质、激素、细胞应激和细胞黏附等)刺激而活化。由生长因子等介导的细胞增殖过程中,PI3K/Akt信号通路发挥了不可或缺的作用[5]。研究表明,在乳腺癌中,PI3K-Akt通路的活化率高达70%[6]。近年来的研究发现GnRH结合位点存在于卵巢、前列腺、子宫内膜、胰腺、垂体和肝脏等组织发生的肿瘤细胞上, GnRH类似物可促进这些癌细胞的凋亡。GnRH抑制肿瘤增殖的效应可能是通过独立于GnRH之外的作用机制完成的。关于GnRH与肿瘤的作用机制方面,近期有研究报道GnRH类似物与受体结合后,可能通过蛋白激酶C、MAPK、ERK等信号通路抑制肿瘤细胞增殖与分化[7]。在卵巢癌细胞中,Ⅱ型GnRH可以通过p38途径调节细胞增殖[8]。GnRH受体在乳腺癌中已被鉴定出来。据报道,在体外实验中,GnRH激动剂和GnRH拮抗剂可抑制乳腺癌上皮的生长,其效应是通过受体调节直接作用于细胞生长和增殖环节[9]。同样的结果也出现在使用GnRH激动剂goserelin抑制前列腺癌细胞LNCaP时[10]。

Figure 4.The effects of triptorelin on the expression of p-Akt and p-ERK1/2 in MDA-MB-231 cells. Mean±SD. n=3.
GnRH类似物对人乳腺癌细胞增生的影响仍有争议。大部分的研究表明, GnRH 类似物可以抑制乳腺癌细胞的增殖[11]。但是也有少部分研究表明, GnRH类似物并不影响乳腺癌细胞的增生[12-13]。本实验中,选用了雌激素受体阳性的人乳腺癌MCF-7细胞和雌激素受体阴性的人乳腺癌MDA-MB-231细胞,测定GnRH类似物曲普瑞林对2种人乳腺癌细胞增殖及ERK/MAPK、PI3K/Akt信号通路中重要信号分子ERK1/2和Akt活化程度的影响。研究显示GnRH类似物曲普瑞林对人乳腺癌细胞有抑制作用,这一结果与Ohta等[14]的结论相似,即观察GnRH激动剂buserelin作用于人类子宫内膜癌细胞系(Ishikawa 、EIIL、HEC-1A)、人乳腺癌细胞系(MCF-7)和卵巢癌细胞系(OVHS-1)24 h和168 h后的生长状况,发现与阴性对照组相比,24 h给药组没有显著差异,而168 h后都呈现抑制细胞生长的状态,因此GnRH类似物的生物效应可能与药物作用浓度和时间有关。用Western blotting法测定蛋白表达,浓度为10-4mol/L的曲普瑞林作用人乳腺癌MCF-7和MDA-MB-231细胞192 h,均表现为ERK1/2的磷酸化程度较正常对照组下降,Akt的磷酸化程度较正常对照组升高,但差异无统计学意义。提示该抑制作用可能并不通过ERK/MAPK和PI3K/Akt信号通路完成,这有待进一步研究。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90.
[2] Burger CW, Prinssen HM, Kenemans P. LHRH agonist treatment of breast cancer and gynecological malignancies: a review[J]. Eur J Obstet Gynecol Reprod Biol, 1996, 67(1):27-33.
[3] Shen Q, Uray IP, Li Y, et al. The Ap-1 transcription factor regulates breast cancer cell growth via cyclins and E2F factors[J]. Oncogene, 2008, 27(3):366-377.
[4] Park CM, Park MJ, Kwak HJ, et al. Ionizing radiation enhances matrix metalloproteinase-2 secretion and invasion of glioma cells through Src/epidermal growth factor receptor mediated p38/Akt and phosphatidylinositol 3-kinase/Akt signaling pathways[J]. Cancer Res, 2006, 66(17):8511-8519.
[5] 冯美江,丁新生.Akt与细胞生存[J].国外医学:分子生物学分册,2002,24(5):283-285.
[6] Lopez-Knowles E, OToole SA, MeNeil CM, et al. PI3K pathway activation in breast cancer is associated with the basal-like phenotype and cancer-specific mortality[J]. Int J Cancer, 2010, 126(5):1121-1231.
[7] Leung PC, Choi JH. Endocrine signaling in ovarian surface epithelium and cancer[J]. Hum Reprod Update, 2007, 13(2):143-162.
[8] Kim KY, Choi KC, Park SH, et al. Type II gonadotropin-releasing hormone stimulates p38 mitogen-activated protein kinase and apoptosis in ovarian cancer cells[J]. J Clin Endocrinol Metab, 2004, 89(6):3020-3026.
[9] Benshushan A, Brzezinski A. Hormonal manipulations and breast cancer[J]. Obstet Gynecol Surv, 2002, 57(5):314-323.
[10]Grundker C, Volker P, Schulz KD, et al. Luteinizing hormone-releasing hormone (LHRH) agonist triptorelin and antagonist cetroelix inhibit EGF-induced c-fos expression in human gynecological cancers[J]. Gynec Oncol, 2000, 78(2):194-202.
[11]Foekens JA, Henkelman MS, Fukkink JF, et al. Combined effects of buserelin, estradiol and tamoxifen on the growth of MCF-7 human breast cancer cellsinvitro[J]. Biochem Biophys Res Commun, 1986, 140 (2):550-556.
[12]Eidne KA, Flanagan CA, Harris NS, et al. Gonadotropin-releasing hormone ( GnRH ) - binding sites in human breast cancer cell lines and inhibitory effects of GnRH antagonists[J]. J Clin Endocrinol Metab, 1987, 64(3):425-432.
[13]Sharoni Y, Bosin E, Miinster A, et al. Inhibition of growth of human mammary tumor cells by potent antagonists of luteinizing hormone- releasing hormone[J]. Proc Natl Acad Sci U S A, 1989, 86( 5):1648-1651.
[14]Ohta H, Sakamoto H, Satoh K.Invitroeffects of gonadotropin-releasing hormone (GnRH) analogue on cancer cell sensitivity to cis-platinum[J]. Cancer Lett, 1998, 134(1):111-118.
Effect of gonadotropin-releasing hormone analogue on human breast cancer cell lineinvitro
ZHANG Xiao-juan, DONG Shi-zhong, MA Yan-qing, YANG Lu-ming
(DepartmentofEndocrinology,ChineseShenmaGroupGeneralHospitalofPingdingshanCoal,Pingdingshan467000,China.E-mail:zhangxj86822@126.com)
AIM: To investigate the effects of gonadotropin-releasing hormone (GnRH) analogue on the growth of breast cancer cell lines MCF-7 and MDA-MB-231invitroand to explore the related mechanisms with PI3K/Akt or ERK/MAPK pathways. METHODS: The proliferation of human breast cancer cell lines MCF-7 and MDA-MB-231 treatment with triptorelin was detected by MTT assay and the distribution of the cell cycle was determined by flow cytometry. The phosphorylation of the ERK1/2 and Akt was evaluated by Western blotting. RESULTS: Triptorelin inhibited the proliferation of MCF-7 cells at concentration of 10-5mol/L after treated for 192 h or at concentration of 10-4mol/L after treated for 168 h and 192 h. Triptorelin inhibited the proliferation of MDA-MB-231 cells at concentration of 10-4mol/L after treated for 192 h (P<0.05).Treatment with triptorelin for 192 h at concentration of 10-4mol/L had no statistical significance effect on phosphorylation of ERK1/2 and Akt(P>0.05).CONCLUSION: Inhibitory effect of GnRH analogue triptorelin on human breast cancer cells is not just the connection with the down-regulation of pituitary hormone, but also a direct inhibitory effect. The role may not be involved in the activation of ERK/MAPK and PI3K/Akt signaling pathways.
MCF-7 cells; MDA-MB-231 cells; Gonadotropin-releasing hormone; Extracellulalr signal-regulated kinase 1/2; PI3K/Akt signaling pathway
1000- 4718(2015)01- 0130- 05
2014- 07- 26
2014- 09- 10
△通讯作者 Tel: 0375-2799332; E-mail: zhangxj86822@126.com
R73-3
A
10.3969/j.issn.1000- 4718.2015.01.025
