生物饲料对凡纳滨对虾生长、免疫及消化功能的影响
2015-04-11王宝杰蒋克勇沙玉杰
夏 青 , 王宝杰 刘 梅 蒋克勇 沙玉杰 , 辛 芳 , 王 雷
(1.中国科学院 海洋研究所 海洋生态养殖技术国家地方联合工程实验室, 山东 青岛 266071; 2.中国科学院大学, 北京 100049)
凡纳滨对虾在我国已有多年养殖历史, 是水产业重要的支柱产业之一, 而近年来凡纳滨对虾养殖病害频发, 与环境污染、对虾抗病力下降等因素密切相关, 解决这一问题的途径之一是开发新型的功能性饲料。生物饲料一般是指利用基因工程、蛋白质工程、发酵工程等生物技术配制的新型饲料, 它具有提高饲料效价和利用率、有效节约资源、减少环境或水体污染、增强动物免疫抗病力、预防病害、提高安全性等优点。如: 发酵豆粕、酶制剂、益生菌、生物活性肽和寡糖等。目前, 利用生物技术原理开发的对虾全价生物饲料尚未见报道。
对虾饲料中主要营养成分一般包括蛋白质、脂肪、碳水化合物、维生素和矿物元素等[1-2]。国内外很多研究集中针对开发新型蛋白源, 有关研究指出酶解蛋白能够将低价值的鱼类加工副产物转化为具有极高含量必需氨基酸的促生长及免疫促进的生物功能物质, 可增强鱼类溶菌酶活力、增加血清补体及 LgM浓度[3-5]。植物蛋白通过高温、酶解、发酵等过程, 改善了其必需氨基酸组成及含量不足,含有较多抗营养因子, 适口性不佳等缺点[6]。酵母蛋白已作为一种新型饲料蛋白源替代鱼粉用于水产养殖业[7]。
本研究以生物酶解制备小肽、复合益生菌发酵植物蛋白、自溶及破壁制备酵母蛋白等新型生物原料配制生物饲料, 并进行为期 8周的生产性养殖试验, 探究生物饲料对凡纳滨对虾生长、免疫及消化性能的影响, 以期为通过功能性饲料提高凡纳滨对虾抗病力及安全控制对虾病害提供依据。
1 材料及方法
1.1 试验饲料
发酵豆粕是将枯草芽孢杆菌和产朊假丝酵母接种在豆粕中发酵获得, 酶解多肽是用碱性蛋白酶和风味蛋白酶酶解水产动物加工副产品所得, 破壁酵母是热带假丝酵母和产朊假丝酵母于培养基中发酵所得发酵物经诱导自溶和破壁处理后所得, 以烟台大乐公司生产的南美白对虾饲料作为对照饲料, 将以上三种原料分别替代大乐饲料中一定比例的鱼粉、豆粕和饲料酵母, 使其在配方的用量比例分别达到 8%、10%及 2%, 获得供试验用的对虾生物饲料,营养成分分析由中科院海洋所分析测试中心测定,结果见表1。
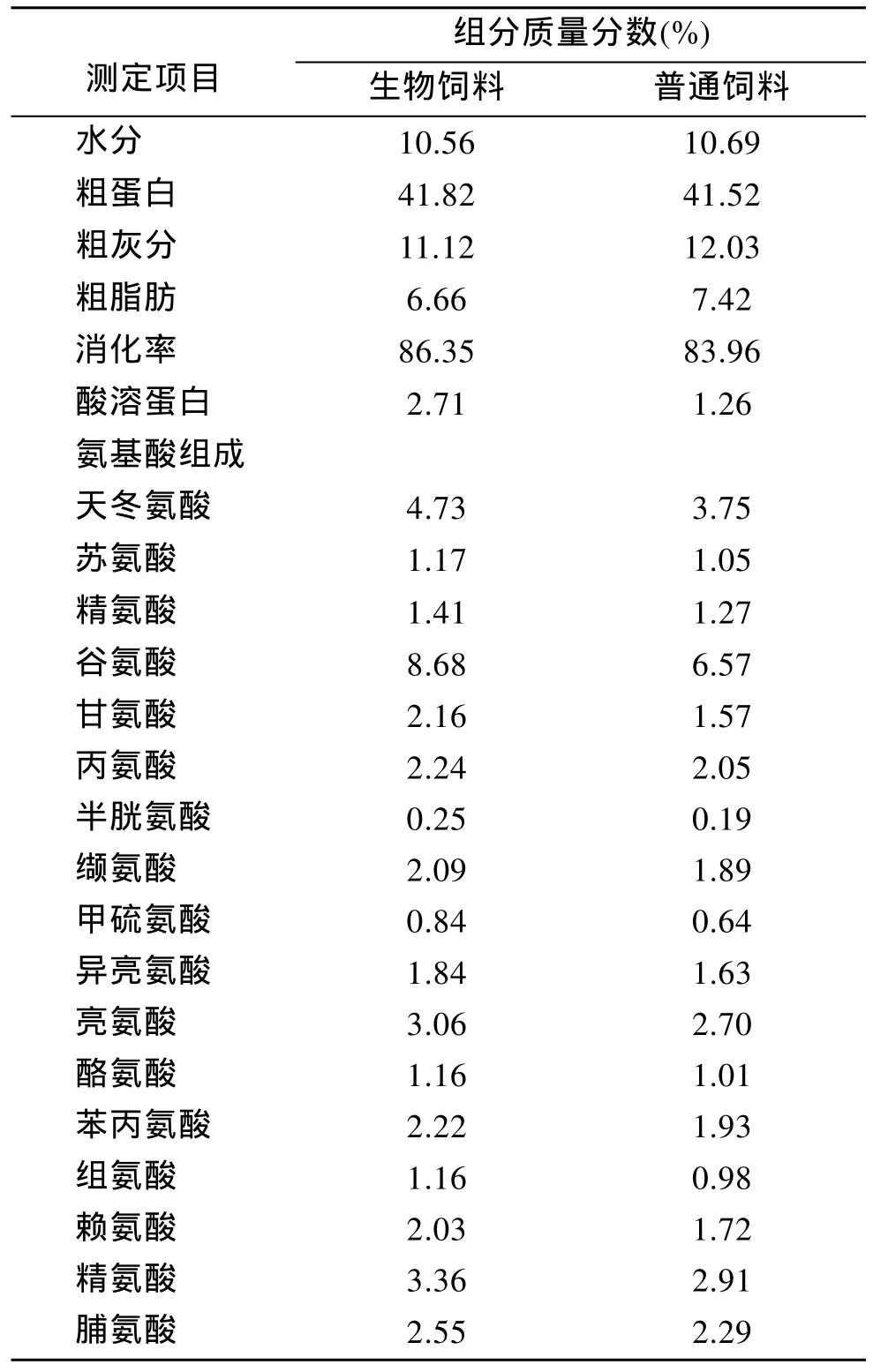
表1 生物饲料与普通饲料组分及营养成分分析Tab.1 Proximate and amino acid compositions of treatment-diet and control-diet
1.2 饲养试验
试验于2013年7~8月在山东滨州乔庄镇仓上村对虾养殖场进行, 该养殖场水源为地下淡水。试验选择两口条件相近的池塘, 试验池面积为 1267m2, 对照池面积为 1000m2。每池配备 1.75kW 叶轮式增氧机一台。凡纳滨对虾种苗为一代虾苗, 放养密度为36万尾/ha。各项管理完全按照生产规程进行。日投饵量为对虾体质量的 2%并根据天气及对虾摄食情况调整, 每日投喂3次, 分别在6:00、11:00及19:00。每 2日采集水样进行水质分析, 现场采用雷磁PHS-3D型便携式pH计测定pH, 用WYY-便携式折射盐度计测量盐度。用YSI550便携式溶氧仪测定溶解氧(DO)及水温, 氨氮采水杨酸分光光度计 HJ 536-2009法国家标准测定; 亚硝酸盐选用分光光度法GB 7493-87测定。每15d用旋网随机取对虾样品一次。
1.3 样品采集及处理
试验末期随机取30尾虾, 测其体质量和体长。计算成活率、饵料系数。计算公式:
成活率( Survival rate, SR) =(试验结束时虾尾数/试验开始时投放的虾尾数)× 100%;
饵料系数( Feed conversion rate, FCR) =饲料摄入量/(终末体质量-初始体质量);
试验期间, 每 15d取样一次, 每池随机取 30尾虾, 测其体长和体质量。后用 5mL无菌注射器自第二腹节处插入采血, 将混合血样放入冰盒中, 4℃保存过夜。血样于第2天处理, 在4℃条件下以6000r /min离心10 min, 取上清液, 放入超低温冰箱–80℃中保存待测。采样当天将此30尾虾进行肝胰腺合并采集,分析时, 将肝胰腺样品称量后, 按照9倍体积加入提前在0℃冰箱中预冷的0.1 mol /L, pH 6.4的磷酸缓冲液稀释, 在冰浴中用匀浆器匀浆, 将匀浆液在0℃、2500r /min离心10 min 后, –80℃冰箱冷藏待用。
1.4 血清免疫及肝胰腺消化指标测定
SOD测定采用南京建成生物工程研究所的SOD试剂盒进行; 溶菌活性测定将二次活化的溶壁微球菌活化培养48 h, 后收集菌体, 按Hultmark等[8]的方法, 用磷酸钾盐缓冲液(pH=6.4, 0.1mol/L)稀释至A570nm=0.3, 配成底物悬液供测试用; 抑菌活性以大肠杆菌为底物, 将二次活化的本实验室分离的大肠杆菌活化培养 48 h, 后收集菌体, 按 Hultmark等[8]及 Boman等[9]的方法, 用磷酸钾盐缓冲液(pH=6.4,0.1mol/L)稀释至A570nm= 0.3, 配成底物悬液供测试用; 蛋白酶活力以酪蛋白为底物, 取1 mL肝胰腺匀浆液与等体积的Tris-HCl缓冲液(pH 7.4, 0.05 mol/L)混合, 加入20 g/L的酪蛋白底物溶液2 mL, 于37℃下消化反应 30 min, 参考刘玉梅等[10]的方法测定;肝胰腺和血清中的总蛋白含量测定采用南京建成生物工程研究所考马斯亮蓝蛋白测定试剂盒。
1.5 数据分析
试验数据均用 SPSS 19.0分析软件 One-way ANOVA模型来分析, 多重比较采用LSD法, 数据以平均数±标准误表示。
2 结果
2.1 水质变化
养殖过程中的pH、NO2-N及NH4-N变化如表2所示, 生物饲料组与普通饲料组的环境理化因子无显著性差异(P>0.05), pH维持在 7.5~7.9, NO2-N及NH4-N维持在较低水平。研究表明, 氨氮和亚硝酸氮的安全质量浓度为0.500 mg/L以下[11]。

表2 虾池中水化因子变化情况Tab.2 Variation of quality of water in the shrimp ponds
2.2 生物饲料对凡纳滨对虾生长性能的影响
由表3可知, 生物饲料组平均产量为1242.5 kg/ha,高于普通饲料组平均产量1180.5 kg/ha。生物饲料组成活率达91.5%, 高于普通饲料组的86.2%; 生物饲料饵料系数为0.96, 低于普通料的1.01。
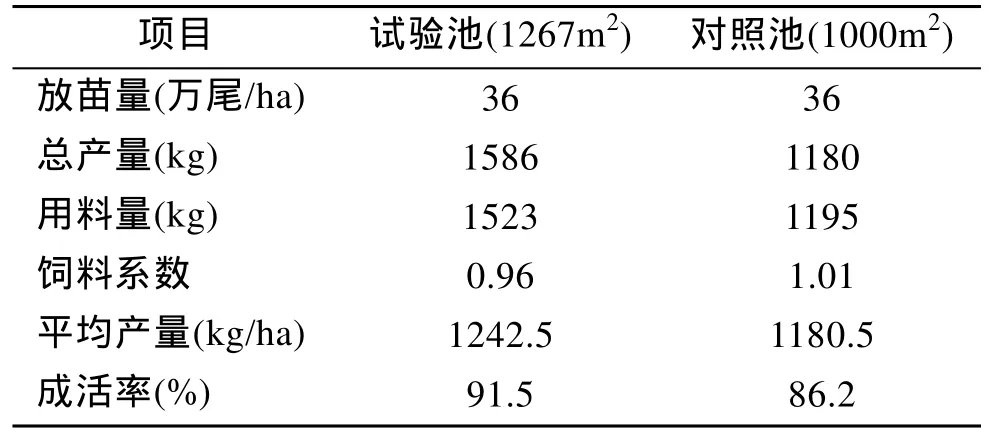
表3 对虾产量情况Tab.3 The shrimp production in farm
2.3 生物饲料对凡纳滨对虾免疫及消化性能的影响
如图1所示, 超氧化物歧化酶(SOD)活性为1.195~2.150 U/mg, 喂养15 d时, 普通饲料SOD活性较高, 随着喂养时间的延长, 生物饲料组对虾的SOD活性开始上升, 至45 d生物饲料组显著高于普通饲料组(P<0.05); 血清总蛋白含量为178~320 mg/mL,喂养 15 d时, 普通饲料含量较高, 随着喂养时间延长, 生物饲料组对虾血清总蛋白含量开始上升, 至45 d生物饲料组显著高于普通饲料组(P<0.05); 溶菌活性为31~85 mU/mg, 投喂生物饲料15 d无显著提高(P>0.05), 15 d后溶菌活力显著上升, 持续显著高于普通饲料组, 较普通饲料组有显著性提高(P<0.05),普通饲料组溶菌活性无显著波动; 抑菌活力变化范围为9~38 mU/mg, 生物饲料未显著提高对虾抑菌活力, 与普通饲料组相比无显著性差异(P>0.05)。
养殖现场观察, 生物饲料组对虾肠道粗长、均匀且清晰无炎症, 虾粪较松软, 说明生物饲料有助于对虾消化和吸收率的提高。由图1可知, 生物饲料对凡纳滨对虾肝胰脏中的蛋白酶、总蛋白含量均有显著影响(P<0.05)。总蛋白酶活性以生物料30 d时最高,前30 d生物饲料组均显著高于普通饲料组。
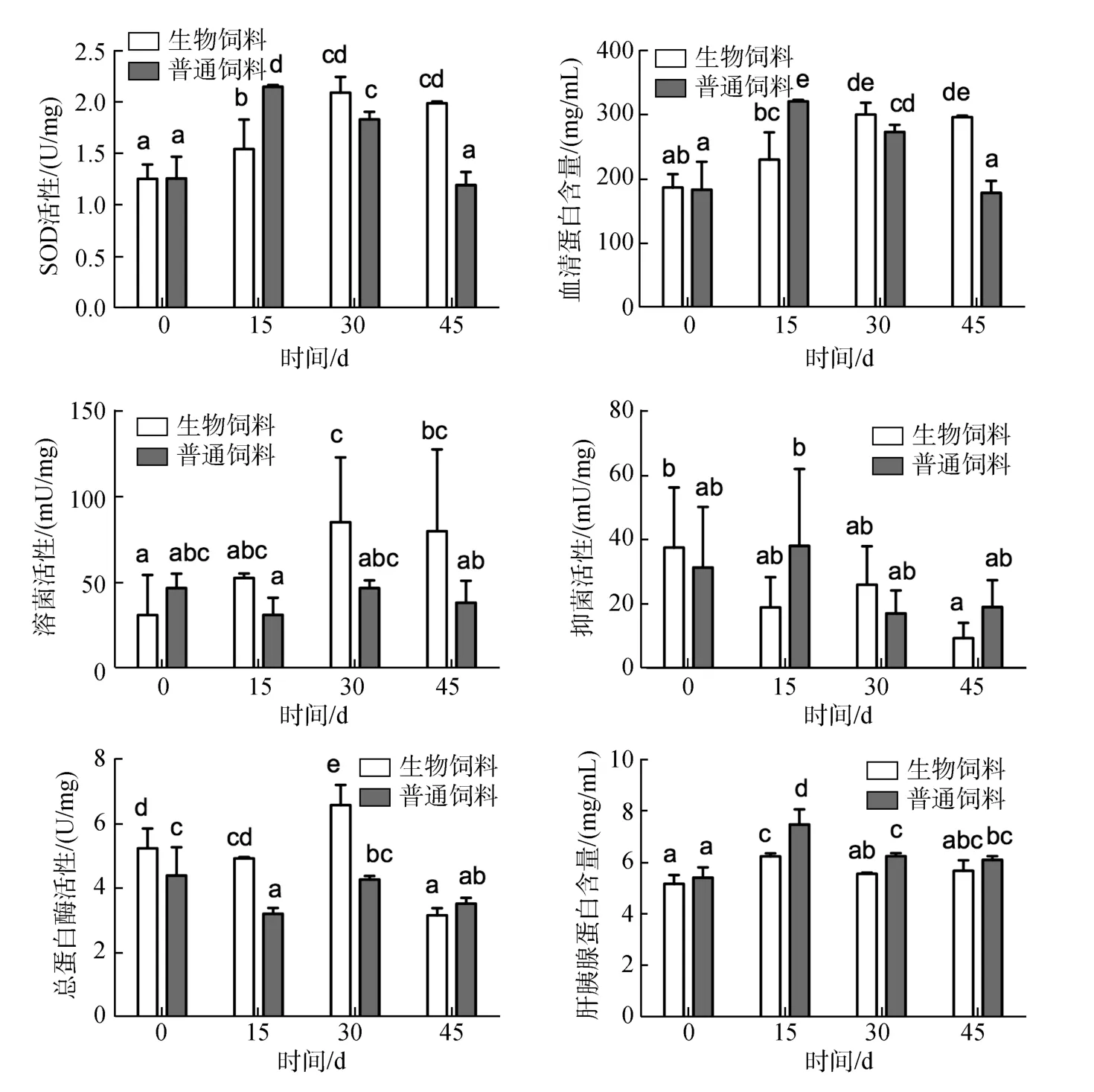
图1 生物饲料组与普通饲料组对虾血清免疫功能及肝胰腺消化功能指标的比较Fig.1 Hemolymph immune and hepatopancreas digestibility performance analysis of treatment-diet and control-diet
3 讨论
3.1 生物饲料对凡纳滨对虾对虾成活率的影响
由于养殖环境因子不稳定、高温、暴雨等频发,环境胁迫因子(如水体 pH、温度、盐度等)急剧变化诱导的生理效应造成生物体内有氧代谢异常[12-14],即活性氧自由基大量积累而引起机体的氧化损伤,抑制对虾免疫系统功能, 降低对虾的抗感染能力[15]。本试验生物饲料组对虾成活率达 91.5%, 高于普通料组的 68.2%(表3), 可能是由于生物饲料中酶解蛋白的作用。酶解蛋白含有较高的抗氧化作用的生物活性小肽, 暴露大量酪氨酸、色氨酸、甲硫氨酸、赖氨酸、半胱氨酸及组氨酸, 使小肽具有极高的抗氧化活性, 缓解由环境胁迫因子引起机体的氧化损伤,从而使生物体抗病抗感染[16]。本试验针对饲料氨基酸组成分析发现生物饲料中含有较高的酪氨酸、色氨酸、甲硫氨酸、赖氨酸、半胱氨酸及组氨酸等(表1), 因此生物饲料可能通过抗氧化损伤从而提高对虾成活率。
3.2 生物饲料对凡纳滨对虾免疫功能影响
甲壳动物非特异性免疫依靠血淋巴中的血细胞及多种活性因子组成一些非特异性酶或因子来进行吞噬作用、血液凝集、结节形成及外排, 水解酶作用、酚氧化酶原激活系统, 从而提高机体抗病能力[17-18]。本研究中生物饲料中的成分均可有效提高对虾免疫性能, 酶解蛋白可增强溶菌酶活力、增加血清补体及LgM 浓度[4-5]; 破壁酵母其蛋白含量较高, 含有丰富的碱基、核酸、β-葡聚糖、维生素、木聚糖、寡甘露聚糖等, 往往作为生物活性物质具有免疫增强的作用[19]; 此外发酵豆粕含有较多益生菌, 益生菌对肠道黏膜细胞有保护作用[20], 促进肠道对外在细菌及物质的保护屏障[20-21]。
SOD是一种重要的抗氧化酶, 对于增强吞噬细胞防御能力和整个机体的免疫功能有重要作用, 因此SOD常作为机体免疫指标来评判机体免疫力[22]。当SOD活性降低时, 生物体内会出现自由基过多的现象, 扰乱和破坏体内一些重要的生化过程, 导致代谢混乱, 正常生理功能失调, 体内免疫水平下降,因此导致对虾发病[23]。本试验投喂生物饲料30d后,SOD活性显著上升, 并显著高于普通饲料组。这说明生物饲料可以增强凡纳滨对虾的免疫力及抗病能力。
溶菌活性是机体免疫系统的综合体现, 反映了机体对病原微生物侵染的防御能力, 尤其是在高密度集约化养殖中, 对于增强对虾抵抗疾病的能力发挥着重要作用[24]。本试验中对虾投喂生物饲料15 d后溶菌活力显著上升, 持续显著高于普通饲料组(P<0.05)。有研究针对酵母提取物投喂凡纳滨对虾对虾后, 发现对虾溶菌活力显著上升[25]。
血清抑菌活性在水产动物清除致病菌及毒素具有重要作用。研究表明对虾免疫防御中抗菌肽发挥重要作用, 有学者从养殖凡纳滨对虾的血细胞和血浆中分离出几种抗菌活性因子, 这些抗菌肽具有广谱抗菌活性, 在血淋巴内合成后以成熟肽的形式存在, 受到刺激后才释放[26]。本试验发现对抑菌活性的测定并无发现各时刻生物料组与普通料组有显著性差异, 但夏季是弧菌病高发季节, 水体中弧菌浓度较高。试验组对虾具有较高的存活率, 达91.5%, 高于普通料组的 68.2%(表3), 说明生物饲料组对虾具有较高的抗菌能力, 可能促进抗菌物质如抗菌肽的生成, 血淋巴中抗菌肽含量增加, 而在有细菌刺激的条件下, 抗菌肽大量释放, 降解菌体的细胞壁, 从而提高了抗菌能力。
3.3 生物饲料对凡纳滨对虾消化功能及生长的影响
很多研究表明酶解蛋白、发酵豆粕及单细胞酵母蛋白均具有生长促进作用[6,27-28]。酶解蛋白能够将低价值的鱼类加工副产物转化为具有极高含量必需氨基酸的促生长及免疫促进的生物功能物质[16]; 发酵植物蛋白中益生菌菌数较高, 有利于保护对虾肠道粘膜细胞, 有利于促进生物饲料组对虾的消化吸收从而促进生长; 此外生物饲料中的破壁酵母, 其细胞壁的某些成分如β-葡聚糖、寡甘露聚糖等, 据报道有调节肠道微生物群系从而有利于水产动物消化吸收的作用[26]。本试验中, 生物料组平均产量为1242.5 kg/ha, 高于普通料组平均产量 1180.5 kg/ha,具有更优的生长性能。
对虾消化酶活性的提高与食物消化率、生长的增长有极大相关性[29], 本试验生物饲料的组成中含有发酵豆粕, 可以消除普通豆粕中蛋白酶抑制因子的影响, 因而对虾总蛋白酶活性并未受到抑制, 前30 d均显著高于普通饲料组, 说明生物饲料对提高对虾消化功能、促进生长有一定作用, 但有关生物饲料的作用机制尚有待进一步研究。
[1] Smith L L, Lee P G, Lawrence A L, et al.Growth and digestibility by three sizes of Penaeus vannamei Boone:effects of dietary protein level and protein source[J].Aquaculture, 1985, 46(2): 85-96.
[2] Akiyama D M, Dominy W G, Association A S.Penaeid shrimp nutrition for the commercial feed industry:American Soybean Association St.Louis, MO, 1989.
[3] Hermannsdottir R, Johannsdottir J, Smaradottir H, et al.Analysis of effects induced by a pollock protein hydrolysate on early development, innate immunity and the bacterial community structure of first feeding of Atlantic halibut (Hippoglossus hippoglossusL.)larvae[J].Fish & Shellfish Immunology, 2009;27(5):595-602.
[4] Liang M, Wang J, Chang Q, et al.Effects of different levels of fish protein hydrolysate in the diet on the nonspecific immunity of Japanese sea bass,Lateolabraxjaponicus(Cuvieret Valenciennes,1828)[J].Aquaculture Research, 2006, 37(1): 102-106.
[5] Tang H g, Wu T x, Zhao Z y, et al.Effects of fish protein hydrolysate on growth performance and humoral immune response in large yellow croaker(Pseudosciaena croceaR.)[J].Journal of Zhejiang University Science B, 2008, 9(9): 684-690.
[6] Millamena O M, Teruel M, Kanazawa A, et al.Quantitative dietary requirements of postlarval tiger shrimp, Penaeus monodon, for histidine, isoleucine,leucine, phenylalanine and tryptophan[J].Aquaculture,1999, 179(1): 169-179.
[7] Oliva-Teles A, Gonçalves P.Partial replacement of fishmeal by brewers yeast (Saccaromyces cerevisae) in diets for sea bass (Dicentrarchus labrax) juveniles[J].Aquaculture, 2001, 202(3): 269-278.
[8] Hultmaek D, Steiner H, Rasmuson T, et al.Insect immunity.Purification and properties of three inducible bactericidal proteins from hemolymph of immunized pupae ofHyalophora cecropia[J].European Journal of Biochemistry, 1980, 106(1): 7-16.
[9] Boman H G, Nilsson-Faye I, Paul K, et al.Insect immunity I.Characteristics of an inducible cell-free antibacterial reaction in hemolymph ofSamia cynthiapupae[J].Infection and Immunity, 1974, 10(1): 136-145.
[10] 刘玉梅, 朱谨钊.对虾消化酶的研究[J].海洋科学,1984, 5: 46-50.
[11] 姜令绪, 潘鲁青, 肖国强.氨氮对凡纳对虾免疫指标的影响[J].中国水产科学, 2005, 11(6): 537-541.
[12] Li C C, Chen J C.The immune response of white shrimp Litopenaeus vannamei and its susceptibility toVibrio alginolyticusunder low and high pH stress[J].Fish & Shellfish Immunology, 2008, 25(6): 701-709.
[13] Tseng I T, Chen J C.The immune response of white shrimp Litopenaeus vannamei and its susceptibility toVibrio alginolyticusunder nitrite stress[J].Fish &Shellfish Immunology, 2004, 17(4): 325-333.
[14] Bachère E.Shrimp immunity and disease control[J].Aquaculture, 2000, 191(1): 3-11.
[15] 王芸, 李健, 李吉涛, 等.pH 胁迫对中国明对虾抗氧化系统酶活力及基因表达的影响[J].中国水产科学, 2011, 18(3): 556-564.
[16] Sarmadi B H, Ismail A.Antioxidative peptides from food proteins: a review[J].Peptides, 2010, 31(10):1949-1956.
[17] 徐海圣, 徐步进.甲壳动物细胞及体液免疫机理的研究进展[J].大连水产学院学报, 2001, 16(1): 49-56.
[18] Jiravanichpaisal P, Lee B L, Söderhäll K.Cell-mediated immunity in arthropods: hematopoiesis, coagulation,melanization and opsonization[J].Immunobiology,2006, 211(4): 213-236.
[19] Omar S S, Merrifield D L, Kühlwein H, et al.Biofuel derived yeast protein concentrate (YPC) as a novel feed ingredient in carp diets[J].Aquaculture, 2012, 330:54-62.
[20] Standen B, Rawling M, Davies S, et al.Probiotic Pediococcus acidilactici modulates both localised intestinal-and peripheral-immunity in tilapia (Oreochromis niloticus)[J].Fish & shellfish immunology, 2013, 35(4):1097-1104.
[21] Skalli A, Castillo M, Andree K B, et al.The LPS derived from the cell walls of the Gram-negative bacteria Pantoea agglomerans stimulates growth and immune status of rainbow trout (Oncorhynchus mykiss)juveniles[J].Aquaculture, 2013, 416: 272-279.
[22] 李光友.中国对虾疾病与免疫机制[J].海洋科学,1995, 4(1): 3.
[23] 丁美丽, 林林.有机污染对中国对虾体内外环境影响的研究[J].海洋与湖沼, 1997, 28(1): 7-12.
[24] Chen S-C, Yoshida T, Adams A, et al.Immune response of rainbow trout to extracellular products of Mycobacterium spp.[J].Journal of Aquatic Animal Health, 1996, 8(3): 216-222.
[25] Deng D, Mei C, Mai K, et al.Effects of a yeast based additive on growth and immune responses of white shrimp,Litopenaeus vannamei(Boone, 1931), and aquaculture environment[J].Aquaculture Research,2013, 44(9): 1348-1357.
[26] Destoumieux D, Bulet P, Loew D, et al.Penaeidins, a new family of antimicrobial peptides isolated from the shrimpPenaeus vannamei(Decapoda)[J].Journal of Biological Chemistry, 1997, 272(45): 28398-28406.
[27] Refstie S, Olli J J, Standal H.Feed intake, growth, and protein utilisation by post-smolt Atlantic salmon(Salmo salar) in response to graded levels of fish protein hydrolysate in the diet[J].Aquaculture, 2004,239(1): 331-349.
[28] Zheng K, Liang M, Yao H, et al.Effect of dietary fish protein hydrolysate on growth, feed utilization and IGF-I levels of Japanese flounder (Paralichthys olivaceus)[J].Aquaculture Nutrition, 2012, 18(3): 297-303.
[29] Nya E J, Austin B.Dietary modulation of digestive enzymes by the administration of feed additives to rainbow trout,Oncorhynchus mykissWalbaum[J].Aquaculture Nutrition, 2011, 17(2): e459-e466.
