中药复方糖痹康对糖尿病大鼠坐骨神经BDNF蛋白及BDNFmRNA表达的影响*
2015-04-11吕翠岩张胜容赵文景郑桂敏姜媛媛陈洋子刘铜华
吕翠岩,张胜容,赵文景,蔡 朕,郑桂敏,赵 静,王 晖,姜媛媛,陈洋子,刘铜华
(1.首都医科大学附属北京中医医院肾内科,北京 100010;2.北京中医药大学,北京 100029)
中药复方糖痹康对糖尿病大鼠坐骨神经BDNF蛋白及BDNFmRNA表达的影响*
吕翠岩1,2,张胜容1,赵文景1,蔡 朕1,郑桂敏1,赵 静1,王 晖1,姜媛媛1,陈洋子1,刘铜华2△
(1.首都医科大学附属北京中医医院肾内科,北京 100010;2.北京中医药大学,北京 100029)
目的:观察中药复方糖痹康对糖尿病大鼠坐骨神经脑源性神经生长因子(Brain-derived neurotrophic factor,BDNF)蛋白及BDNFmRNA表达的影响。方法:采用高脂饲料和小剂量链脲佐菌素(streptozotocin,STZ)诱发2型糖尿病大鼠动物模型,用不同剂量的糖痹康灌胃并与甲钴胺对照,16周后取大鼠一侧坐骨神经,用免疫组化法检测坐骨神经中BDNF蛋白的表达及采用RTPCR方法检测坐骨神经组织中BDNF mRNA的表达。结果:与正常组比较,模型组BDNF蛋白表达显著降低及BDNF mRNA表达显著降低;糖痹康组与模型组比较,能升高BDNF蛋白及BDNF mRNA表达。结论:中药复方糖痹康能够促进糖尿病周围神经病变大鼠坐骨神经BDNF mRNA的转录和蛋白的表达。
糖痹康;糖尿病;周围神经病变;坐骨神经;脑源性神经生长因子
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是目前常见的糖尿病并发症之一[1],也是导致糖尿病病人足溃疡最主要的原因。DPN发病机制十分复杂,非单一因素所致,目前尚未完全阐明,造成西医对其治疗存在一定的局限性和有效性,而中医对其治疗有多种有效手段,具有综合调节优势。刘铜华教授经过多年的临床研究,认为本病主要病机为“气阴不足,毒瘀神络”,并提出“益气养阴、解毒化瘀通络”的新治疗原则。中药复方糖痹康是在这一治则指导下,在传统经方黄芪桂枝五物汤(《金匮要略·血痹虚劳病脉证并治》)基础上,结合现代研究成果和临床经验创制的,先后经多年临床验证,不断优化处方,其组方及制备工艺已成功申报发明专利。为进一步探讨糖痹康防治DPN的作用机制,本研究在前期研究的基础上,选用SD大鼠,通过高脂饲料和小剂量STZ诱发2型糖尿病构建2型DPN动物模型[1],以观察糖痹康对糖尿病大鼠坐骨神经组织BDNF mRNA和蛋白表达的影响。
1 材料与方法
1.1 实验动物
选取SPF级SD雄性大鼠60只,体质量(160± 10)g,6周龄,购自北京维通利华动物实验中心(动物生产许可证号SCXK(京)2004-0009)。
1.2 材料及主要仪器
糖痹康(主药为黄芪、女贞子、桂枝、黄芩、黄连等)由北京中医药大学中药学院提供;甲钴胺片(国药准字H20030812)由卫材(中国)药业有限公司制造;高脂饲料购自北京华阜康生物科技有限公司; Trizol试剂盒购自Invitrogen公司;PCR引物为生工生物工程(上海)有限公司;M-MLV反转录试剂盒购自Takara公司;Real-time PCR扩增试剂盒购自北京泽平生物技术有限公司;Agarose购自Promega公司;DEPC购自Sigma公司;100bp DNA Ladder购自北京全式金生物技术有限公司;罗氏活力型血糖仪(ACCU-CHEK);7500型Real-Time PCR仪,美国ABI。
1.3 实验方法
1.3.1 模型建立及分组 动物适应性喂养1周后,随机选取10只为正常组,普通饲料喂养;其余喂养高脂饲料,8周后STZ造模,给予35 mg/kg腹腔内注射。72 h后用血糖仪测尾尖血糖,持续血糖水平≥16.7 mmol/L以上为造模成功,将造模成功的大鼠按随机数字表法分为模型组、甲钴胺组、糖痹康低、中、高剂量组各10只。
1.3.2 给药方法 造模成功且血糖稳定3 d后开始灌胃。糖痹康低、中、高剂量组分别按成人剂量5、10、20倍给药,即分别为生药的4.175 g/kg/d、8.35 g/kg/d、16.7g/kg/d。甲钴胺组按成人剂量10倍给药,即1.97 mg/kg/d。实验期间大鼠自由饮食饮水,连续给药16周。
1.3.3 指标检测及方法
①体质量、血糖检测:分别在给药前和给药后的4、8、12、16周末,禁食6 h,称其体质量及尾静脉取血测空腹血糖。
②组织病理学观察:16周末取2 cm左右大鼠坐骨神经,放入4%多聚甲醛(不含DEPC)固定,石蜡包埋,4 μm切片,做HE染色,光镜下观察坐骨神经组织病理学变化。
③免疫组织化学检测大鼠坐骨神经BDNF蛋白表达:16周末取2 cm左右大鼠坐骨神经,放入4%多聚甲醛(不含DEPC)固定,石蜡包埋,4 μm切片,采用SABC免疫组化法,一抗稀释比为1∶50,显色后中性树胶封片。
④实时荧光定量检测大鼠坐骨神经BDNFmRNA表达:一部分大鼠坐骨神经经DEPC溶液处理后置入液氮冻存,待测BDNFmRNA。BDNF引物序列:BDNF,上游引物:5'-CTGGATGAGGA CCAGAAGGT-3',下游引物:5'-CAGAAAGAGCAG AGGAGGCT-3',117bp;参照基因 GAPDH序列: GAPDH,上游引物:5'-CAACTCCCTCAAGATTG TCAGCAA-3',下游引物:5'-GGCATGGACTGTGGT CATGA-3',128 bp。首先,用Trizol提取获取大鼠坐骨神经组织总RNA,核酸紫外分光光度计测定经稀释RNA提取物的OD值和浓度,判断RNA纯度,计算RNA浓度。经25 μL反转录体系:RNA 3 μl,Oligo(dT)1 μl,dd H2O(DEPC处理)9.5 μl,以上首先70℃孵育5 min,然后迅速放在冰上。5XBuffer 5 μl,dNTP(10 mM)5 μl,Ribonuclease inhibitor 0.5 μl,M-MLV RT 1 μl。以上42℃孵育60 min,然后70℃ 10 min,将所得的cDNA与引物1(10 pmol/μl) 0.5 μl,引物2(10pmol/μl)0.5 μl,SYBR mix10 μl,dd H2O7.5 μl加入20 μL Real-Time PCR体系,94℃预变性2 min,94℃ 15 s,60℃ 60 s,40个循环,72℃ 10 min。
1.4 统计学方法
采用SPSS 16.0统计软件进行统计分析,数据以均数±标准差(±s)表示,2组以上组间比较采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
STZ注射72 h后,大鼠逐渐出现不同程度的采食量增加,尿量明显增多,消瘦,精神不振,体毛色泽枯黄,缺乏光泽,竖毛弓背,活动明显迟缓,反应迟钝等。后期还相继出现溃疡、白内障等糖尿病并发症,甲钴胺组和中药糖痹康各治疗以上情况组均有不同程度的改善。
2.2 体质量
表1显示,与正常组比较,干预8周、12周后,模型组大鼠体质量有所降低(P<0.05);干预16周后,模型组大鼠体质量显著降低(P<0.01)。与模型组比较,干预16周后,糖痹康低、中剂量及甲钴胺组体质量显著升高(P<0.01)。
表1 不同时间点各组大鼠体质量比较(±s,g)

表1 不同时间点各组大鼠体质量比较(±s,g)
注:与空白组比较:*P<0.05,**P<0.01;与模型组比较:##P<0.01
组 别 鼠数 干预前干预后4周 8周 12周 16周正 常 组 10 411.12±16.12 430.75±34.70 467.25±58.50 486.13±18.69 514.13±10.99模 型 组 10 435.40±15.23 425.60±15.07 414.55±32.77* 408.20±36.79* 354.80±24.96**甲 钴 胺 组 10 426.11±50.76 430.89±33.80 429.22±28.13 434.11±29.16* 466.33±30.55*##糖 痹 康 低 10 427.33±19.73 438.00±21.81 448.60±36.82 457.44±38.85 482.56±36.15##糖 痹 康 中 10 416.90±45.89 423.10±47.73 442.90±59.48 450.11±70.67 484.70±32.46##糖痹康高 10 409.89±56.39 427.56±48.35 429.00±63.20 445.33±65.47 447.77±79.96
2.3 血糖检测
表2显示,与正常组比较,干预前及干预后各时间点模型组大鼠血糖值均显著升高(P<0.01);经药物干预后,各组大鼠与模型组比较血糖值均有不同程度的下降,其中甲钴胺组(P<0.05)和糖痹康低剂量组(P<0.01)在干预16周后血糖值下降显著,糖痹康中、高剂量组在干预后各时间点血糖值下降均较为显著(P<0.05,P<0.01)。
表2 不同时间点各组大鼠血糖比较(mmol/L±s)

表2 不同时间点各组大鼠血糖比较(mmol/L±s)
注:与空白组比较:*P<0.05,**P<0.01;与模型组比较:#P<0.05,##P<0.01
组 别 鼠数 干预前干预后4周 8周 12周 16周正 常 组 10 5.72±0.48 5.88±0.83 6.09±0.32 6.28±0.51 6.45±0.46模 型 组 10 20.48±2.02** 22.16±1.65** 22.06±1.67** 22.47±1.04** 23.88±0.87**甲钴胺组 10 21.27±1.85** 21.03±1.79** 19.42±2.39** 20.29±2.19** 21.02±1.92**#糖痹康低 10 23.19±1.60** 21.28±0.92** 20.30±2.37** 20.36±2.41** 19.93±2.21**##糖痹康中 10 21.04±1.97** 19.42±2.40**## 16.97±1.82**# 16.33±1.78**# 15.94±1.78**##糖痹康高 10 21.59±1.26** 19.42±1.25**## 12.99±1.91**# 10.68±2.20**## 9.74±2.15*##
2.4 病理学检测
图1显示,正常组大鼠坐骨神经纤维结构紧密、分布均匀、排列整齐,可见半月形施万细胞,且其结构完整、髓鞘薄厚均匀、着色均匀粉染(图1A);模型组大鼠坐骨神经纤维排列疏松、间隙变大、多处发生变性及断裂,有髓神经纤维密度分布不均匀且显著减少,髓鞘变薄且着色不均匀,出现大量炎性病灶(图1B);与模型组比较,甲钴胺组大鼠坐骨神经变性与断裂显著减少,神经纤维结构紧密,但髓鞘仍较薄且着色不均匀,局部仍有炎症反应发生(图1C);而低剂量组、中剂量组及低剂量组与模型组比较显示,低剂量组与中剂量组大鼠坐骨神经纤维的变性与断裂显著减少,但结构仍较疏松,髓鞘也未发生显著变化,局部仍有炎症反应发生(图1D、E),而高剂量组大鼠坐骨神经纤维结构紧密、排列整齐,未见变性与断裂的发生,髓鞘变厚且着色均匀,炎性病灶相对减少(图1F)。
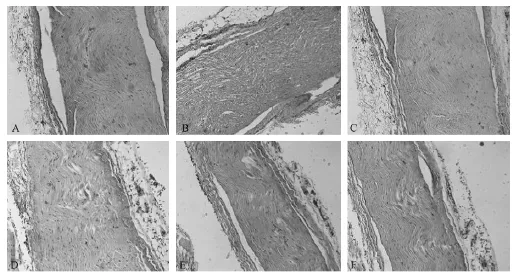
图1 大鼠坐骨神经石蜡切片HE染色光镜观察结果(×100)
2.5 糖痹康对大鼠坐骨神经组织BDNF蛋白及mRNA表达的影响
表3图2显示,BDNF主要分布于细胞浆中,其在正常大鼠的坐骨神经中呈强阳性表达(图2A);而与正常组比较,糖尿病模型大鼠坐骨神经中BDNF的表达显著降低(P<0.01,图2B);给予甲钴胺及糖痹康低、中、高剂量治疗后,与模型组比较,BDNF在坐骨神经中的含量均显著升高,呈强阳性表达(P<0.01,图2C、D、E、F);与正常组比较,模型组大鼠坐骨神经BDNFmRNA表达显著降低(P<0.01);甲钴胺组和糖痹康低、中、高剂量组BDNFmRNA的表达与模型组比较均显著升高(P<0.01)。
表3 大鼠坐骨神经石蜡切片BDNF蛋白及BDNFmRNA表达的变化(±s)

表3 大鼠坐骨神经石蜡切片BDNF蛋白及BDNFmRNA表达的变化(±s)
注:与空白组比较:**P<0.01;与模型组比较:##P<0.01
组别 例数 平均光密度值BDNFmRNA正 常 组6 126.61±28.65 0.92±0.18模 型 组 6 29.71±11.13** 0.23±0.06**甲 钴 胺 组 6 69.36±15.86## 0.49±0.12##糖 痹 康 低 6 79.47±16.94## 0.57±0.08##糖 痹 康 中 6 94.95± 3.73## 0.82±0.11##糖 痹 康 高 6 101.94± 7.21## 0.62±0.14##

图2 大鼠坐骨神经石蜡切片BDNF免疫组织化学染色光镜观察结果(×400)
3 讨论
神经营养因子(neurotrophic factor,NTF)是目前阐述DPN发病机制的一个主要学说。NTFs是机体产生的能够促进神经存活、生长、分化的一类蛋白因子,是由敏感神经元的靶组织释放,与特殊受体结合后,通过轴索逆向转运进入细胞体,具有减少神经变性、阻止疾病进程、刺激轴突生长、促进神经修复和再生功能。该学说认为,神经营养因子的合成、分泌和代谢障碍是DPN发病的重要原因[3]。
脑 源 性 神 经 营 养 因 子 (brain derived neurotrophic factor,BDNF)是NTFs家族中最具代表性的成员之一,同时与神经生长因子(NGF)有50%的同源性。BDNF由神经元细胞分泌,在体内以二聚体的形式存在,对神经元的生存、分化、生长和维持神经元的功能具有重要作用;而且在病理状态下,能抵抗神经元损伤,促进受损神经元修复,维持神经元的正常功效。BDNF能影响突触递质的分泌,对中枢和周围神经系统均有广泛作用[4]。研究证实,BDNF与神经系统功能紊乱有着密切的关系。研究报道,糖尿病大鼠脑组织和坐骨神经中的BDNFmRNA水平下降,同时研究发现与BDNF结合的TrKB受体和刺激BDNF产生的NGFmRNA在糖尿病大鼠中多明显减少[5-6]。国外文献报道,用外源性的BDNF治疗糖尿病db/db小鼠能明显减轻体质量和降低血糖[7]。Tolwani等[8]研究证实,BDNF一类的神经营养因子可以通过增加雪旺细胞的增殖和迁移速度,来促进外周神经髓鞘的形成。熊丽丽等[9]实验发现,高糖条件下,周围神经组织中的BDNF蛋白表达下降,减弱了受损神经纤维的修复能力。加味补肝汤可明显上调内源性BDNF蛋白的表达,其机制可能与营养神经组织,从而改善神经组织缺血缺氧和组织损伤有关,进而对DPN具有防治作用。
本实验研究结果显示,糖尿病大鼠坐骨神经BDNF蛋白及BDNFmRNA表达均显著下调,中药糖痹康可显著上调糖尿病大鼠坐骨神经BDNF蛋白及BDNFmRNA表达。由此我们推测,临床有效中药糖痹康对糖尿病周围神经病变的神经保护作用有可能与其上调大鼠坐骨神经中 BDNF蛋白及BDNFmRNA表达有关。
[1]吴晏,韩静,黄黎明,等.高脂喂养合并小剂量链脲佐菌素建立2型糖尿病大鼠模型[J].中国实验动物学报,2012,20(2):11-15.
[2]Vinik AI,Park TS,Stansberry KB,et al.Diabetic neuropathies[J].Diabetologia,2000,43(8):957–973.
[3]Vinik AI.Diabetic neuropathy:pathogenesis and therapy[J].Am J Med,1999,30:107(2B):175.
[4]Qi S,Zhan RZ,Wu C,et al.The effects of thiopental and propofol on cell swelling induced by oxygen/glucose cell layer of rat hippocampal slicers[J].Anesth Analg,2002,94(3):655-660.
[5]A.Nitta,R.Murai,N.Suzuki,et al.Diabetic neuropathies in brain are induced by deficiency of BDNF[J].Neurotoxicology and Teratology,2002,24:695-701.
[6]叶仁群,陈泽奇,贺钰磊,等.加味补肝汤对糖尿病大鼠坐骨神经NGF表达的影响[J].北京中医药大学学报,2007,30 (2):90-94.
[7]A Tsuchida,T Nonomura,M Ono-Kishino.Acute effects of brainderived neurotrophic factor on energy expenditure in obese diabetic mice[J].Obesity,2001,25(9):1286-1293.
[8]Tolwani RJ,Cosgaya JM,Varma S,et al.BDNF over-expression produces a long-term increase in myelin formation in the peripheral nervous system[J].J Neurosci Res,2004,77:662-669.
[9]熊丽丽,陈泽奇,黄娟,等.加味补肝汤对糖尿病大鼠坐骨神经脑源性神经生长因子表达的影响[J].中国中医药信息杂志,2008,15(12):42-44.
Effects of Chinese herbal compound Tangbikang on expression of BDNF protein and BDNFmRNA in sciatic nerve in diabetic rats
LCui-Yan1,2,ZHANG Sheng-Rong1,ZHAO Wen-jing1,CAI Zhen1,ZHENG Gui-min1,ZHAO Jing1,WANG Hui1,JIANG Yuan-yuan1,CHEN Yang-zi1,LIU Tong-Hua2△
(1.Department of Nephrology,Beijing Hospital of Traditional Chinese Medicine Affiliated to Capital Medical University,Beijing 100010;2.Beijing University of Chinese Medicine,Beijing 100029)
Objective:To explore the effect of Chinese herbal compound Tangbikang on the expressions of BDNF protein and BDNF mRNA of diabetic rats'sciatic nerve.Methods:The experimental diabetes mellitus rats model were induced by feeding high fat forage and injection streptozotocin.Tangbikang groups were given Tangbikang with different dose,rats unilaterals sciatic nerve were cutting-up after 16 weeks,immunohistochemical method was used to detect the expressions of BDNF protein of sciatic nerve,and the expressions of BDNFmRNA were detected by semi-quantitative RTPCR,and compared with mecobalamine group.Results:The expressions of BDNF protein and BDNFmRNA of model group were significantly decreased compared with normal group,Tangbikang group significantly increased the expressions of BDNfprotein and BDNFmRNA.Conclusion:Chinese herbal compound Tangbikang could promote the expressions of BDNFprotein and BDNFmRNA of diabetic peripheral neuropathy rats’sciatic nerve
Tangbikang;Diabetes mellitus;Peripheral neuropathy;Sciatic nerve; Brain-derived neurotrophic factor
R871.6+4
B
1006-3250(2015)02-0168-04
2014-11-11
国家重大新药创制项目(2012ZX09102201-001);教育部博士点基金立项课题(20110013130001);北京中医药大学创新团队项目(2011-CXTD-19);教育部中医养生学重点实验室资助项目;北京市中医养生学重点实验室资助项目
吕翠岩,女,副主任医师,医学博士,从事中医药防治肾病、糖尿病及并发症的临床与作用机制研究。
△通讯作者:刘铜华,教授,主任医师,博士研究生导师,Tel: 010-64286642,E-mail:thliu@tom.com。
