双补汤对环磷酰胺诱导弱精子症小鼠精子运动障碍的影响及作用机制研究*
2015-04-11武宜婷
武宜婷,姜 淼,孙 洁,杨 进
(南京中医药大学,南京 210029)
双补汤对环磷酰胺诱导弱精子症小鼠精子运动障碍的影响及作用机制研究*
武宜婷,姜 淼,孙 洁,杨 进△
(南京中医药大学,南京 210029)
目的:研究双补汤对环磷酰胺诱导弱精子症小鼠精子运动障碍的改善作用并初步探讨其作用机制。方法:将50只雄性昆明小鼠按随机数字表法分为对照组、模型组、氯米酚组、低剂量组及高剂量组。采用环磷酰胺腹腔注射制备弱精子症小鼠模型,以计算机辅助精液分析仪进行常规分析,分别以Western blot及Real time-PCR检测精子中SEPT4的蛋白及mRNA表达。结果:环磷酰胺明显下调小鼠精子运动参数,而2种剂量均可提高运动参数,但高剂量组优于低剂量组;另外环磷酰胺下调小鼠精子SEPT4蛋白及mRNA表达,而高剂量及低剂量组显著升高,此外氯米酚组与高剂量组较低剂量组明显上升。结论:双补汤明显改善环磷酰胺诱导弱精子症小鼠精子运动障碍,其作用可能与上调SEPT4有关。
双补汤;环磷酰胺;SEPT4蛋白;弱精子症
近年来不孕不育的发病率显著上升,调查显示约15%夫妻受到不孕不育的困扰,而男性因素已占50%以上[1]。随着研究的深入,在造成男性不育的病因中,弱精子症逐渐受到重视,且其病因病机尚未完全阐明,现代医学也缺乏可靠的治疗手段,而临床中以双补汤为代表的中医药在治疗该病中显现出独特的疗效。本实验以小鼠腹腔注射环磷酰胺制备弱精子症模型,研究双补汤对弱精子症的改善作用,并进一步探讨其可能机制。
1 材料
1.1 动物与分组
清洁级雄性昆明小鼠50只(南京中医药大学动物实验中心提供),体质量18 g~22 g,按随机数字表法分为对照组、模型组、氯米酚(阳性药物)组、双补汤低剂量组及高剂量组5组各10只。
1.2 药物与主要试剂
按颗粒剂与生药等效剂量换算,双补汤颗粒剂量:五味子0.83 g,山药0.75 g,莲子、覆盆子、茯苓及补骨脂各1 g,肉苁蓉、巴戟天及党参各3 g,山茱萸2.5 g,菟丝子及芡实各0.5 g(购自江苏省中医院),实验前配成水溶液。环磷酰胺(江苏恒瑞医药股份有限公司,批号H32020856),氯米酚(塞浦路斯高特制药有限公司,批号Batch:E0105),Bww高蛋白获能液(南京医科大学生殖中心提供),Trizol reagent(美国 Invitrogen公司),PrimeScript RT reagent kit(大连Takara公司),兔抗小鼠SEPT-4抗体及兔抗小鼠GAPDH抗体(美国Santa cruz公司),HRP羊抗兔二抗(丹麦Dako公司),1×PBS液、细胞裂解液及苯甲基磺酰氟(PMSF)购自南京生兴生物技术公司。
1.3 主要仪器
恒温水浴箱(美国PolyScience公司),Sorvall低温离心机(美国 Biofuge stratos公司),Multiskan Spectrum Microplate酶标仪(德国Thermo公司),计算机辅助精液分析系统 CASA(美国 Hamilton Thorne Bioscience公司),PCR仪(美国BIO-RAD公司),Dolphin-Doc凝胶成像系统(美国 Wealtec公司),ZF型紫外透射反射分析仪(上海嘉鹏有限公司),电泳仪(美国BIO-RAD公司)。
2 方法
2.1 动物模型制备
实验小鼠适应性驯养5 d后,对照组按(0.06 g ·kg-1)腹腔注射生理盐水,模型组、氯米酚组、低剂量组及高剂量组按0.06 g·kg-1腹腔注射环磷酰胺,每天1次,连续5 d,第6天起按体质量给低剂量组及高剂量组灌服双补汤,剂量分别为人常规用量的1倍和5倍,即2.35 g·kg-1及11.75 g·kg-1,氯米酚组小鼠按0.0065 g·kg-1灌服氯米酚溶液,模型组小鼠给予等体积双蒸水灌胃,每天1次,连续灌服34 d,对照组常规饲养[2]。灌胃期间,每周小鼠称重1次,灌胃第34天将实验小鼠脱颈处死。
2.2 小鼠精子的采集
小鼠断颈处死后迅速剥离附睾、输精管,去除周围的脂肪、筋膜等组织,置于装有500 μL Bww获能液的离心管中,并用眼科剪剪碎,放入37℃水浴锅中温浴30 min,待精子充分游离后,滤纸过滤多余组织,保留上清。
2.3 计算机辅助精液分析
吸取10 μL上清液于精子计数板上,利用计算机辅助精液分析仪选取5个视野对精子进行常规分析,相关运动参数为VAP(平均速度)、VSL(直线速度)、VCL(曲线速度)、ALH(侧摆幅度)、BCF(鞭打频率)、LIN(直线性)和STR(前向性)。
2.4 Real time-PCR法检测小鼠精子中SEPT4 mRNA表达
每0.1 g精子加入1 ml Trizol,冰上裂解10 min,匀浆后加入1/5体积氯仿剧烈振荡摇匀,冰上静置10 min,4℃离心12000 g×15 min。取上清400 ul移至另一EP管,加入等体积异丙醇摇匀,冰上放置10 min,4℃离心12000 g×15 min弃上清,加1 ml 75%乙醇洗涤沉淀,4℃离心12000 g×5 min弃上清,将沉淀(即RNA)风干后溶于DEPC水备用。将RNA逆转录为cDNA,根据PCR反应体系以PCR仪获得PCR产物,引物序列如下:SEPT4上游:5’-CCAGACTGTGATTCCGATGA-3’, 下 游: 5’-TGTTGCGATTCCGTTCCT-3’;GAPDH上游:5’-TGAGGCCGGTGCTGAGTATGT-3’, 下 游 5’-CAGTCTTCTGGGTGGCAGTGAT-3’。PCR产物经1.5%琼脂糖凝胶电泳、溴化乙啶染色后,在凝胶影像分析仪上成像,并对条带进行分析。
2.5 Western blot法检测小鼠精子中SEPT4蛋白表达
以1×PBS洗涤精子上清液3次,即4℃离心12000 g×5 min。将纯化的精子重悬于细胞裂解液,按1∶100加入PMSF,匀浆置冰上30 min。再4℃离心12000 g×5 min,取上清即为精子总蛋白。蛋白定量并配制10%SDS-PAGE电泳凝胶,60 V恒压40 min浓缩蛋白后120 V电泳90 min,恒压100 V 120 min将蛋白转移至聚偏氟乙烯膜(polyvinylidenedifluoride,PVDF),5%脱脂牛奶37℃封闭1 h,TBS-T 洗10 min×3次;加以稀释的一抗兔抗小鼠SEPT4抗体(1∶1000)或者兔抗小鼠 GAPDH抗体(1∶1000),4℃过夜。用TBS-T洗膜10 min×3次,加入含5%脱脂牛奶1∶5000稀释的HRP标记二抗,37℃摇动孵育2 h。TBS-T洗膜10 min×3次,加ECL发光显色,以Image J软件对条带密度进行处理并计算平均密度值。
2.6 统计学方法
使用SPSS 16.0软件进行统计分析,计量资料以均数±标准差(±s)表示,对正态分布数据进行单因素方差分析,P<0.05、P<0.01为差异有统计学意义。
3 结果
3.1 环磷酰胺对小鼠体质量的影响
图1显示,注射环磷酰胺后,3 d内小鼠体质量未见明显变化;第5天至第34天与对照组比较,模型组、氯米酚组、双补汤低剂量组及高剂量组小鼠体质量均明显减轻(P<0.01);第40天高剂量组与对照组比较差异无统计学意义,其他各组差异有统计学意义(P<0.01),说明环磷酰胺可降低小鼠体质量。
3.2 双补汤对弱精子症小鼠精子运动功能的影响
表1显示,与对照组比较,模型组小鼠精子VAP、VSL、VCL、ALH、BCF、LIN显著降低(P<0.01),STR降低(P<0.05);与模型组比较,低剂量组VAP、VSL显著上升(P<0.01),而STR及LIN上升(P<0.05),高剂量组 VAP、VSL、VCL、ALH、BCF、STR及LIN均显著升高(P<0.01),氯米酚组VAP、VSL、VCL显著上升(P<0.01),ALH、BCF、STR及LIN均升高(P<0.05);与低剂量组比较,高剂量组VAP、ALH显著升高(P<0.01),VSL、VCL、BCF、STR及LIN升高(P<0.05),氯米酚组VAP、VCL显著上升(P<0.01),ALH升高(P<0.05);与高剂量组比较,氯米酚组STR降低(P<0.05),显示高剂量双补汤治疗效果与氯米酚相当,但优于低剂量组。
表1 各组小鼠计算机辅助精液分析结果(±s)
注:与对照组比较:*P<0.05,**P<0.01;与模型组比较:△P<0.05,△△P<0.01;与低剂量组比较:#P<0.05;##P<0.01;与高剂量组比较:▲P<0.05
组 别 VAP/(um/s) VSL/(um/s) VCL/(um/s) ALH(um) BCF(Hz) STR(%) LIN(%)对 照 组 142.57±15.76 100.73±8.07 208.26±16.31 7.96±0.84 15.63±3.49 74.3±9.15 50.5±6.31模 型 组 70.14±17.55**74.40±8.00**150.64±26.34**5.04±2.04**9.50±2.44**56.1±12.07*31.0±6.39**低剂量组 105.09±16.49△△93.74±14.46△△171.31±22.44 5.40±1.33 11.16±3.77 72.1±14.29△38.1±7.98△高剂量组 125.37±14.54△△##106.99±9.99△△#191.79±16.57△△##7.57±1.04△△##15.62±3.68△△##85.9±8.44△△#48.1±11.52△△#氯米酚组 126.51±21.01△△##97.22±17.24△△189.11±27.11△△##7.04±1.45△#13.25±4.37△71.8±13.55△▲41.2±12.02△
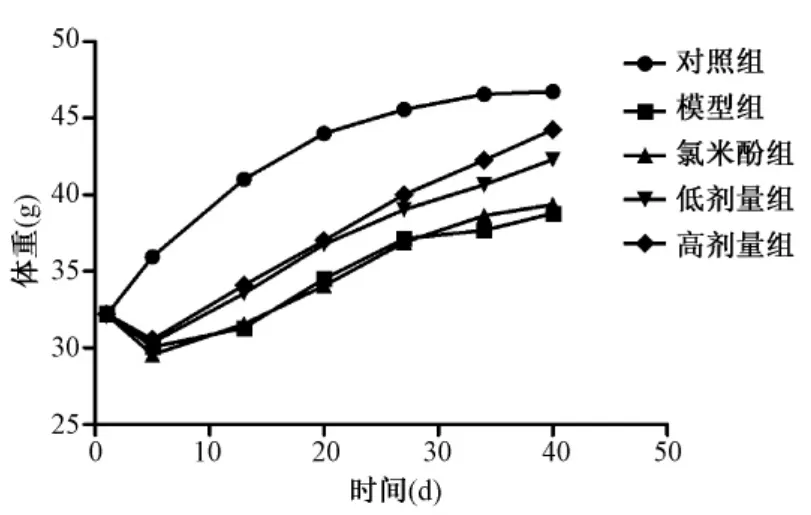
图1 各组小鼠体质量变化趋势图
3.3 双补汤对小鼠精子中SEPT4 mRNA表达的影响
图2显示,与对照组比较,模型组 SEPT4 mRNA水平显著下降(P<0.01),而氯米酚组及高剂量组较模型组显著升高(P<0.01),低剂量组亦明显升高(P<0.05)。此外,氯米酚组与高剂量组SEPT4 mRNA水平较低剂量组明显上升(P<0.01),显示双补汤可上调小鼠精子中 SEPT4 mRNA表达。
3.4 双补汤对小鼠精子中SEPT4蛋白表达的影响
图3显示,与对照组比较,模型组SEPT4蛋白水平显著下降(P<0.01),而氯米酚组、低剂量组及高剂量组较模型组显著升高(P<0.01)。此外,氯米酚组与高剂量组SEPT4蛋白水平较低剂量组明显上升(P<0.01),证实双补汤可上调小鼠精子中SEPT4蛋白表达。
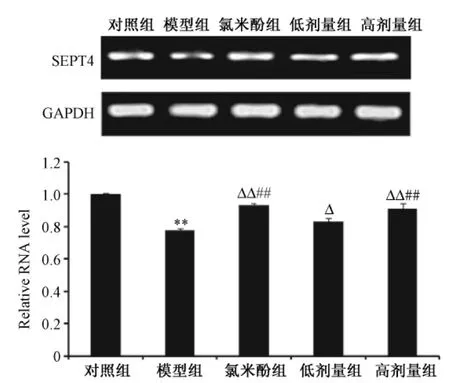
图2 Real time-PCR检测各组SEPT4mRNA表达水平

图3 Western blot检测各组SEPT4蛋白表达水平
4 讨论
本实验首次证实,双补汤可改善环磷酰胺诱导的弱精子症模型小鼠精子的运动功能,并进一步发现其可能通过上调SEPT4而发挥保护作用。
弱精子症定义为精液参数中前向运动的精子(a级和b级)小于50%或a级运动的精子小于25%[3]。研究显示,81%男性不育患者与精子运动障碍有关,而其中约20%与精子活力低下密切相关[4],因此用药物改善精子运动障碍逐渐成为研究的热点。环磷酰胺为烷化剂类抗肿瘤药物,具有显著的免疫抑制作用[5]。研究显示,雄性小鼠注射环磷酰胺后,体质量明显下降,并出现精子活力下降和数量减少[6]。另外有报道,男性癌症患者经环磷酰胺治疗后,弱精子症的发病率显著上升[7]。本研究中,环磷酰胺处理后,小鼠精神萎靡、食欲减退,出现体质量下降,显示出明显的毒副作用。同时造成生殖系统毒性,小鼠睾丸萎缩,精液分析各项指标明显下降,引起精子运动功能障碍,表现为弱精子症。而经不同剂量双补汤治疗后,精子运动参数显著上升,高剂量组效果明显优于低剂量组,进一步提高精子运动参数,显示双补汤可改善环磷酰胺造成的精子运动功能障碍,并提高精子活力,提示双补汤对弱精子症具有明显的治疗作用。
弱精子症的发病机制目前仍未完全阐明。近来研究显示,Septins蛋白家族异常与男性不育密切相关[8]。Septins为GTP结合蛋白,主要参与细胞分裂、细胞骨架形成和细胞膜重塑[9]。现已明确,Septins家族成员中,SEPT1、SEPT4、SEPT6、SEPT7、SEPT12存在于人类及小鼠精子的环状带中[10]。研究认为,SEPT4蛋白失活在弱精子症的发病中发挥了重要作用。Ihara[11]等证实,敲除SEPT4基因的雄性小鼠发生不育,精子鞭毛出现结构缺陷,表现为精子活力下降、精子环状带被脆弱且缺乏皮质的组织取代。另有研究发现,在SEPT4基因突变的小鼠中,其精子的顶体和线粒体出现结构异常[12]。本实验结果显示,双补汤治疗后明显上调环磷酰胺诱导的SEPT4 mRNA和蛋白水平,且高剂量组高于低剂量组,与精液分析结果一致,说明双补汤的治疗作用以SEPT4为靶点,高剂量效果更佳,SEPT4激活后提高精子活力,从而改善其运动障碍,但双补汤通过上调SEPT4而发挥保护作用的具体机制仍需进一步研究。
弱精子症属于中医学“精冷”、“无子”、“艰嗣”、“虚劳”等范畴。肾为先天之本,藏精主生殖,脾为后天之本,气血生化之源。脾阳受损,易生寒湿,损伤肾阳;肾阳不足,温煦失司,损伤脾阳,而脾肾阳虚可致男性不育,影响精子的活力及运动功能。双补汤出自吴鞠通《温病条辨》,以人参、山药、茯苓、莲子、芡实甘温而淡者补脾渗湿,其中莲子、芡实为水中之谷,补土而不克水,又以补骨脂、肉苁蓉、巴戟天、菟丝子、覆盆子、山萸肉、五味子升补肾脏阴中之阳,兼能益精气安五脏,该方可双补脾肾之阳气,用于弱精子症,使脾阳充足则气血生化有源、精血同源,可填补真精,肾阳充足则可促进精子的生发,最终提高精子的活力并改善其运动功能,是治疗不育的良方。
综上所述,本研究证实低剂量和高剂量双补汤均可通过上调SEPT4蛋白改善精子的运动功能障碍,其中以高剂量组最佳,显示双补汤可能成为临床治疗弱精子症不育患者的潜在药物,并为治疗弱精子症提供了新的思路和理论依据。
[1] World Health Organization.WHO Manual for the Standardised Investigation and Diagnosisofthe Infertile Couple[M].Cambridge:Cambridge University press,2000:18.
[2] 罗少波,胡海翔,贾金铭.益精方对环磷酰胺小鼠少弱精症模型精子凋亡的干预作用[J].北京中医药大学学报,2011,34 (2):119-130.
[3] World Health Organization.Laboratory manual of the WHO for examination ofhuman semen and semen-cervicalmucus interaction[J].Ann Ist Super Sanita,2001,37(1):I-XII,1-123.
[4] Curi SM,Ariagno JI,Chenlo PH,et al.Asthenozoospermia: analysis of a large population[J].Arch Androl,2003,49(5): 343-349.
[5] Rafiul Haque M,Ansari SH,Rashikh A.Coffea arabica Seed Extract Stimulate the Cellular Immune Function and Cyclophosphamide-induced Immunosuppression in Mice[J].Iran J Pharm Res,2013,12(1):101-108.
[6] Elangovan N,Chiou TJ,Tzeng WF,et al.Cyclophosphamide treatment causes impairment of sperm and its fertilizing ability in mice[J].Toxicology,2006,222(1-2):60-70.
[7] Wang YN,Wang B,Liang M,et al.Down-regulation of CatSper1 channel in epididymal spermatozoa contributes to the pathogenesis of asthenozoospermia,whereas up-regulation of the channel by Sheng-Jing-San treatment improves the sperm motility of asthenozoospermia in rats[J].Fertil Steril,2013,99(2): 579-587.
[8] Sugino Y,Ichioka K,Soda T,et al.Septins as diagnostic markers for a subset of human asthenozoospermia[J].J Urol,2008,180(6):2706-2709.
[9] Weirich CS,Erzberger JP,Barral Y.The septin family of GTPases:architecture and dynamics[J].Nat Rev Mol Cell Biol,2008,9(6):478-489.
[10] Steels JD,Estey MP,Froese CD,et al.Sept12 is a component ofthe mammalian sperm tailannulus[J]. CellMotil Cytoskeleton,2007,64(10):794-807.
[11] Ihara M,Kinoshita A,Yamada S,et al.Cortical organization by the septin cytoskeleton is essential for structural and mechanical integrity of mammalian spermatozoa[J].Dev Cell,2005,8(3): 343-352.
[12] Kissel H,Georgescu MM,Larisch S,et al.The Sept4 septin locus is required for sperm terminal differentiation in mice[J].Dev Cell,2005,8(3):353-364.
Research on the Effect and Mechanism of Shuangbu Decoction on Sperm Motility Disorder of Cyclophosphamide induced Asthenospermia Mouse Model
WU Yi-ting,JIANG Miao,SUN Jie,YANG Jin△
(Nanjing University of Chinese Medicine,Nanjing 210029,China)
Objective:To investigate the improvement of Shuangbu Decoction on sperm motility disorder of cyclophosphamide(CTX)induced asthenospermia mouse model and to explore the underlying mechanism.Methods:Male Kunming mice(n=50)were randomly divided into the control group(CG),model group(MG),Clomphid group (CLG),small-dose group(SG)and large-dose group(LG).MG,CLG,SG and LG were given the intraperitoneal injection of CTX to make the asthenospermia mouse model.The seminal fluid was analyzed by computer assisted semen analysis(CASA),the protein and mRNA levels of SEPT4 in the sperms were detected by western blot and Real time-PCR,respectively.Results:CTX treatment decreased the sperm movement parameters of MG.However,the sperm movement parameters of LG and SG were significantly increased,compared with SG,the sperm movement parameters of LG was increased.CTX treatment decreased the expression levels of SEPT4 protein and mRNA of MG.Compared with MG,the expression levels of SEPT4 protein and mRNA of SG and LG were significantly increased.The expression levels of SEPT4 protein and mRNA of CLG and LG were higher than SG.Conclusion:Shuangbu Decoction could improve sperm motility disorder of CTX-induced asthenospermia mouse model through increasing the expression level of SEPT4 protein.
Shuangbu Decoction;Cyclophosphamide;SEPT4 protein;Asthenospermia
R285.5
B
1006-3250(2015)03-0298-04
2014-12-16
江苏高校优势学科建设工程资助项目(苏政办发[2011]6号)
武宜婷(1987-),女,江苏连云港人,医学硕士,从事温病治法的临床应用与研究。
△通讯作者:杨 进(1944-),男,教授,博士研究生导师,从事温病治法的临床 应 用,Tel:13951743550,E-mail: 13951743550@163.com。
