基于rDNA-ITS 序列的天门冬拟茎点霉与相似种的系统发育关系
2015-04-02卢松茂陈振东林秀香郑少缘余智城
卢松茂, 陈振东, 林秀香, 郑少缘, 余智城
(福建省热带作物科学研究所,福建 漳州363001)
芦笋(Asparagus officinalis L.)又名石刁柏,素有“蔬菜之王”的美称,富含多种氨基酸、蛋白质、维生素及人体所需的微量元素等[1]。中国已成为世界上生产和出口芦笋数量最大的国家[2]。芦笋茎枯病(Asparagus stem blight)是芦笋的一种毁灭性病害,其病原菌最初由Saccardo[3]命名为天门冬茎点霉(Phoma asparagi),而后Bubak[4]将其更正为天门冬拟茎点霉(Phomopsis asparagi),并一直沿用到现在。当前,P. asparagi 在国内外的芦笋产区均有发生危害,国内主要分布在福建、山东、海南、山西、河南、台湾等省[5-7],国外主要分布在美国、欧洲、澳大利亚、意大利、新西兰、希腊等国家[8-10]。在发病严重的地区发病率达100%[11-12],病情指数达50 ~70[13],导致芦笋植株整株干枯,严重影响芦笋的品质和产量。
核糖体DNA 内转录间隔区(rDNA-ITS)序列是介于18S rDNA、5.8S rDNA 和28S rDNA 之间的区域,该区域进化速度较编码区快,在种内不同菌株间高度保守,而在真菌的种间存在着丰富的变化[14-15]。rDNA-ITS 序列测定和比对为大量生物的系统发育和亲缘关系的鉴定提供了有价值的参考,己被广泛应用于亲缘关系较近分类群的系统发育研究[16]。Murali 等[17]利用rDNA-ITS 序列分析结果表明寄生在柚木上的内生菌Phomopsis 存在多个不同的组群。Kanematsu 等[18]从形态特征观察和ITS 序列分析认为寄生在蔷薇科果树上的Phomopsis 与P.asparagi 在分子系统发育上存在差异。目前,尚未见基于rDNA-ITS 序列对P. asparagi 与寄生在其他蔬菜、果树和经济林木上的Phomopsis 菌株进行系统发育分析的研究报道。本研究对分离自福建漳州不同地区的3 个P. asparagi 菌株的ITS 序列进行测定,并对P. asparagi 菌株与GenBank 中登录的寄生在其他蔬菜、果树和经济林木上的19 个种的拟茎点霉菌株的ITS 序列(共35 条)进行多序列比对分析,以进一步揭示P. asparagi 与拟茎点霉属其他重要种的系统发育关系,为P. asparagi 的分子鉴定及其分子进化关系研究提供理论依据。
1 材料与方法
1.1 供试菌株
于2010 ~2013 年,在福建省东山县芦笋产区和福建省热带作物科学研究所内芦笋试验地采集具有芦笋茎枯病典型症状的茎秆组织,采用常规组织分离法[19]对病斑上的病菌进行分离和纯化,并参照卢松茂等[20]方法进行形态特征鉴定和致病性测定,获得3 个Phomopsis asparagi 菌株(PDL、PQW、PWF),在恒温培养箱中25 ℃、12 h 光暗交替条件下用燕麦培养基(OA)培养7 d,备用。
1.2 菌丝体的收集及基因组DNA 的提取
将已在燕麦培养基(OA)上25 ℃条件下生长7 d 的3 个Phomopsis asparagi 菌株(PDL、PQW、PWF)菌落边缘分别切取直径为5 mm 的菌饼,接种至装有100 ml 马铃薯葡萄糖液体培养基(PD)的三角瓶上,每瓶接3 块菌饼,在25 ℃、120 r/min条件下振荡培养7 d。用纱布过滤菌液,获得菌丝置于无菌的滤纸上吸去水分,55 ℃下烘30 min。采用十二烷基硫酸钠(SDS)法提取基因组DNA[21]。
1.3 PCR 扩增及测序
利用真菌ITS 通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和下游引物ITS4 (5'-TCCTCCGCTTATTGATATGC-3')扩增病菌rDNA-ITS 序列。PCR 反应体系组成成分为:10 × Buffer(含MgCl2)2.5 μl,dNTP(2.5 mmol/L)0.5 μl,ITS1 和ITS4(10 μmol/L)各1.5 μl,Taq(5 U/μl)0.2 μl,模板DNA 1 μl,ddH2O 17.8 μl。PCR 反应程序为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,30 个循环;72 ℃延伸10 min。PCR 产物用质量分数1%的琼脂糖凝胶电泳检测,将条带清晰的PCR 扩增产物送上海生工双向测序。
1.4 供试菌株ITS 序列分析
将供试菌株PDL、PQW、PWF 的ITS 序列分别与GenBank 中核酸数据库进行BLAST 分析,比较同源性。用Clustal X、SeqMan 等软件分析供试菌株PDL、PQW、PWF 与已发表的P. asparagi 菌株(GenBank 登录号:JQ070363)的核糖体DNA-ITS序列差异,分析其5.8S 及其侧翼的ITS 区的变异情况。
1.5 基于ITS 序列构建系统发育树
将供试菌株(PDL、PQW、PWF)及来自GenBank登录的寄生在其他蔬菜、果树、经济林木等上的35个拟茎点霉菌株(表1)的ITS 序列用Clustal X 软件进行多序列比对分析,并用MEGA5.0 软件的Neighbor-Joining 法构建系统发育树,Bootstrap 检验1 000次。

表1 35 个拟茎点霉菌株及来源Table 1 35 Phomopsis strains and their sources
2 结果与分析
2.1 供试菌株核糖体ITS 序列分析
分别以提取的PDL、PQW 和PWF 菌株基因组DNA 为模板,用真菌通用引物ITS1 和ITS4 进行PCR 扩增,产物经电泳后均得到大小约为600 bp 的DNA 片段(图1)。上海生工双向测序结果显示,PDL、PQW 和PWF 菌株的片段大小与预测的较为一致,它们的ITS 序列长度分别为585 bp、585 bp、587 bp。将PDL、PQW 和PWF 菌株的ITS 序列提交至NCBI 后,获取登录号分别为KJ801804、KJ801805、KJ801806。三者的ITS1-5.8S-ITS2 序列的一致性达100%,其中rDNA-ITS1 全长为173 bp,5.8S 全长为159 bp,rDNA-ITS2 全长为160 bp。它们与P. asparagi 菌株Pa1100(GenBank 登录号:JQ070363)ITS1-5.8S-ITS2 序列的同源性达99. 8%,仅在rDNA-ITS2 有1 个碱基的差异,由碱基A→G 单碱基转换。由此说明P. asparagi 同种内的不同个体之间的ITS 序列是非常保守的。
2.2 基于ITS 序列的拟茎点霉菌株的系统发育分析
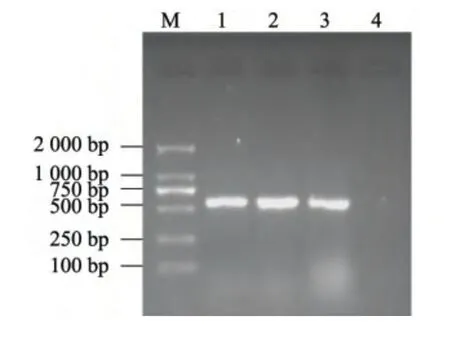
图1 3 株P. asparagi 菌株的PCR 产物电泳图Fig.1 Electrophoretogram of PCR products of three strains of P. asparagi
将35 个拟茎点霉菌株的ITS 序列进行多序列比对分析,采用Neighbor-Joining 法构建了系统发育树,结果(图2)显示,35 个菌株被划分为Ⅰ、Ⅱ和Ⅲ组群,且除Diaporthe sojae、Phomopsis longicolla、P. mali 和P. castaneae 外,同一组群的不同种分别聚在不同的分支上,表明寄生在蔬菜、水果和经济林木等植物上的拟茎点霉之间的ITS 序列存在一定差异。其中,P. asparagi与寄生葡萄的P. viticola、马尾松的P. phyllanthicola、杨桃的P. averrhoae、芒果的Diaporthe phaseolorum 等菌株聚在I 组群的A 亚群,它们之间的ITS 序列差异小,表明它们之间的亲缘关系近,但又存在一定分化;Ⅰ组群B 亚群的拟茎点霉(P. ternstroemia、P. azadirachtae、P.mali、P. castaneae、P. perniciosa、P. fukushii)及C 亚群的拟茎点霉(P. longanae)与P. asparagi 的亲缘关系次之;寄生在葫芦、黄瓜、野生大豆、大豆、茄子和柑橘等植物上的拟茎点霉分别聚在Ⅱ组群的A 和B 亚群,该组群的菌株与P. asparagi 的ITS 序列差异较大,它们之间的亲缘关系较远;而单独聚在Ⅲ组群的寄生草莓的P. obscurans 菌株与P. asparagi 的ITS 序列差异最大,表明它们之间的亲缘关系最远。

图2 基于P. asparagi 及其近似种的rDAN-ITS 序列构建的系统发育树Fig.2 Phylogenetic tree of P. asparagi and related speices based on their rDAN-ITS sequences
3 讨论
拟茎点霉属真菌已描述有400 多个种[22],主要为植物致病菌、植物内生菌或腐生菌,甚至危害人和动物[23],其分类主要依据形态特征、培养特征和寄主范围[24],但其分子进化关系尚不十分清楚。rDNA-ITS 序列已广泛应用于真菌的分子鉴定、亲缘关系分析及系统发育研究。陈永青等[25]采用rDNAITS 序列分析法对寄生在木棉、发财树、榴莲、番石榴、芒果、杨梅、柚等植物上的拟茎点霉属7 个种15个菌株进行了系统发育分析,但未涉及P. asparagi。杨迎青等[7]对河北、江西、海南、山东和福建等5 省区的天门冬拟茎点霉的形态特征及ITS 序列进行分析,证实了P. asparagi 存在地域差异,但未研究P.asparagi 与近似种如P. viticola、P. longicolla、P. obscurans、P. vexans、P. fukushii 等的分子进化关系。本研究探明了P. asparagi 与寄生在蔬菜、水果和经济林木等植物上的拟茎点霉属重要种的系统发育关系,为P. asparagi 的分子鉴定及亲缘关系分析提供一定的理论参考。
杨迎青等[7]研究认为P. asparagi(JQ619526)与P. phyllanthicola(JN107737)聚在一起,且支持率达92%,它们的亲缘关系最近,而本研究结果显示,P. asparagi (KJ801804、KJ801805、KJ8018046、JQ070363)与P. phyllanthicola(JN107737)不聚在同一分支上,这可能与不同的P.asparagi 菌株有关。
系统发育树显示,寄生红豆杉的P. mali(KF574900)菌 株 与 寄 生 板 栗 的 P. castaneae(JF957786)菌株聚在同一分支上,且自展支持率为100%,表明它们的ITS 序列差异小,推测为异名同物,但有待对它们的形态特征进行分析验证。同时,寄生大豆的P. longicolla(无性态)菌株和寄生野生大豆的Diaporthe sojae(有性态)菌株也聚在同一分支上,且自展支持率为100%,这与Gomes 等[23]报道它们属于同1 个种是一致的。Zhang 等[26]认为尽管序列有相似之处,但P. longicolla 与Diaporthe sojae 为不同的种,这可能与不同的分离菌株(P.longicolla 和Diaporthe sojae)存在差异有关。
本研究中用于分析的拟茎点霉菌株的ITS 序列有3 个为自测序列,其余大部分为已发表文献中的ITS 序列,这为数据分析的准确性及代表性提供重要基础,但它们的形态特征及生物学特性等差异有待进一步的比较分析。
[1] 陈 罡,管安琴,卢昱宇,等.盐胁迫对不同基因型芦笋萌发的影响及盐碱地育苗技术[J].江苏农业科学,2014,42(8):136-138.
[2] ZHANG Y P,CHEN G G,LUO S C,et al. Stress physiology and virulence characterization of Phomopsis asparagi (Sacc.)bubak isolated from asparagus in Jiangxi province of China[J]. Aricultural Science & Technology,2012,13(7):1502-1508.
[3] SACCARDO P A. Fungi veneti novi vel critici vel mycologiae venetae addendi[J]. Seriei VIII. Michelia,1878,1:239-275.
[4] BUBAK F. Zweiter beitrag zur pilzflora von montenegro[J]. Bull Herb Boissier Ser,1906,2(6):393-408.
[5] 郑元梅,陈福如,陈赛云,等.芦笋茎枯病的研究Ⅰ,症状,侵染期及侵菌源[J].江西植保,1987 (1):7-10.
[6] 王元珪,王述彬.芦笋茎枯病的初步研究[J].江苏农业科学,1988(3):30-31.
[7] 杨迎青,李湘民,孟 凡,等.芦笋茎枯病菌的鉴定及区域差异性分析[J].植物保护学报,2012,39(4):315-320.
[8] 张岳平,瞿华香,罗绍春,等. 一些重要作物拟茎点霉属病原生物学及致病机制研究概况[J]. 中国农学通报,2013,29(33):327-332.
[9] ELENA K. First report of Phomopsis asparagi causing stem blight of asparagus in Greece[J]. Plant Pathology,2006,55(2):300.
[10] DAVIS R D. Asparagus stem blight recorded in Australia[J].Australasian Plant Pathology,2001,30(2):181-182.
[11] 路广明.芦笋茎枯病的症状及防治方法[J]. 蔬菜,2001(9):26.
[12] 林添发. 芦笋茎枯病的预测预报[J]. 福建农业科技,2001(4):27.
[13] 苗华民,侯绪友,盂凡明,等.芦笋茎枯病病原菌及其生物学研究[J]. 植物保护学报,1991,18(1):87-90.
[14] 陈庆和,翁启勇,王源超,等.福建省大豆疫病病原鉴定及其核糖体DNA-ITS 序列分析[J].植物病理学报,2004,34(2):112-116.
[15] 胡中会,赵立华,严恩平,等.云南烟草赤星病菌及近似种rDNA-ITS 序列分析[J]. 云南农业大学学报,2012,27(5):670-676.
[16] 楼兵干,张炳欣. 基于rDNA ITS 序列探讨部分腐霉种的系统发育与其形态特征[J].菌物学报,2005,24(2):207-220.
[17] MURALI T S,SURYANARAYANAN T S,GEETA R. Endophytic Phomopsis species:host range and implications for diversity estimates[J]. Canadian Journal of Microbiology,2006,52(7):673-680.
[18] KANEMATSU S,MINAKA N,KOBAYASHI T,et al. Molecular phylogenetic analysis of ribosomal DNA internal transcribed spacer regions and comparison of fertility in Phomopsis isolates from fruit trees[J]. Journal of General Plant Pathology,2000,66(3):191-201.
[19] 方中达. 植病研究方法[M]. 3 版. 北京:中国农业出版社,1998.
[20] 卢松茂,罗金水,李丽容. 芦笋茎枯病菌鉴定及寄主范围研究[J].福建热作科技,2010,35(3):4-6.
[21] 罗金水,张汉荣,卢松茂,等.琯溪蜜柚黑斑病菌分离鉴定及其致病性测定[J].福建热作科技,2011,36(4):1-5.
[22] 陆家云.植物病原真菌学[M].北京:中国农业出版社,2001.
[23] GOMES R R,GLIENKE C,VIDEIRA S I R,et al. Diaporthe:a genus of endophytic,saprobic and plant pathogenic fungi[J]. Persoonia:Molecular Phylogeny and Evolution of Fungi,2013,31:1-41.
[24] UDAYANGA D,LIU X,MCKENZIE E H C,et al. The genus Phomopsis:biology,applications,species concepts and names of common phytopathogens[J]. Fungal Diversity,2011,50(1):189-225.
[25] 陈永青,姜子德,戚佩坤.RAPD 分析与ITS 序列分析在拟茎点霉分类鉴定上的应用[J].菌物系统,2002,21(1):39-46.
[26] ZHANG A W,RICCIONI L,PEDERSEN W L,et al. Molecular identification and phylogenetic grouping of Diaporthe phaseolorum and Phomopsis longicolla isolates from soybean[J]. Phytopathology,1998,88(12):1306-1314.
