可见光条件下Hg 掺杂ZnS 光催化降解有毒有机污染物
2015-04-01詹东平黄笛王攀蔡宽顾彦
詹东平,黄笛,王攀,蔡宽,顾彦
(1.厦门大学 化学化工学院,福建 厦门 361005;2.三峡大学 三峡库区生态环境教育部工程研究中心,湖北 宜昌 443002)
与纳米TiO2相似,II-VI 半导体ZnS 在紫外光(λ <380 nm)激发下能高效产生光生空穴-电子对及其较负的激发电子还原电势,作为一类光催化材料,广泛应用于光催化还原水制氢及降解水体中有毒有机污染物[1]。然而,ZnS 在光激发作用中具有不良的光腐蚀现象,影响其实际应用。另外,其仅仅能被紫外光激发,受到光能源(如太阳光)应用的限制[2]。因此,开发具有稳定的掺杂或复合可见光光催化活性的催化剂,提高太阳光的利用率,延长IIVI 半导体在光催化中的使用寿命,具有很好的研究意义。
众多具有可见光活性的复合ZnS 光催化剂已见文献报道,如CuInS2-ZnS、AgInS2-CuInS2-ZnS 等复合型可见光ZnS 催化剂[3]及Ni 掺杂ZnS[4],Cu 掺杂ZnS[5]、Cd 与Cu 共掺杂ZnS 及Pb 与卤离子共掺杂ZnS 等[6-7],因为金属掺杂而改变光催化剂的激发带隙,其ZnS 金属掺杂光催化剂可以有效促进可见光的利用,并提高光催化剂的活性。作为重金属汞元素,因为其存在环境毒害问题,在掺杂或复合光催化材料的制备中,报道较少,由于Hg 元素能明显提高半导体空间电荷分离效率[8],有助于光催化过程中的空穴电子的相对稳定,提高光催化活性,同时HgS具备小的Ksp 和较窄的激发带隙0.5 eV[9],能提高催化剂稳定性和调节其光激发带隙[10],并且通过掺杂亦可以抑制ZnS 光腐蚀。为此研究稳定汞掺杂ZnS 光催化剂,并建立可见光激发,汞不释放于水体环境的光催化降解有毒有机污染物体系,具有一定的理论研究意义和实际应用价值。
本文采用沉淀法制备不同量Hg 掺杂ZnS(HgXZn1-XS),并以罗丹明B(RhB)及2,4-二氯苯酚(2,4-DCP)为目标污染物进行光催化反应的特性研究,通过循环及汞释放试验,探讨光催化剂的稳定性。通过紫外-可见光谱(UV-Vis)、红外光谱(FTIR)和总有机碳(TOC)的测定,研究其在可见光激发下的光催化降解有毒有机污染物的催化活性。利用荧光法对氧化过程中的氧化物种·OH 进行跟踪,研究其氧化机理。
1 实验部分
1.1 试剂与仪器
RhB、2,4-DCP、N,N-二乙基对苯二胺(DPD)、辣根过氧化物酶(POD)、苯甲酸(BA)、Zn(AcO)2、HgCl2、NaS2·9H2O 等均为分析纯;二次蒸馏水。
H27500 型透射电子显微镜;D/max2500 型XRD 仪;Lambda 25 紫外-可见光分光计;Multilab 2000 X-射线光电子能谱仪;F24500 荧光仪;N/C 2100 TOC 分析仪;FTIR 红外光谱仪。
1.2 Hg 掺杂Hg-ZnS 的制备
将浓度为0.1 mol/L Zn(AcO)2与含量分别为0%,3%,5%,7% 及10% 的HgCl2混合,加入到0.1 mol/L的Na2S 溶液中,边加边搅拌。反应过程中随掺杂量的不同,沉淀由无色变至灰黄色,滴加完毕后继续搅拌4 h。过滤、水洗、乙醇洗数次后于80 ℃干燥12 h,得具有不同Hg 掺杂量(nHg/nCd+Hg)的ZnS 粉末HgXZn1-XS,依据加入HgCl2的量的不同,催化剂记为ZnS、C0.03、C0.05、C0.07及C0.1。
1.3 可见光光催化降解RhB
可见光光催化实验装置见图1。将500 W 的碘钨灯光源安装于一端开口的圆柱形的冷凝石英玻璃套管中,一个截止型滤光片(5 cm × 5 cm,λ >420 nm)放在石英套管的外面,过滤掉420 nm 以下的光,以保证其光反应在可见光条件下进行。在70 mL的硬质玻璃瓶中加入1 mL 0.5 mmol/L 的RhB 溶液,30 mg的HgXZn1-XS。用HClO4及NaOH调节pH(pH=6.8),定容至50 mL,置于暗箱反应1 h,达到吸附平衡后加光,于适当的时间间隔取样3 mL 离心去上清液,用Lambda 25 UV/vis Spectrometer 测定其吸光度值A。用N/C 2100 分析仪测TOC 值。用红外分光光度计跟踪其中间产物(TOC及IR 测定催化剂采用C0.07)。

图1 光催化装置图Fig.1 Photocatalytic reaction equipment
1.4 光催化反应过程氧化物种测定
1.4.1 H2O2含量的检测[11]于比色管中依次加入30 μL 的DPD、150 μL 的POD、1 mL 的磷酸二氢钾-氢氧化钠缓冲溶液(pH 6.9)、2 mL 的光催化反应试液,定容至5 mL,显色一段时间后于505 nm 处测定其吸光度,根据标准曲线来计算可见光体系中H2O2的含量。
1.4.2 ·OH 含量测定[12]在反应过程中,定时取1 mL 的光催化试液加入到装有1 mL 0.01 mol/L 的苯甲酸溶液中,定容到5 mL,离心。离心液采用荧光光谱进行分析,激发光波长294 nm,发射波长400 nm,狭缝宽度10 nm。
1.4.3 光催化反应过程Hg 的测定[13]于25 mL容量瓶中,加 入2.0 mL 1.0 μg/mL 汞(II )标准溶液(不同光催化反应时间试样),0.6 mL l.0 mol/L HCl,加水至9.5 mL,加入2.7 mL 1% KSCN,摇匀放置5 min。再加入1.l mL 1% 明胶,1.15 mL 2.0 mmol/L罗丹明B,用水稀释至刻度,摇匀放置10 min。在Lambda 25 UV/vis Spectromete 上,用1 cm比色皿,于596 nm 处,以试剂空白作参比,测量吸光度,依据工作曲线计算Hg 的含量。
1.5 2,4-DCP 光催化降解
于70 mL 圆柱形硬质石英瓶中加入5.0 mL 2,4-DCP 溶液(0.8 mol/L),30 mg C0.07(或ZnS 催化剂作为对照),用NaOH 和HClO4调pH 至7.00,定容至50 mL,置于暗室、搅拌30 min,以达到吸附-解吸平衡后加光(λ >420 nm)。计时并开始反应,于不同时间间隔取样,根据文献[14]用4-安基安替比林(4-AAP)比色法跟踪2,4-DCP 光催化反应过程中其浓度的变化。
2 结果与讨论
2.1 催化剂的表征
2.1.1 XRD 物相分析 Hg 掺量ZnS (HgXZn1-XS)催化剂的XRD 见图2。

图2 HgXZn1-XS 及ZnS 的XRD 图Fig.2 XRD spectrum of HgXZn1-XS and ZnS a.ZnS;b.C0.03;c.C0.05;d.C0.07;e.C0.1
由图2 可知,2θ =28.57°(111)、47.63°(200)、56.49°(311)是四方晶型ZnS(JCPDS No.05-0566)衍射峰[15],随着掺杂量的增加,ZnS 的衍射峰变钝,并且ZnS 的晶型并未因Hg 的掺杂而发生改变,也未发现HgS 晶型的存在。根据Scherrer 公式L =0.89λ/(βcosθ)计算,随着Hg 掺杂量从0% ~10%的增加,ZnS 的晶粒分别为19.10,23.44,15.52,15.19,22.35 nm,在一定程度上,Hg 的掺杂使ZnS的晶粒度减小,可能原因是由于HgS 的溶度积较小,在较低浓度下就形成HgS 晶核,导致晶核的形成速度较快,不利于晶粒的生长,从而使晶粒度较小[16]。故Hg 的掺入改变了ZnS 晶粒的生长,从而改变了其晶粒度。
2.1.2 HgXZn1-XS 的XPS 分析 图3A 为未掺杂ZnS 的XPS 图谱,其中S 的2p 轨道的结合能为161.77 eV,Zn 的2p3/2 和2p1/2 的结合能分别为1 021.57,1 044.62 eV。图3B 为Hg 掺杂量为7%时C0.07的XPS 图谱,其中S 的2p 轨道的结合能为162.22 eV,Zn 的2p3/2 和2p1/2 的结合能分别为1 021.91,1 044.96 eV,Hg 的4f7 和4f5 的结合能分别为100.68,104.77 eV,Hg4d 的结合能为359.65,378.70 eV。可知Hg 掺杂ZnS,导致S 的结合能增加0.55 eV,Zn 的结合能增加了0.65 eV,表明Hg掺杂使ZnS 各元素电子云密度发生改变,使S 的电子云密度降低,Zn 的电子云密度增加。而Hg 的结合能较文献[17]HgS 中Hg 的结合能99.35,103.4 eV均有一定程度的升高,其原因也是Hg 与S 键合后电子云密度升高所致。同时根据XPS 数据可知,掺杂Hg 7%条件下,掺杂Hg 元素所占金属百分数约为3.5%。综上所述,Hg 掺杂导致了ZnS 内部的电子云密度分布发生改变,最终使其光催化活性发生改变。
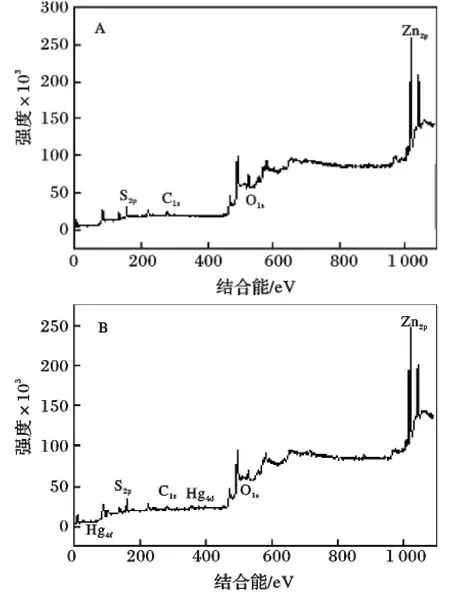
图3 HgXZn1-XS 及ZnS 的XPS 图Fig.3 XPS spectrum of doped(B)and nondoped ZnS(A)A.ZnS;B.HgXZn1-XS
2.1.3 TEM 分析 图4 为ZnS 与C0.07的TEM 图谱。

图4 ZnS 与C0.07 TEM 图Fig.4 TEM graph of ZnS and optimal C0.07 A.ZnS;B.C0.07
由图4 可知,ZnS 的晶粒度较最佳掺杂条件下C0.07的晶粒度大,与XRD 的结果相一致。ZnS 及C0.07的BET 分析表明,Hg 掺杂7%时的比表面积为242.1 m2/g,比未掺杂时的比表面积211.8 m2/g 高约30 m2/g,比表面积的增大有利于有机物与催化位点的结合,进而提高催化剂的光催化活性[18]。
2.1.4 紫外-可见漫反射吸收光谱分析 图5 为不同掺杂量的HgXZn1-XS 的紫外-可见漫反射吸收光谱。

图5 HgXZn1-XS 的紫外-可见漫反射吸收光谱Fig.5 UDR spectrum of different Hg amounts of doped ZnS
由图5 可知,当掺Hg 量在一定范围内(X =nHg/nZn+Hg≤0.1)逐渐增大时,催化剂在400 ~700 nm的可见光区域的吸收程度也逐渐增大,这表明Hg 掺杂改变了ZnS 带隙,降低了其对光响应的阈值。ZnS 属于直接跃迁型半导体,其吸收带边的吸光度满足A=C(hγ-Eg)1/2/ hγ(A 为吸光度,h 为Plank 常数,γ 为入射光频率,Eg为禁带宽度,C 为比例系数),其带隙随掺杂量的增加而减小[19],其Eg分别为3.25,3.15,2.92,2.75,2.58 eV,比未掺杂的体相ZnS 的带隙3.6 eV[20]要小,使其对光的吸收由紫外区逐渐红移到了可见光区,赋予了其可见光光催化降解活性。
2.2 可见光下RhB 的降解动力学曲线
2.2.1 Hg 掺杂量对光催化降解活性的影响 图6为Hg 掺杂量对HgXZn1-XS 光催化降解RhB 活性的影响。

图6 HgXZn1-XS 可见光降解RhB 的动力学曲线及C0.07降解RhB 全扫描Fig.6 Degradation dynamic curve and temporal absorption spectral changes of RhB by different Hg amounts of doped ZnS
由图6 可知,在RhB 可见光的光催化降解体系中,C0.07光催化降解速度最快。催化剂光催化降解活性与半导体的能带带隙有很大的关系,带隙越窄,在一定程度上的光催化降解能力也越强,但结合图5 发现,C0.1的能带带隙比C0.07小,然而其可见光降解效率较C0.07低,其原因可能是在光催化降解过程中,光催化降解的效率与催化剂对光的响应度及光生空穴电子利用率两方面有关,虽然C0.1对光的响应度增加了,但其光生空穴的复合几率也增加了[21],对光生空穴利用率降低了,而C0.07则综合了对光的响应范围宽和光生空穴电子不易复合的有利因素,其光生空穴电子对的利用效率最高,故其可见光催化降解效率最高,后续实验采用催化剂均为C0.07。
2.2.2 催化剂用量对催化活性的影响 图7 为催化剂用量在可见光下的光催化降解动力学曲线。
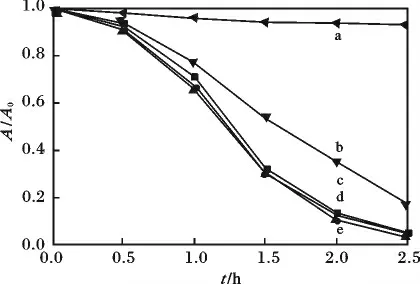
图7 催化剂用量的影响Fig.7 Influence of optimal dosage for catalyzer
由图7 可知,催化剂用量为30 mg 时,表现出最高催化降解活性。在暗反应时,3 h 染料的褪色率不足5%,表明催化剂在暗反应条件下表现为对染料的吸附,光反应阶段表现为光催化降解,随着催化剂用量的变化,其催化活性表现出先增大后减小的趋势,其原因可能是由于催化剂用量较高时,催化剂对光子的吸收已经达到饱和状态,同时过量的催化剂会阻碍可见光的作用效率,从而影响催化氧化反应速率[22]。
2.3 RhB 光催化降解产物红外光谱分析
在Vis/C0.07/RhB 体系下,对RhB 降解产物进行了红外光谱跟踪分析,结果见图8。

图8 C0.07可见光催化降解RhB 的红外分析图Fig.8 IR spectrum of the intermediates during the degradation of RhB by C0.07
由图8 可知,RhB 原始红外光谱(曲线a)中的1 589,1 340,1 125 cm-1吸收峰分别归属为RhB 分子骨 架、Ar—N 和 C—CH3伸 缩 振 动,1 445,1 079 cm-1吸收分别归属为氨碳键(N—CH3)、醚键(C—O—C)的伸缩振动,600 ~900 cm-1处的几个小峰为苯环不同取代部位的特征吸收峰[23]。随着反应的进行4 h(曲线b),890,1 079,1 340,1 445,1 590 cm-1的吸收峰最先消失,表明其—N(C2H5)2最先被氧化,并伴随着C—O—C 的消失,RhB 环断裂。1 589 cm-1处吸收峰发生蓝移,并在1 640 cm-1处出现一宽峰,其可能为在反应过程中生成—NO2吸收峰。在614 cm-1处出现苯环的取代吸收峰,表明苯环上的取代基数目减少。反应12 h(曲线c)后,1 125 cm-1处的峰形逐渐变小,其为对芳香环的氧化,但氧化较为缓慢。在光催化反应30 h(曲线d),614 cm-1处的吸收峰消失,表明苯环上的取代基团被彻底氧化。最后在1 650 cm-1呈现的吸收峰归属于硝基(—NO2)的伸缩振动吸收,在1 000 ~1 080 cm-1处的一宽峰对应为O—N—C 和C—O—C 等的弯曲振动吸收。可知,催化剂在可见光下将RhB 氧化为含硝基类和羧酸类物质,对芳香环也具有较好的降解效果,光催化氧化较彻底。
2.4 RhB 光催化降解TOC 测定
图9 为C0.07可见光催化降解RhB 的TOC 分析图。

图9 RhB 的TOC 测定Fig.9 TOC determination of RhB
由图9 可知,暗反应条件下(曲线a),RhB 不氧化矿化,但可见光催化反应能够有效矿化RhB(曲线b),光催化反应30 h 其矿化率为39.5%。
2.5 光催化降解RhB 氧化物种的跟踪分析
2.5.1 H2O2含量测定 图10 为光催化降解体系中H2O2含量变化。
由图10 可知,在可见光催化条件下,ZnS(曲线b)和C0.07(曲线a)光催化降解RhB 反应体系过程中均有H2O2产生,而暗反应(曲线c)几乎没有H2O2产生;在光催化前一时间段H2O2相对含量呈现上升的趋势,且C0.07相对含量要高于ZnS 催化剂。在整个光催化降解过程中,HgXZn1-XS 催化剂的H2O2的相对含量始终要高于未掺杂ZnS,辅证了其具备较高催化降解活性的原因。

图10 H2O2 含量变化Fig.10 Transformation of H2O2 for the RhB/HgXZn1-XS system under visible light irradiation
2.5.2 ·OH 的检测 图11 为C0.07与ZnS 在可见光降解RhB 时·OH 含量的相对变化。

图11 ·OH 含量变化Fig.11 Transformation of hydroxy radical for the RhB/HgXZn1-XS system under visible light irradiation
由图11 可知,在暗反应条件下(曲线c),几乎没检测到·OH 的信号;在可见光激发下,·OH 的含量变化与H2O2浓度及RhB 降解动力学变化趋同,表明光催化降解RhB 涉及并趋同相关于光催化反应过程中氧化物种H2O2及·OH 的变化和转化。ZnS 体系(曲线b),其光催化对可见光没有响应,体系中的·OH 信号仅为染料敏化导致[24]。
2.5.3 光催化反应过程的稳定性 在70 mL 的硬质玻璃瓶中加入1 mL 0.5 mmol/L 的RhB 溶液,30 mg C0.07。用HClO4及NaOH 调 节pH(pH =6.8),定容至50 mL,置于暗箱反应2 h,达到吸附平衡后加光,于适当的时间间隔取样3 mL 离心去上清液,直至溶液变无色,用Lambda 25 UV/Vis Spectrometer 测定其吸光度值A。再在该试管中加入1 mL 0.5 mmol/L 的RhB 溶液,加光,重复实验5次,结果见图12。
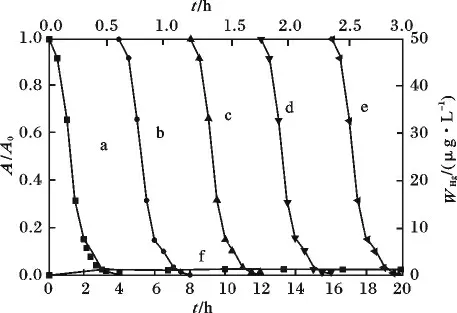
图12 C0.07降解RhB 重复实验及光催化降解RhB时Hg 离解实验Fig.12 Catalyst recycling in the system of C0.07/RhB and disassociation of mercury
由图12 可知,在连续的5 个循环(a ~e),C0.07呈现很好的稳定性,跟踪经过一个循环过程测定本体溶液中Hg 离子的变化。表明其光催化过程,Hg几乎没有离解,说明掺杂光催化试剂具有很好的稳定性,实际利用可以避免带来二次污染。
2.6 2,4-DCP 的降解
图13 为在可见光照射下,C0.07与ZnS 催化剂降解2,4-DCP 的动力学曲线。
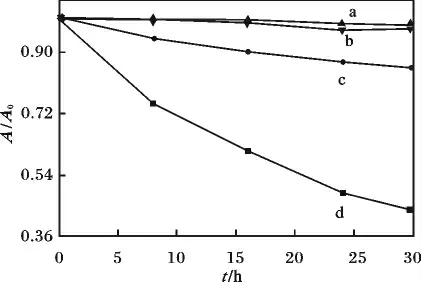
图13 2,4-DCP 的降解动力学Fig.13 Photo-degradation of 2,4-DCP under different conditions
由图13 可知,C0.07(曲线d)在可见光光照30 h,降解率达到54.6%,ZnS (曲线c)降解率仅为14.4%,暗反应均没有降解,表明C0.07能大大提高可见光光催化降解2,4-DCP 的能力。
3 结论
利用沉淀法合成了HgXZn1-XS,与未掺杂ZnS 相比,其具有可见光光催化活性,并且有良好的稳定性,光催化循环反应中,几乎不离解汞元素。可见光条件下,其对有毒有机染料及小分子有较好的催化氧化矿化能力,氧化过程中涉及H2O2及·OH 过程,其氧化机理可能涉及·OH 机理。
[1] Hu J S,Ren L L,Guo Y G,et al.Mass production and high photocatalytic activity of ZnS nanoporous nanoparticles[J].Angew Chem Int Ed,2005,44:1269-1273.
[2] Dunstan D E,Hagfeldt A,Almgren M,et al.Importance of surface reactions in the photochemistry of zincsulfide colloids[J].The Journal of Physical Chemistry,1990,94(17):6797-6804.
[3] Labiadh H,Chaabane T B,Balan L,et al.Preparation of Cu-doped ZnS QDs/TiO2nanocomposites with highphotocatalytic activity[J].Applied Catalysis B:Environmental,2014,144:29-35.
[4] Kudo A,Sekizawa M.Photocatalytic H2evolution under visible light irradiation on Ni-doped ZnS photocatalyst[J].Chem Commun,2000(15):1371-1372.
[5] Poormohammadi Z A,Yangjeh H,Pirhashemi M.Ultrasonic-assisted method for preparation of Cu-doped ZnS nanoparticles in water as a highly efficient visible light photocatalyst[J].Phys Chem Res,2014,2(1):76-89.
[6] Liu G J,Zhao L,Ma L J,et al.Photocatalytic H2evolution under visible light irradiation on a novel CdxCuyZn1-x-yS catalyst[J].Catalysis Communications,2008(9):126-130.
[7] Tsuji I,Kud A.H2evolution from aqueous sulfite solutions under visible-light irradiation over Pb and halogen-codoped ZnS photocatalysts[J].Journal of Photochemistry and Photobiology A:Chemistry,2003,15:6249-6252.
[8] Braun M,Link S,Burda C,et al.Transfer times of electrons and holes across the interface in CdS/HgS/CdS quantum dot quantum well nanoparticles[J].Chemical Physics Letters,2002,361(5/6):446-452.
[9] Chakaraborty I,Mitra D,Moulik S P.Spectroscopic studies on nanodispersions of CdS,HgS,their core-shells and composites prepared in micellar medium[J].J Nanopart Res,2005,7:228-236.
[10]Sameer S,Mishra D,Singh K.Electrodeposition of (ZnSe:colloidal HgS)composite and their photoelectrochemical characterization[J].Solar Energy Materials and Solar Cells,2009,93(8):1202-1207.
[11] Huang Y,Li J,Ma W,et al.Efficient H2O2oxidation of organic pollutants catalyzed by supported iron sulfophenylporphyrin under visible light irradiation[J].J Phys Chem B,2004,108(22):7263-7271.
[12]邓安平,杨静,黄应平,等.混晶纳米TiO2的制备及其光催化降解有毒有机污染物[J].环境科学,2010,31(12):2965-2972.
[13]李士和,李生泉,凌凤香.Hg(II)-SCN--罗丹明B 超高灵敏显色体系的研究[J].分析实验室,1991,10(5):14-16.
[14]邓安平,黄应平,方艳芬,等.TiO2纳米管的制备和光催化降解有毒有机污染物[J].环境化学,2009,28(2):202-205.
[15] Panda S K,Datta A,Chaudhuri S.Nearly monodispersed ZnS nanospheres:Synthesis and optical properties[J].Chemical Physics Letters,2007,440:235-238.
[16]张慧宁,王德举,唐颐,等.低温水热合成超微NaY 沸石[J].日用化学工业,2004,34(4):226-228.
[17]Zeng J H,Yang J,Qian Y T.A novel morphology controllable preparation method to HgS[J].Materials Research Bulletin,2001,36:343-348.
[18] He C X,Tian B Z,Zhang J L.Thermally stable SiO2-doped mesoporous anatase TiO2with large surface area and excellent photocatalytic activity[J].Journal of Colloid and Interface Science,2010,344(2):382-389.
[19]张霞,赵岩,张彩碚.TiO2-Fe2O3核-壳粒子的制备及光学性能[J].材料研究学报,2005,19(4):343-348.
[20]Denzler D,Olschewski M,Sattler K.Luminesc-ence studies of localized gap states in colloidal ZnS nanocrystals[J].J Appl Phys,1998,84:2841-2845.
[21] Wang C Y,Bottcher C,Detlef W,et al.A comparative study of nanometer sized Fe(III)-doped TiO2-photocatalysts:synthesis,characterization and activity[J].J Mater Chem,2003,13(9):2322-2329.
[22]Halma M,Dias K A,Castro D F,et al.Synthesis,characterization,and catalytic activity of anionic iron(III)porphyrins intercalated into layered double hydroxides[J].Journal of Catalysis,2008,257:233-243.
[23] 陈燕,黄应平,潘家荣,等.正/反相胶束法制备纳米TiO2及其光催化降解有毒有机污染物[J].纳米科技,2009,6(1):41-47.
[24]Cheng M M,Ma W H,Huang Y P,et al.Visible light-assisted degradation of dye pollutants over fe(III)-loaded resin in the presence of H2O2at neutral pH values[J].Environ Sci Technol,2004,38:1569-1575.
