离子强度、阴阳离子和腐殖酸对纳米零价铁去除溶液中U(Ⅵ)的影响
2015-03-26李小燕刘义保刘云海
李小燕,张 明,刘义保,李 寻,杨 波,花 榕,刘云海
(东华理工大学 核工程与地球物理学院 核资源与环境省部共建国家重点实验室培育基地,南昌 330013)
铀是一种具有放射性的稀有金属,也是国防事业和核电产业非常重要的战略性资源[1]。环境中的铀以难溶性的U(Ⅳ)和水溶性的U(Ⅵ)为主,多数U(Ⅵ)化合物易溶、易迁移、毒性大,在水溶液中 U(Ⅵ)多以铀酰离子()的形式,常与 OH-、等形成阴离子配合物。多数U(IV)化合物难溶、难迁移、毒性小,常以难溶物UO2形式存在,因此,将U(Ⅵ)还原为U(IV)并以难溶物UO2形式固定下来,是一种理想的去除U(Ⅵ)的途径[2]。零价铁(Fe0)是近年来国际上受到较多关注的水污染修复方法之一,零价铁廉价易得,环境友好,可通过吸附、还原沉淀等机理去除水中多种污染物质[3-4]。用零价铁还原去除U(Ⅵ)已有不少的报道,对其去除反应机理也有详细阐述[5-6]。但近几年的研究表明:纳米零价铁(nZVI)颗粒不仅具有零价铁的特性,而且比普通零价铁具有更大的比表面积、更高的反应活性及更强的吸附性,故在地下水和土壤原位修复中的应用成为研究的热点[7]。纳米零价铁作为一种新型材料是当今研究的前沿领域,有着广阔的应用前景,目前的研究大部分都集中在纳米零价铁去除铀的机理研究,而对离子强度、阴阳离子和腐殖酸对纳米零价铁去除溶液中 U(Ⅵ)的影响的研究还鲜见报道。本文作者的前期研究结果表明,纳米零价铁对溶液中 U(Ⅵ)有较好的去除作用,对U(Ⅵ)的还原过程符合准一级反应动力学[8]。本文作者在前期研究工作基础上,进一步研究离子强度、共存阴阳离子和腐殖酸对纳米零价铁去除 U(Ⅵ)效果的影响,为其实际应用提供更有力的依据。
1 实验
1.1 试剂与材料
硝酸、氢氧化钠、高氯酸钠、氯化钠、氯化钾、氯化钙、氯化镁、硫酸钠、碳酸钠、磷酸氢二钠、偶氮胂Ⅲ、硼氢化钾、三氯化铁、无水乙醇、2-4-二硝基酚、乙酸、乙酸钠等均为分析纯,腐殖酸,试剂均购自国药集团化学试剂有限公司。
铀储备液配制:用化学纯八氧化三铀配制浓度为1000 mg/L的铀标准溶液,将该溶液稀释后进行实验。
纳米零价铁制备参照文献[9]:在氮气保护下,将等体积的0.25 mol/L KBH4溶液在磁力搅拌下缓慢加入到0.05 mol/L Fe3+的醇水溶液(水与乙醇体积比9:1)中,磁力搅拌一定时间后,用磁选法选出,将得到的纳米零价铁依次用去离子水洗涤3次后,在65 ℃真空干燥箱中烘干备用。反应方程式为
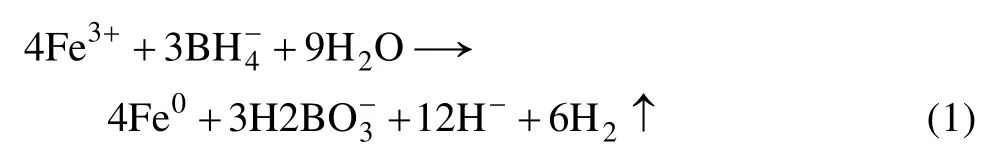
1.2 分析测试仪器
722型分光光度计(浙江托普仪器有限公司生产);THZ82A 型恒温水浴振荡器(江苏金坛仪器厂生产);pHS3C型酸度计(上海雷磁仪器厂生产);JA1003型十万分之一电子天平(上海垒固仪器有限公司生产);FTIR-650型傅里叶变换红外光谱仪(博津仪器(上海)有限公司生产),S-520HTACHI型扫描电镜。
1.3 吸附实验
准确称取一定量纳米零价铁于250 mL锥形瓶中,加入50 mL质量浓度ρ0为(40±0.05) mg/L 的 U(Ⅵ)溶液,用0.5 mol/L HNO3或NaOH调节溶液pH为5.0,置于振荡器上振荡反应一定时间后静止沉降,取1 mL上清液,加入1 mL偶氮胂Ⅲ和1 mL pH=2.5的乙酸-乙酸钠缓冲溶液,用蒸馏水定容至10 mL,放置5 min后用分光光度法测溶液中U(Ⅵ)的剩余浓度ρ。U(Ⅵ)的去除率(R)按式(2)计算:

式中:ρt为t时刻溶液中的U(Ⅵ)浓度,mg/L;ρ0为U(Ⅵ)初始浓度,mg/L。
实验条件如下:pH为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5;nZVI加入质量浓度 ρm为0.3 g/L;温度t为30 ℃,反应90 min时取样分析溶液中U(Ⅵ)浓度ρt。
2 结果与分析
2.1 纳米零价铁(nZVI)的表征结果分析
1) 纳米零价铁扫描电镜分析(SEM)
将真空干燥后的纳米零价铁粘于载物台上,在试样表面喷涂一层金膜,然后用S-520HTACHI型扫描电镜观察固体表观形貌。测试条件:工作电压20 kV,扫描电镜结果见图1。
从图 1(a)可以看出,新制备的纳米零价铁呈现球形,各个球相互连接在一起,这主要是纳米零价铁颗粒具有磁性,受地磁力及颗粒之间的磁性引力而发生团聚,这种现象在其他文献中也有报道[10]。从图1(b)可以看出,反应后纳米零价铁颗粒粒径变大,这主要是纳米零价铁与U(Ⅵ)发生反应后生成了铁的氧化物,如Fe3O4、Fe2O3和FeOOH以及生产的UO2沉淀覆盖在纳米零价铁表面所致[11-12]。
2) 纳米零价铁XRD结果分析
图2所示为纳米零价铁铁颗粒的XRD谱,扫描的2θ角度为10°~80°,入射波的波长为0.154 nm。
XRD 的测试结果表明:在扫描衍射角度(2θ)为10°~80°时,出现衍射峰时对应的 2θ分别为 35.25°和44.51°,对照铁的标准JCPDF卡片发现,图2中所示的峰与FeOOH和Fe的标准衍射峰一致[13],铁的半峰宽(FWHM)为 0.752,主峰位置在 2θ=44.51°处,表明颗粒为单质零价铁,表面有一层铁的氧化物质(FeOOH)生成,这与一些文献[14-16]中的较一致。由图2中的曲线2可以看出,当纳米零价铁与U(Ⅵ)发生反应后,在311和440处有两个比较明显的峰及一些小峰,通过与标准 PDF#24-0081卡片对比,主要是 γ-Fe2O3/Fe3O4,在 XRD 谱中,很难将 γ-Fe2O3和 Fe3O4(FeO·Fe2O3)区分开,由于它们产生十分相似的峰[17]。通过上述分析可知,纳米零价铁的核心由 Fe0组成,外层覆盖的是 FeOOH/Fe2O3和 Fe3O4,而 Fe3O4主要存在于覆盖层的内层。
3) 傅里叶变换红外光谱分析
图3所示为纳米零价铁的傅里叶变换红外光谱表征结果,测试条件:采用 2 cm-1的分辨率,扫描 60次,扫描范围400~4000 cm-1。

图1 纳米零价铁的SEM像Fig. 1 SEM images of nZVI: (a) Before reaction; (b) After reaction
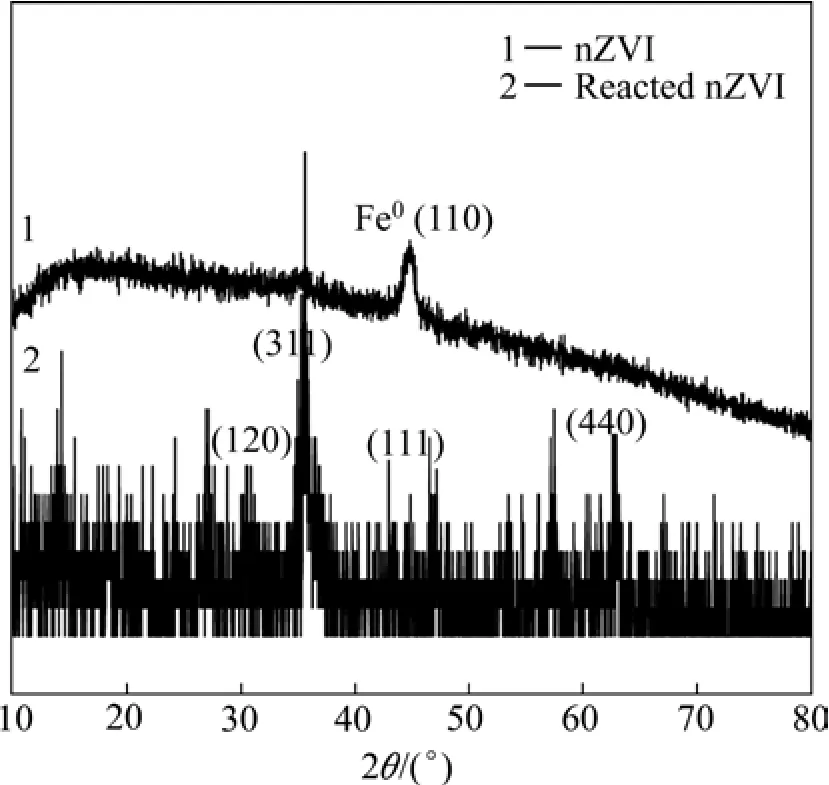
图2 纳米零价铁XRD谱Fig. 2 XRD pattern of nZVI
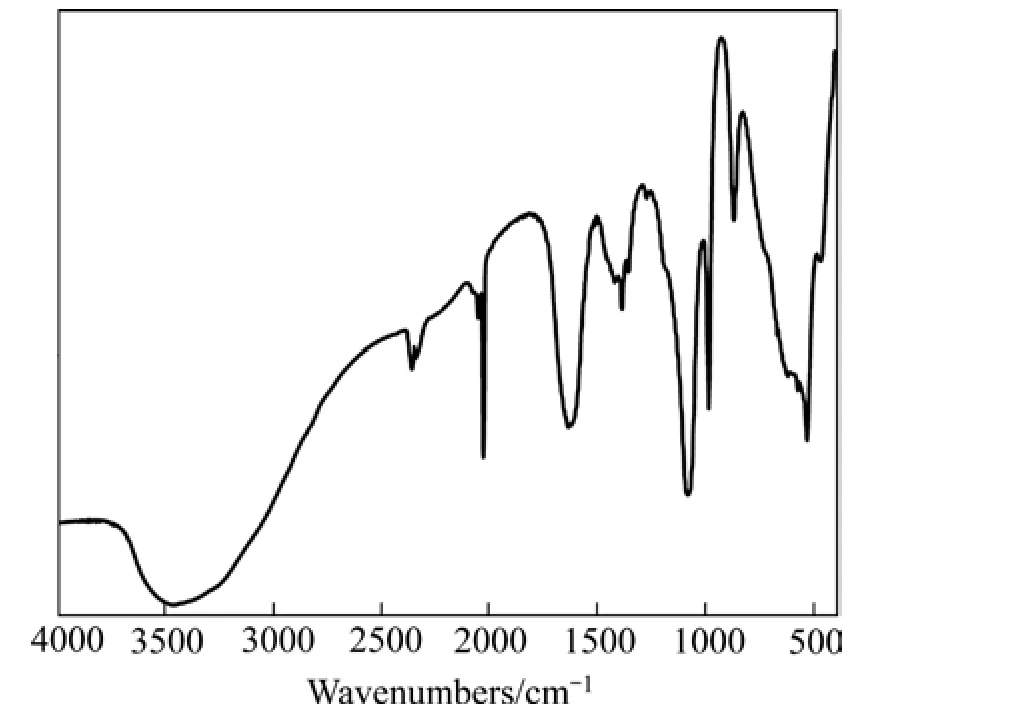
图3 纳米零价铁的傅里叶变换红外光谱Fig. 3 FT-IR spectroscope of nZVI
从图3可以看出,1634 cm-1谱带对应于Fe微粒上—OH的弯曲振动,说明痕量水作为溶液中微反应器的存在[18]。在1434 cm-1和875 cm-1处的吸收峰由的官能团振动引起,说明nZVI的表面同时有碳元素的存在,可能来自水和空气中的CO2。540.60 cm-1的吸收峰为纳米零价铁表面铁的氧化物Fe—O伸缩振动峰[19]。JOSEPHN等[20]运用XPS技术对零价铁表面的物种组成进行研究,结果表明:零价铁表面的元素主要是Fe、O、C,而Fe主要以氧化铁的形式存在,少量以Fe0的形式存在,Fe的氧化物可能是FeOOH、Fe3O4、Fe2O3,单纯运用XPS很难确定到底是哪一种形态,结合热力学分析表明,铁的氧化物主要是FeOOH,是零价铁在制备过程中很快发生氧化还原反应生成的。
2.2 溶液pH值和离子强度对去除效果的影响
在实验条件下,用 NaClO4调离子强度为 0~1.0 mol/L,考察pH和离子强度对纳米零价铁去除U(Ⅵ)的影响,其结果如图4所示(图中R为U(Ⅵ)的去除率)。
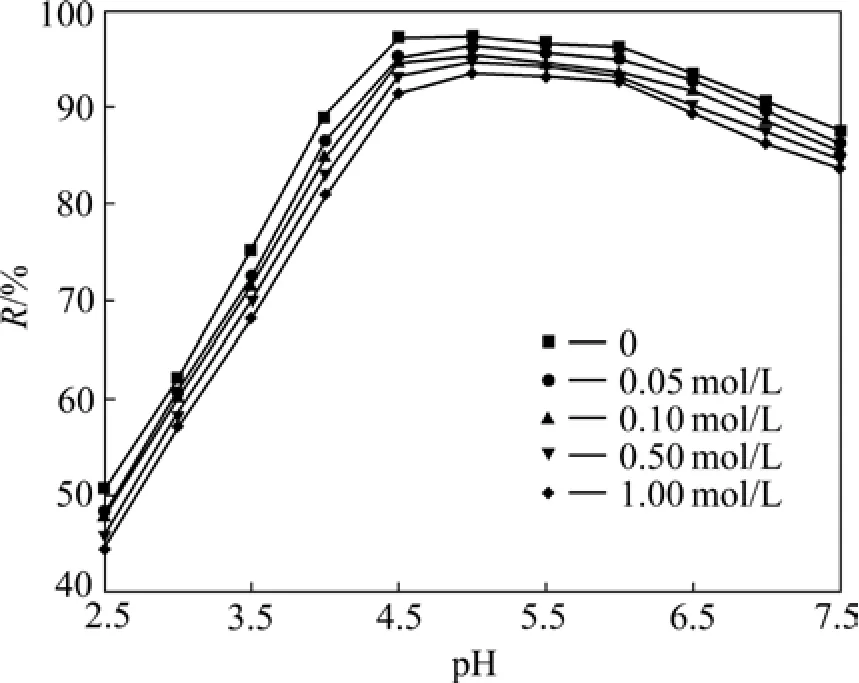
图4 pH值与离子强度对U(Ⅵ)去除效果的影响Fig. 4 Effect of pH and ion strenth on removal of U(Ⅵ)
从图 4可以看出,pH 值对 U(Ⅵ)的去除影响较大,当pH为2.5~5.0时,随着pH值的增大,U(Ⅵ)的去除率也在增大。当pH=5.0时,纳米零价铁对U(Ⅵ)的去除率达到最大值,随后随着pH值的增加,U(Ⅵ)去除率开始缓慢下降。这是由于 pH值既可以影响纳米零价铁的表面性质,也影响铀在溶液中的存在形态。
pH对铀在溶液中存在形态的影响 在pH的影响下,铀的水解作用对铀在溶液中和纳米零价铁之间的平衡起重要作用。在酸性条件下,U(Ⅵ)在溶液中主要以的形态存在,随着溶液pH值的增加,会发生一系列的水解而形成(UO2)2(O、UO2(OH)+、UO2(OH)2、(UO2)3(O和 UO2(O。但在弱酸性溶液中,UO2(OH)+是主要的存在形态,故当溶液pH为2.5~5.5时,U(Ⅵ)除了被Fe0直接还原为UO2沉淀外,以UO2(OH)+形式存在的铀与纳米零价铁表面的腐蚀产物发生络合作用。
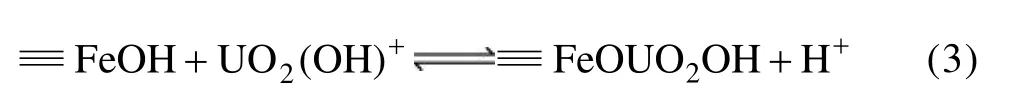
当溶液的 pH>5.5以后,随着 pH的增加,UO2(OH)+和 OH-进一步发生反应,逐渐形成了UO2(OH)2·H2O,不利于纳米零价铁对 U(Ⅵ)的还原和吸附。在更高的 pH下,铀主要形成了不溶性的UO2(OH)2和带负电荷的UO2(O,此时铀的去除是以沉淀形式而不是以吸附或还原沉淀的形式去除。此外,pH会影响纳米零价铁的表面性质,低pH值可以促进Fe的腐蚀速度,提高反应的效率。高pH值会促进氢氧化物钝化层的形成,占据活性反应场所,从而抑制还原反应的进行[21]。
从图4还可以看出,离子强度对纳米零价铁去除U(Ⅵ)几乎没有影响。一般情况下,表面配位作用依赖于溶液pH值的变化,低pH值时,表面配位是外层配位作用;高 pH值时,表面配位是内层配位作用,而离子交换则依赖于溶液中的离子强度[22]。因此,在所研究的pH值下,纳米零价铁对U(Ⅵ)的去除主要以还原沉淀和非专性吸附的方式被去除。
2.3 阳离子对去除效果的影响
在实际的废水中,往往含有大量如Ca2+、Mg2+、Na+和 K+等阳离子,它们能影响到溶液中金属离子的形态和活度,进而对去除都有不同程度的影响。在实验条件下,阳离子浓度为0.1 mol/L时,阳离子对去除效果的影响如图5所示。
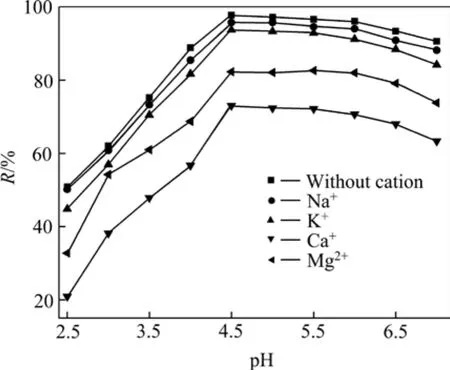
图5 阳离子对去除效果的影响Fig. 5 Effect of cation ions on removal of U(Ⅵ)
从图5可以看出,阳离子对铀的去除有一定的影响,其中Ca2+和Mg2+的影响较大,而Na+和K+几乎没有影响。在溶液中,水合离子的半径越小,电荷越高,离子极化度也越大,其与吸附材料的亲和力越大。在溶液中,阳离子的离子半径由小到大依次为 Mg2+(72 pm)、Ca2+(99 pm)、Na+(102 pm)、K+(138 pm),因此,Ca2+和 Mg2+与 U(Ⅵ)竞争纳米零价铁表面吸附位点的能力相对较强,故对去除的影响较大,而Na+和K+对吸附位点的竞争能力较弱,故对去除的影响较小。另外,Ca2+和 Mg2+对去除的影响来自于 Ca2+、Mg2+与之间静电斥力的作用,且当溶液中有存在时,溶液中形成了可溶性的三元络合物CaUO2(C、MgUO2(C、Ca2UO2(CO3)3和Mg2UO2(CO3)3,阻止纳米零价铁对 U(Ⅵ)的还原和吸附[23]。
2.4 含氧阴离子对去除效果的影响
水中存在多种含氧阴离子,很可能会影响 nZVI对铀的去除效果。本研究选取硫酸根、硝酸根、磷酸氢根、碳酸根和高氯酸根等含氧阴离子,其浓度为0.1 mol/L,考察它们对纳米零价铁去除铀的影响,其结果如图6所示。
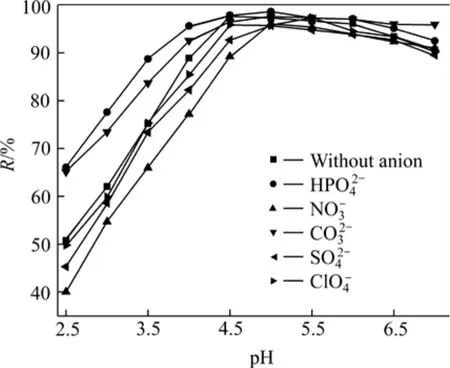
图6 阴离子对纳米零价铁去除U(Ⅵ)的影响Fig. 6 Effect of anion ions on removal of U(Ⅵ)
从图6可以看出,阴离子对纳米零价铁去除溶液中的 U(Ⅵ)有一定的影响,其影响顺序由大到小依次为。磷酸氢根和碳酸根在pH≤5.0时,对铀的去除有一定的促进作用,对 U(Ⅵ)的去除率随 pH 的增大而增大;当溶液pH>5.0以后,促进作用减弱,影响不明显。在pH≤5.0时,硝酸根对纳米零价铁去除 U(Ⅵ)具有明显的抑制作用;而当pH>5.0以后,几乎不产生影响。高氯酸根对铀的去除在整个pH范围内几乎没影响。硫酸根在 pH≤5.0时产生轻微影响,主要是 U(Ⅵ)与硫酸根发生络合反应:
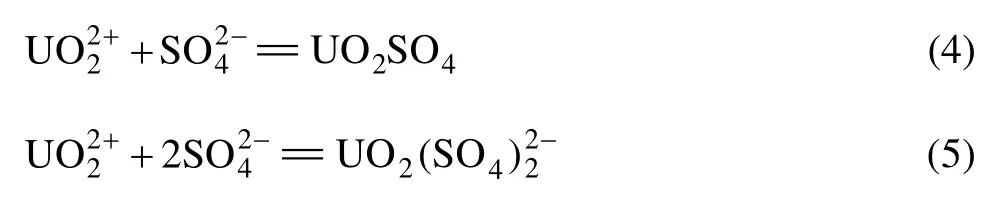
磷酸氢根对 U(Ⅵ)去除的促进作用主要是在pH≤5.0时,在溶液中与形成了和,然后再与纳米零价铁表面氧化产物的官能团发生表面配位反应,生三元表面配合物,反应式如下[24]:
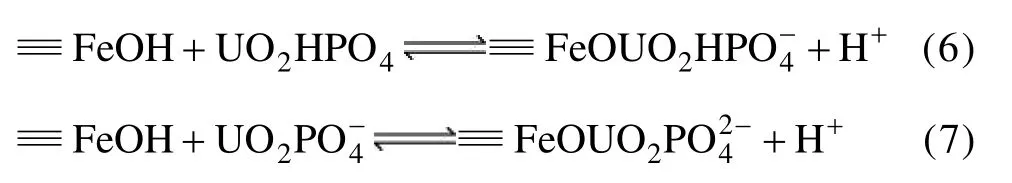
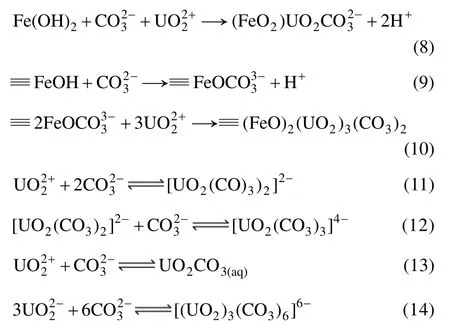
硝酸根对 U(Ⅵ)去除的影响主要是纳米零价铁对溶液中的硝酸根也有还原和吸附作用,铁在不断“腐蚀”过程中生成铁的氧化物,如γ-FeOOH、α-FeOOH、Fe3O4以及Fe2O3均对硝酸根离子有一定的吸附作用。JALOWITZ等[25]研究发现,采用零价铁粉去除硝酸盐,当pH>8.0以后,反应缓慢。ZHANG等[26]也指出,当pH≤4.0时,有利于硝酸盐的还原。主要是由于低 pH值时,可以去除零价铁表面的氧化物及其他保护层,产生较多的化学反应位。纳米零价铁去除溶液中硝酸根的方式如下[27-28]:
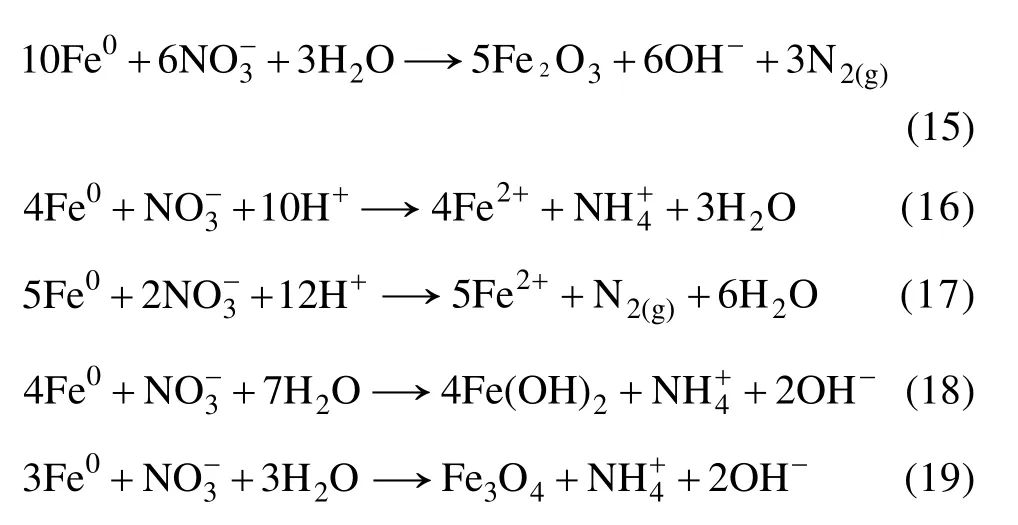
2.5 腐殖酸对去除效果的影响
腐殖酸表面包含大量的活性基团,腐殖酸表面带有较大的负电性,也可能会促进污染物的还原。在实验条件下,腐殖酸浓度为200 mg/L时对纳米零价铁吸附铀的影响见图7。
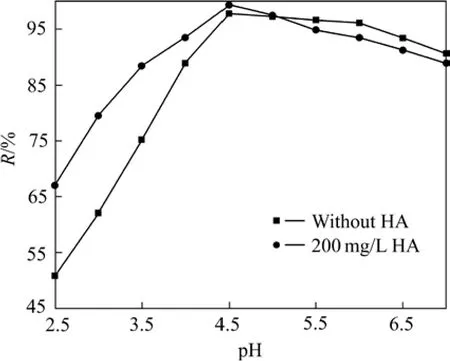
图7 腐殖酸对纳米零价铁去除U(Ⅵ)的影响Fig. 7 Effect of humic acid on removal of U(Ⅵ)
从图7可以看出,当pH≤4.5时,腐殖酸对纳米零价铁去除溶液中 U(Ⅵ)有明显的促进作用,其对U(Ⅵ)的去除率随溶液 pH 的增加而增大;当 pH=4.5时,加有腐殖酸的样品对U(Ⅵ)的去除率为99.29%,而单独纳米零价铁对 U(Ⅵ)的去除率为 93.25%;当pH>4.5时,加有腐殖酸的体系对U(Ⅵ)的去除率开始缓慢下降,腐殖酸对 U(Ⅵ)去除的促进作用减弱。而单独纳米零价铁对U(Ⅵ)的去除率在pH=5.0时达到最大,随后,随着 pH的增加而缓慢下降。腐殖酸主要官能团有羧基、醇羟基、酚羟基、醌型羰基和酮型羰基,这些官能团对铀具有吸附、络合和氧化还原的作用[29]。通常在弱酸性(pH为4.0~5.0)溶液中,腐殖酸对铀和超铀元素的吸附率最高,其原因是由于当溶液的pH为4.0~5.0时,腐殖酸的负电动势大,对铀和超铀元素的静电吸附亦大。腐殖酸的主要成分为胡敏酸和富里酸,据研究,在强酸性、中性和碱性介质中,铀以胡敏酸合铀酰络离子 Na4[UO2(CnHnCOO)m]形式迁移,而在酸性介质中则以富里酸合铀酰络离子的形式迁移,当pH为3.5~6.5时,胡敏酸吸附铀能力最强,并形成沉淀[30]。
3 结论
1) 纳米零价铁表征结果表明,新合成的纳米零价铁成明显的球形,由于纳米颗粒间的磁力及地心磁力,纳米颗粒发生团聚呈树枝状。纳米零价铁(nZVI)核心由Fe0组成,外层覆盖的是FeOOH/Fe2O3和 Fe3O4,而Fe3O4主要存在于覆盖层的内层。
2) 溶液pH值是反应体系中的重要影响因素,高pH值会促进氢氧化物钝化层的形成,阻碍还原反应的进行;低pH值可以促进Fe0腐蚀速度,提高还原反应效率,而离子强度对纳米零价铁去除 U(Ⅵ)几乎没有影响。
3) 溶液中共存阴阳离子对去除过程有一定的影响,其中磷酸根和碳酸根的存在可以促进纳米零价铁对铀的去除,当 pH≤5.0时,硝酸根对去除 U(Ⅵ)有一定的抑制作用;当pH>5.0时,硝酸根对去除U(Ⅵ)的抑制作用减弱;阳离子对去除效果的影响顺序由大到小依次为 Mg2+、Ca2+、Na+、K+(其中 Na+的与 K+的接近)。
4) 腐殖酸对纳米零价铁去除溶液中U(Ⅵ)有明显的影响,当pH≤4.5时,腐殖酸对纳米零价铁去除U(Ⅵ)具有明显的促进作用;随着 pH的升高,腐殖酸对纳米零价铁去除 U(Ⅵ)的去除率增加;当 pH>4.5时,腐殖酸对纳米零价铁去除U(Ⅵ)具有明显的抑制作用,U(Ⅵ)的去除率随pH的增加而下降。
[1] 彭国文, 丁德馨, 胡 南, 杨雨山, 王晓亮. 纳米 Fe3O4负载啤酒酵母菌对铀的吸附性能与机理[J]. 中国有色金属学报,2012, 22(2): 604-610.PENG Guo-wen, DING De-xin, HU Nan, YANG Yu-shan,WANG Xiao-liang. Adsorption properties and mechanism of saccharomyces cerevisiae loaded by nano-Fe3O4on uranium[J].The Chinese Journal of Nonferrous Metals, 2012, 22(2):604-610.
[2] 谢水波, 张亚萍, 刘金香, 刘迎九, 李仕友, 王劲松, 刘海燕.腐殖质 AQS 存在条件下腐败希瓦氏菌还原 U(Ⅵ)的特性[J].中国有色金属学报, 2012, 22(11): 3285-3291.XIE Shui-bo, ZHANG Ya-ping, LIU Jin-xiang, LIU Ying-jiu, LI Shi-you, WANG Jin-song, LIU Hai-yan. Characteristics of reducing U(Ⅵ) by Shewanella putrefaciens in presence of anthraguinone-2-sulfonate(AQS)[J]. The Chinese Journal of Nonferrous Metals, 2012, 22(11): 3285-3291.
[3] GHJU M. Hexavalent chromium reduction with zero-valent iron(ZVI) in aquatic systems[J]. Water Air Soil Pollut, 2011, 222:103-148.
[4] 付丰连. 零价铁处理污水的最新研究进展[J]. 工业水处理,2010, 30(6): 1-4.FU Feng-lian. Newest research progress in the application of zero-valent iron to the treatment of wastewater[J]. Industrial Water Treatment, 2010, 30(6): 1-4.
[5] 邵小宇, 王冬杰, 盛国栋, 李益民. 零价铁去除 U(Ⅵ)的作用机理及其影响因素[J]. 核化学与放射化学, 2013, 35(1): 1-7.SHAO Xiao-yu, WANG Dong-jie, SHENG Guo-dong, LI Yi-min.Mechanism and influence factors of uranium remediation from wastewater by zero-valent iron[J]. Journal of Nuclear and Radiochemistry, 2013, 35(1): 1-7.
[6] 吴旭红, 徐乐昌, 魏广芝. 用零价铁从含铀溶液去除铀的试验研究[J]. 湿法冶金, 2014, 33(5): 389-303.WU Xu-hong, XU Lec-hang, WEI Guang-zhi. Removal of uranium in uranous solution using zero-valent iron[J].Hydrometallurgy of China, 2014, 33(5): 389-303.
[7] MUELLER N C, BRAUN J, BRUNS J, ČERNÍK M, RISSING P, RICKERBY D, NOWACK B. Application of nanoscale zero valent iron (nZVI) for groundwater remediation in Europe[J].Environ Sci Pollut Res, 2012, 19: 550-558.
[8] 李小燕, 刘义保, 张 明, 李 寻, 刘云海, 花 榕. 纳米零价铁去除溶液中 U(Ⅴ)的还原动力学研究[J]. 原子能科学技术, 2014, 48(1): 7-14.LI Xiao-yan, LIU Yi-bao, ZHANG Ming, LI Xun, LIU Yun-hai,HUA Rong. Reduction kinetics of U(Ⅵ) in aqueous solution by nanoscale zero-valent iron[J]. Atomic Energy Science and Technology, 2014, 48(1): 7-14.
[9] ZHU Shi-ni, LIU Guo-hua, YE Zheng-fang, ZHAO Quan-lin,XU Ying. Reduction of dinitrotoluene sulfonates in TNT red water using nanoscale zero valent iron particles[J]. Environ Sci Pollut Res, 2011, 19(6): 2372-2380.
[10] SHIH Y H, HSU C Y, SU Y F. Reduction of hexachlorobenzene by nanoscale zero-valent iron: Kinetics, pH effect and degradation mechanism[J]. Separation and Puri fi cation Technology, 2011, 76: 268-274.
[11] 高树梅, 王晓栋, 秦 良, 罗 斯, 赵 欣, 刘树深, 王连生.改进液相还原法制备纳米零价铁颗粒[J]. 南京大学学报(自然科学), 2007, 43(4): 358-364.GAO Shu-mei, WANG Xiao-dong, QIN Liang, LUO Si, ZHAO Xin, LIU Shu-shen, WANG Lian-sheng. Preparation of nano zero-valent iron particles by modified liquid phase reduction method[J]. Journal of Nanjing University (Natural Sciences),2007, 43(4): 358-364.
[12] DU Xin, BOONCHAYAANANT B, WU Wei-min, FENDORF S,BARGAR J, CRIDDLE C S. Reduction of uranium (Ⅵ) by soluble iron (Ⅱ) conforms with thermodynamic predictions[J].Environ Sci Technol, 2011, 45: 4718-4725.
[13] PHENRAT T, SALEH N, SIRK K, TILTON R D, LOWRY G V.Aggregation and sediment at ion of aqueous nanoscale zero valent iron dispersions[J]. Environ Sci Technol, 2007, 41:284-290.
[14] FAN Ming-de, YUAN Peng, CHEN Tian-hu, HE Hong-ping,YUAN Ai-hua. Synthesis, characterization and size control of zero valent iron nanoparticles anchored on montmorillonite[J].Chinese Sci Bull, 2010, 55(11): 1092-1099.
[15] LING Xiao-feng, LI Jian-sheng, ZHU Wen, ZHU Yao-yao, SUN Xiu-yun, SHEN Jin-you, HAN Wei-qing, WANG Lian-jun.Synthesis of nanoscale zero-valent iron/ordered mesoporous carbon for adsorption and synergistic reduction of nitrobenzene[J]. Chemosphere, 2012, 87: 655-660.
[16] XIAO Jian-an, GAO Bao-yu, YUE Qin-yan, GAO Yuan, LI Qian.Removal of trihalomethanes from reclaimed-water by original and modified nanoscale zero-valent iron: Characterization,kinetics and mechanism[J]. Chemical Engineering Journal,2016(262): 1226-1236.
[17] LI Zi-jie, WANG Lin, YUAN Li-yong, XIAO Cheng-liang, MEI Lei, ZHENG Li-Rong, ZHANG Jing, YANH Ju-hua, ZHAO Yu-liang, ZHU Zhen-tai, CHAI Zhi-fang, SHI Wei-qun. Efficient removal of uranium from aqueous solution by zero-valent iron nanoparticle and its graphene composite[J]. Journal of Hazardous Materials, 2015(290): 26-33.
[18] SINGH R, MISRA V, SINGH R P. Synthesis, characterization and role of zero-valent iron nano particle in removal of hexavalent chromium from chromium-spiked soil[J]. J Nano part Res, 2011, 13: 4063-4073.
[19] CHEN Zheng-xian, CHENG Ying, CHEN Zu-liang,MEGHARAJ M, NAIDU R. Kaolin-supported nanoscale zero-valent iron for removing cationic dye-crystal violet in aqueous solution[J]. J Nanopart Res, 2012, 14: 899.
[20] JOSEPHN F, WILLIAMD B, ROBERTJ J, JAMES F.Understanding the mechanism of uranium removal from groundwater by zero-valent iron using X-ray photoelectron spectroscopy[J]. Environ Sci Technol, 1998, 32: 1466-1473.
[21] SONG H, CARRAWAY E R. Reduction of chlorinated ethanes by nano sized zero-valent iron: Kinetics, pathways, and effects of reaction conditions[J]. Environ Sci Technol, 2005, 39:6237-6245.
[22] REN Xue-mei, WANG Suo-wei, YANG Shi-tong, LI Jia-xing.In fl uence of contact time, pH, soil humic/fulvic acids, ionic strength and temperature on sorption of U(Ⅵ) onto MX-80 bentonite[J]. J Radioanal Nucl Chem, 2010, 283: 253-259.
[23] YAN Sen, BIN Hua, ZHANG Yu-bao, YONG J, LIU Chong-xuan, DENG Bao-lin. Uranium(Ⅵ) removal by nanoscale zero valent iron in anoxic batch systems[J]. Environ Sci Technol,2010, 44: 7783-7789.
[24] 严 超. U(Ⅵ)、Th(Ⅳ)和 Eu(Ⅲ)在γ-Al2O3上的吸附研究[D].兰州: 兰州大学, 2009: 26.YAN Chao. Adsorption of U(Ⅵ), Th(Ⅳ) and Eu(Ⅲ) onγ-Al2O3[D]. Lanzhou: Lanzhou University, 2009: 26.
[25] JALOWITZ M, SCHERER M. Kinetics of nitrate, nitrite and Cr(Ⅵ) reduction by iron[J]. Environ Sci Technol, 2002, 36(3):299-306.
[26] ZHANG Huan, JIN Zhao-hui, HAN Lu, QIN Cheng-hua.Synthesis of nanoscale zero-valent iron supported on exfoliated graphite for removal of nitrate[J]. Transactions of Nonferrous Metals Society of China, 2006, 16(S1): s345-s349.
[27] GORDON C, YANG C, LEE H L. Chemical reduction of nitrate by nanosized iron: Kinetics and pathways[J]. Water Res, 2005,39(5): 884-894.
[28] WANG Wei, JIN Zhao-hui, LI Tie-long, ZHANG, Huan, GAO Si. Preparation of spherical iron nanoclusters in ethanol-water solution for nitrate removal[J]. Chemosphere, 2006, 65(8):1396-1404.
[29] 何为红, 李福春, 吴志强, 代静玉, 刘本定. 重金属离子在胡敏酸-高岭石复合体上的吸附[J]. 岩石矿物学杂志, 2007,26(4): 359-365.HE Wei-hong, LI Fu-chun, WU Zhi-qiang, DAI Jing-yu, LIU Ben-ding. Adsorption of heavy metal ions on humic acid-kaolinite complexes[J]. Acta Petrologica Et Mineralogica,2007, 26(4): 359-365.
[30] ZHAO Dong-lin, YANG Shu-bin, CHEN Shao-hua, GUO Zhi-qiang, YANG Xin. Effect of pH, ionic strength and humic substances on the adsorption of uranium (Ⅵ) onto Na-rectorite[J]. Journal of Radioanalytical and Nuclear Chemistry, 2011, 287:557-565.
