香港牡蛎(Crassostrea hongkongensis)水通道蛋白基因AQP1的克隆、分子特性和表达分析*
2015-03-22张跃环喻子牛
万 茜 张 扬 张跃环 喻子牛
(1. 中国科学院南海海洋研究所热带海洋生物资源与生态重点实验室及广东省应用海洋生物重点实验室 广州 510301;2. 南海资源开发与保护协同创新中心 广州 510275; 3. 中国科学院大学 北京 100049)
水通道蛋白(Aquaporin, AQP)是一类参与生命活动中水分子跨膜运输的调控蛋白, 属于主要内嵌蛋白超家族成员(major intrinsic protein superfamily), 它主要介导水分由低渗区向高渗区的跨膜转运, 也能转运甘油、尿素、氨水等中性小分子。自从 Pretson等(1992)发现了第一个水通道蛋白 1(CHIP28)以来,研究人员已经发现水通道蛋白广泛分布于古菌、真菌和真核生物组成的三界系统中。水通道蛋白在脊椎动物和植物中已经有很多研究报道, 人类 13种水通道蛋白(从水通道蛋白0到12)已经被发现并且鉴定; 但是, 无脊椎动物水通道蛋白的研究相对较少, 并且主要集中在模式生物线虫、果蝇和昆虫中; 在软体动物中研究甚少 (Yang, 2000; Huanget al, 2007; Campbellet al, 2008; Ishibashiet al, 2011; Pieńkowskaet al,2014)。水通道蛋白是一个多亚型的蛋白家族, 根据氨基酸序列的同源性可以分为四种类型: 第一类为AQP1-like型(包括AQP0, 1, 2, 4, 5和6, 属于典型的传统 AQP, 只转运水分子), 第二类为 AQP3-like型(包括AQP3, 7, 9和10, 属于水甘油通道蛋白, 除了水分子, 还可以转运甘油、尿素、氨水等中性小分子),第三类为AQP8-like型(只包括AQP8这一种传统水通道蛋白), 第四类为AQP11-like型(包括AQP11和12,属于非传统AQP) (Sotoet al, 2012)。所有的水通道蛋白都是以同源四聚体形式存在于细胞膜表面, 每个单体包括 6个跨膜区段(Ⅰ—Ⅵ)和 5个环形结构(loopA-E)。根据“砂漏”模型(Agreet al, 1993), B环和E环从两侧半嵌入膜内形成一个开放式狭窄的水通道。保守的 NPA基序(Asn-Pro-Ala)和选择性水孔构件 ar/R (aromatic/arginine, 芳香族/精氨酸区)被认为是最主要的控制水或其它中性小分子渗透性的关键区域(Ericet al, 2006)。
香港牡蛎(Crassostrea hongkongensis)是我国华南沿海养殖的主要经济种, 主要分布在广东、广西等地, 年产量在130多万 t, 产值在 80—100亿元(中国渔业年鉴, 2013)。香港牡蛎与其它牡蛎种类相比较,其价值主要体现在体大肉肥、味道鲜美, 另外其市场价值远高于其它种类牡蛎, 深受广东、广西、港澳、东南亚一些国家消费者青睐(张跃环等, 2012)。作为河口区域典型牡蛎经济种(Lamet al, 2003), 它对低盐有较强的抗性, 但对高盐仍具有一定的耐受性, 更适宜于栖息在河口咸淡水环境(谢忠明, 2003)。水通道蛋白作为促进水分子跨膜运输的重要蛋白, 参与渗透平衡的调节, 在盐度变化剧烈的环境中发挥重要作用。目前, 对编码牡蛎水通道蛋白的基因研究甚少, 且不清楚盐度胁迫下水通道蛋白基因的表达特性。因此, 本文采用RACE技术首次克隆了香港牡蛎水通道蛋白1(AQP1)基因cDNA全长, 分析该基因编码蛋白序列特征、理化性质和空间结构, 通过实时荧光定量 PCR技术分析该基因在香港牡蛎中的组织分布及7天盐度胁迫下的表达情况, 旨在为进一步研究香港牡蛎的广盐适应机制提供分子理论基础。
1 材料与方法
1.1 供试材料、盐度处理及取样
实验材料为壳高在120mm左右的2龄香港牡蛎,采自广东省阳江市阳西县程村。在实验室27°C, 盐度为 18海水中暂养一周后, 选取健康香港牡蛎个体,快速吸取出淋巴液, 离心(12000 r/min, 30s)后弃上清,立即加入等量TRIzol reagent (Invitrogen公司)重悬沉淀, 继续提取RNA或者冻存于–80°C。另外, 取下小块外套膜、鳃、闭壳肌、消化腺和整个心脏, 加入1mL TRIzol reagent, 匀浆, 继续提取 RNA 或者冻存于–80°C。
盐度处理时, 将 200只健康牡蛎随机分为 4组,即4盐度组、18盐度组、32盐度组和42盐度组。由于香港牡蛎最适盐度范围为 10—20 (谢忠明, 2003),所以本实验以18盐度组作为对照组。用0.8%扁藻喂养, 并且每天换3次海水。处理开始后, 在时间节点1天(24h)、3天(72h)、5天(120h)和 7天(168h)对四组分别随机挑取5个个体, 取出一小块鳃组织, 立即加入TRIzol, 匀浆后冻存。
1.2 试剂与仪器
大肠杆菌菌株 DH5α、克隆载体 pMDTM19-T、exTaq酶、DNAmarker、T4DNA连接酶、DNA片段纯化回收试剂盒、琼脂糖凝胶回收试剂盒、逆转录试剂盒 PrimeScriptⅡ1stStrand cDNA Synthesis Kit 、用于定量实验的逆转录试剂盒Prime Script RT reagent Kit with gDNA Eraser 购于宝生物工程 (大连) 有限公司。TRIzol试剂购于Invitrogen公司。RACE试剂盒BD SMART RACE cDNA Amplification kit 购于Clontech公司。实时定量试剂盒 2×SYBR Green Master Mix 购于Roche公司。用罗氏的LightCycler 480Ⅱ仪器进行Real-time PCR。引物合成和测序工作在北京六合华大进行。
1.3 香港牡蛎总RNA 提取与cDNA第一链的合成
根据TRIzol reagent (Invitrogen公司)的产品说明操作提取淋巴及匀浆后的各个组织总 RNA, 用Nanodrop 2000c (Thermo公司)测定RNA的纯度和浓度, 并用电泳检测 RNA 质量。用 PrimeScriptⅡ1stStrand cDNA Synthesis Kit进行cDNA第一链的合成,反转录产物用于PCR扩增或者保存在–20°C。
1.4 香港牡蛎AQP1基因片段的RT-PCR扩增
根据在 NCBI 太平洋牡蛎EST数据库中获得的一段序列, 设计引物ChAQP1F1和ChAQP1R1 (表1),以混合各个组织cDNA第一链为模板进行PCR扩增。反应条件为: 94°C预变性3min; 94°C变性30s, 50°C退火 30s, 72°C延伸1min, 共30个循环; 最后72°C延伸10min。PCR产物经1.2%琼脂糖凝胶电泳后, 切胶回收纯化目的片段。将纯化产物连接至 pMD19-T质粒载体上, 转化至E. coliDH5α感受态细胞中, 培养过夜, 挑取单克隆进行菌落PCR验证, 阳性克隆送北京六合华大基因科技股份有限公司测序。测序结果在 NCBI上进行 Blast比对, 初步确定获得片段为香港牡蛎水通道蛋白1基因。
1.5 香港牡蛎AQP1末端序列的RACE扩增及全长序列的确定
根据上述克隆获得的片段序列, 设计用于5’RACE扩增的基因特异性引物ChAQP1R2和ChAQP1R3, 用于 3’RACE扩增的基因特异性引物ChAQP1F2 和ChAQP1F3(表 1)。按照 BD SMART RACE cDNA Amplification kit试剂盒说明, 利用引物GR5P/ChAQP1R2和 GR3P/ChAQP1F2进行 5’RACE和 3’RACE 第一轮反应, 反应条件为: 94°C 3min;94°C 30s, 72°C 2min, 5 个循环, 94°C 30s, 70°C 30s,72°C 2min, 5 个循环, 94°C 30s, 68°C 30s, 72°C 2min,25个循环; 72°C 10min。以第一轮PCR产物为模板,引物 GR5NP/ChAQP1R3和 GR3NP/ChAQP1F3进行第二轮反应, 反应程序为: 94°C 3min; 94°C 30s, 55°C 30s, 72°C 2min, 25个循环; 72°C 10min。PCR 产物进行切胶回收纯化, 连 T载体, 转化, 挑克隆, 送测序,获得测序结果经Blast比对后, 用DNAstar软件拼接所得序列片段, 最后获得完整全长序列。
根据已拼接的基因序列设计特异性引物ChAQP1F4和ChAQP1R4 (表1), PCR扩增香港牡蛎AQP1 的编码区, 反应条件为: 94°C 3min; 94°C 30s,55°C 30s, 72°C 2min, 30 个循环; 72°C 10min。1.2%琼脂糖凝胶电泳分析扩增结果, 测序验证。

表1 本文中所用引物序列Tab.1 Sequences of designed primers used in this study
1.6 序列分析、结构预测及分子进化树的构建
从NCBI蛋白数据库中获得水通道蛋白1同源序列, MatGAT2.02软件分析氨基酸序列的一致性(Tamuraet al, 2007)。ProtParam (http: //web.expasy.org/protparam/) 分析蛋白质基本理化性质。蛋白质保守结构域的预测由在线软件Simple Modular Architecture Research Tool (SMART)完成(http: //smart.emblheidelberg.de/)。氨基酸多序列分析由ClustalX 1.81软件完成。分子进化树由MEGA 4.0软件构建获得。蛋白质亲水性分析通过 ProtScale在线服务器预测(http://web.expasy.org/cgi-bin/protscale/protscale.pl) (Kyteet al,1982)蛋白质三级结构预测在SWISS-MODEL中进行,用Rasmol 2.7.0.1查看预测的结构。
1.7 实时定量PCR分析
以香港牡蛎不同组织总RNA及不同盐度胁迫下鳃组织中总RNA 1µg为底物, 按照Prime Script RT reagent Kit with gDNA Eraser产品说明合成用于实时定量PCR的单链cDNA模板。根据全长AQP1序列信息, 设计特异定量引物ChAQP1F5和ChAQP1R5;以看家基因 β-actin为内参基因, 设计内参定量引物β-actin F1和 β-actin R1(表 1), 用于测定香港牡蛎AQP1基因在不同组织中的时空表达量; 以看家基因GAPDH为内参基因, 设计内参定量引物 GAPDHF1和GAPDH R1(表1), 用于测定香港牡蛎AQP1基因在不同盐度胁迫下的表达量; 定量 PCR反应体系20µL 为: 10 µmol/L 的上、下游引物各 2µL; 2×SYBR Green Master Mix (Roche, USA) 10 µL; cDNA 模板 2 µL;灭菌超纯水 H2O 4µL。定量 PCR反应条件为: 95°C预变性 1min; 95°C 变性 10s, 55°C 退火 15 s, 72°C 延伸20s 共40个循环。为检测定量PCR的特异性, 在反应结束时进行熔融曲线分析。数据由 LightCycler 480Ⅱ1.5软件生成并且记录。采用法分析香港牡蛎AQP1 mRNA在不同组织中的相对表达量。
1.8 数据分析
采用 SPSS软件包单因素方差分析法(one-way ANOVA)中的 Duncan多重比较检验法对实时定量PCR中的数据进行分析, 比较香港牡蛎AQP1在组织分布及不同盐度胁迫下鳃中的相对表达量(平均值±标准差)差异。
2 结果
2.1 香港牡蛎ChAQP1基因的克隆和分析
以香港牡蛎各个组织混合cDNA为模板, 使用引物ChAQP1F1和ChAQP1R1进行PCR扩增, 扩增产物经1%琼脂糖凝胶电泳检测获得约600bp的核酸条带(图 1a), 测序获得核酸序列。将核酸序列在 NCBI中Blast比对, 初步确定获得香港牡蛎AQP1基因序列。再用特异性引物ChAQP1R2、ChAQP1R3和ChAQP1F2、ChAQP1F3 分别进行 5’RACE 和 3’RACE两轮PCR扩增, 分别获得1条大小约503 bp (图1b)和353 bp (图1c)的核酸条带。将3段序列拼接后得到长度为1153 bp的香港牡蛎水通道蛋白1基因全长序列。其5’非编码区(UTR)长度为165 bp, 3’非编码区长度为100 bp, 基因编码区长为888 bp, 编码295个氨基酸(图 2)。设计包含编码区及以外若干序列的特异引物ChAQP1F4和ChAQP1R4扩增获得1060 bp的核酸条带(图 1d), 经测序验证为目的基因, 将此基因命名为ChAQP1。将序列提交至GenBank, 获得登录号KJ704847。

图1 香港牡蛎ChAQP1 PCR 扩增结果Fig.1 The PCR amplification products of ChAQP1 in C.hongkongensisM: DL2000 marker; a: 中间片段; b: 5'端片段扩增; c: 3'端片段扩增; d: 全长cDNA片段
2.2 ChAQP1蛋白质基本理化性质分析及结构预测
Protparam在线预测软件表明该蛋白分子式为C1463H2278N370O400S14, 分子量为31.89 kDa, 等电点为8.61, 负电荷氨基酸总残基数(Asp+Glu)为 21, 正电荷氨基酸总残基数(Arg+Lys)为 24, 脂肪系数为 99.19,亲水性总平均数为 0.439, 为脂溶性蛋白, 不稳定系数为20.16, 属于一类稳定的蛋白。
SMART在线服务软件对获得的ChAQP1基因进行蛋白质结构域预测, 结果表明有1个与该基因匹配的蛋白质结构域MIP (major intrinsic protein superfamily),位于第31—243位氨基酸(图2)。
ProtScale分析蛋白质疏水性表明, 该蛋白二级结构中具有 6个跨膜螺旋 TM1—TM6, 5个连接环A—E (图 3)。
MatGAT分析表明,ChAQP1氨基酸序列除了与太平洋牡蛎氨基酸序列一致性为87.8%以外, 与其它的都只有30%左右的一致性(表2)。由于与人类AQP1氨基酸序列一致性为40.2%, 故选择人类AQP1 (PDB ID:1H6I)为模板, 利用 SWISS-MODEL中 Target-Template Alignment进行ChAQP1蛋白三级结构预测。结果发现(用Rasmol查看)两者有相似的结构, 都存在六个跨膜结构域, 2个半跨膜结构域和5个连接环(图 4、图 5)。
2.3 ChAQP1蛋白序列比对和分子进化树的构建
Clustal 同源多序列比对结果(图6)表明ChAQP1有两个保守的 NPA(天冬酰胺-脯氨酸-丙氨酸)结构基序, 位于第93—95和第208—210位氨基酸处, 这与其它物种AQP1中序列一致。ar/R选择性水孔构件由F73、H196、S205和R211四个位点构成, 除了S205位点相对不保守, 其它三个位点存在高度保守性, 这表明ChAQP1属于传统的水通道蛋白, 只允许水分子通过该孔道。另外, 在第一个 NPA基序上游发现有ISGGH序列(第87—91位), 在其它传统AQP氨基酸序列中也普遍存在。此结果进一步说明, 水通道蛋白1的NPA基序和ar/R结构在不同物种中存在很高的进化保守性。
使用 MEGA 4.0软件中的 N-J建树方法对ChAQP1蛋白序列和其它物种中的AQP1及AQP家族成员构建分子进化树(图7)。结果显示, AQP家族成员聚类分成4个主要分支, 即AQP1-like, AQP3-like,AQP8-like和AQP11-like四类,ChAQP1属于AQP1-like分支。将AQP1-like分支序列中AQP1序列重新构建进化树(图 8), 结果表明, 脊椎动物能较好地聚为一类, 无脊椎动物则不能聚为一类。在无脊椎动物中, 香港牡蛎与太平洋牡蛎聚为一类, 亲缘关系最近,这显示了它们中水通道蛋白1相似性但也存在差异。

图2 ChAQP1的全长cDNA序列及推导的氨基酸序列Fig.2 The cDNA sequence of ChAQP1 and deduced amino acid sequences ORF区用大写字母显示, 5’UTR和3’UTR用小写字母显示。灰色阴影标示SMART预测的MIP结构域。椭圆框显示的是NPA基序。终止子用“*”表示

表2 ChAQP1与其它已知AQP1同源序列氨基酸一致性比较Tab.2 Amino acid identity comparison of the ChAQP1 with other known AQP1 homologues

图3 ChAQP1疏水性图Fig.3 Hydropathy plots of ChAQP1数字1—6表示跨膜结构域, 字母A—E表示5个连接环

图4 ChAQP1蛋白预测的三级结构Fig.4 The predicted 3D structure of ChAQP1

图5 1H6I蛋白三级结构Fig.5 The 3D structure of 1H6I
2.4 ChAQP1基因在香港牡蛎中的组织分布
ChAQP1 mRNA在各个组织中的表达量可以通过实时定量PCR的方法进行检测, 结果表明ChAQP1基因在香港牡蛎鳃、外套膜、闭壳肌、消化腺、性腺、心脏和淋巴中都有表达, 其中在闭壳肌中表达量最高, 其次是外套膜、性腺、消化腺、鳃。心脏、淋巴中表达量较低(图9)。
2.5 盐度胁迫下ChAQP1基因的表达量分析
7天盐度胁迫实验结果如图10。香港牡蛎最适盐度为18, 故以之作为对照组。低盐处理后(盐度为4),ChAQP1基因的表达量与对照组表达量相近, 并随盐度胁迫时间的延长维持在一个相对稳定的水平, 1天、3天、5天、7天分别为对照组的1.06、0.90、0.72、0.92倍。在32高盐胁迫下,ChAQP1基因的表达量在前五天呈现出略微下降的趋势, 分别为对照组的0.65、0.76、0.86倍, 而在第 7天恢复正常水平(1.11倍)。42高盐胁迫下,ChAQP1基因的表达量在前五天迅速下降, 随时间延长维持在一个较低水平, 分别为对照组的 0.18 (P<0.01)、0.48、0.28 (P<0.05)倍, 在第7天恢复正常水平(1.03倍)。
3 讨论
本研究采用RACE技术从香港牡蛎中克隆获得其香港牡蛎水通道蛋白1基因ChAQP1 (KJ704847),对其进行蛋白保守区段预测发现, 该蛋白具有一个典型的MIP结构域、6个跨膜螺旋、5个连接环。在氨基酸同源性序列比对中,ChAQP1含有两个保守的 NPA基序, 这与其它物种中水通道蛋白 1一致;ar/R区氨基酸组成在 F73、H196和 R211这三个位点上与其它物种 AQP1中的也是高度一致, 这符合传统水通道蛋白的特性, ar/R区氨基酸形成的孔径正好允许水分子通过(Beitzet al, 2006)。第一个NPA基序上游的 ISGGH序列也是高度保守的, 可见,ChAQP1是非常传统的, 只允许水分子穿过双分子膜的水通道蛋白, 在关键的功能结构域上具有较高的保守性。系统进化分析表明, 该蛋白属于AQP-1like类型的水通道蛋白。对不同物种AQP1序列进行聚类分析发现,ChAQP1与同科同属的太平洋牡蛎 AQP1遗传距离最近, 与同为软体动物门的腹足纲蜗牛(Lymnaea stagnalis, Catascopia occulta和Stagnicola palustris)遗传距离比较近, 而与哺乳动物中的人类及鼠遗传距离相对较远, 符合其遗传进化关系。

图6 ChAQP1与其它物种AQP1氨基酸序列比对Fig.6 Multiple alignment of ChAQP1 amino acid sequences with other AQP1 proteins“*”代表一致, “: ”代表高度保守, “.”代表低度保守。2个阴影部分代表2个NPA基序, 椭圆标示ar/R结构并且方框标示ISSGGH序列。横线标示保守的跨膜结构域。AQPl 来源及GenBank登录号详见表2
组织分布结果显示ChAQP1 mRNA 在香港牡蛎主要组织鳃、外套膜、闭壳肌、消化腺、性腺、心脏和淋巴中都有表达, 其中鳃、外套膜、闭壳肌、消化腺和性腺表达量相对较高些, 这说明着ChAQP1可能在转运水分子的相关生理过程中起到重要作用。Moon等(1993)研究发现人类 AQP1也存在各个组织器官组成型表达的现象, 人类AQP1广泛分布于红细胞、肾、眼、肺和血管内皮细胞等组织中。Pieńkowska等(2014)研究蜗牛AQP1, 发现在脑、肾、足和消化腺等组织器官中都有广泛分布。Tipsmark等(2010)发现大西洋鲑鱼AQP-1a也广泛分布在肠、肾、鳃、脑等组织中。在 7天盐度胁迫实验中, 以盐度 18作为对照, 当盐度达到 42时,ChAQP1基因表达受到抑制,而在低盐(4)组没有太大的变化, 在高盐(32)组呈现出略微下降的趋势。这与 Meng等(2013)利用转录组数据分析太平洋盐度适应性时, 发现的 3个 AQP基因在高盐(盐度为40)和低盐(盐度为10)下均为呈下调趋势的结果不太一致。这是因为太平洋牡蛎最适盐度为30, 为了维持细胞膨胀与收缩的稳定, 机体通过增加蛋白质磷酸化来降低水通道蛋白活性, 从而保护机体免于更多水分的进入, 而在盐度4到32范围内, 香港牡蛎ChAQP1基因表达量和正常盐度下表达量波动不是很大, 这说明在该盐度范围内AQP1基因参与盐度调节的能力是有限的, 尤其是在低盐下。这种现象同样出现在鲈鱼中, Ivone等发现鲈鱼在低盐下,鳃组织中AQP1基因表达量并没有变化(Giffard-Menaet al, 2007)。而在高盐下, AQP1基因表达量普遍存在下调趋势。在42盐度下, 香港牡蛎ChAQP1基因表达量显著下降, 这说明机体通过降低该基因的表达来降低 AQP1蛋白的活性, 抑制机体内水分的流失,保持机体内水盐平衡, 提高机体对逆境的耐受力。同样的现象也出现在大西洋鲑鱼中, 从淡水到海水的过程中, 鲑鱼AQP1-a基因在鳃中表达量也明显下调(Tipsmarket al, 2010)。以上结果表明, 在香港牡蛎中,AQP1参与了调节渗透压平衡, 为探讨香港牡蛎广盐适应性提供一定的实验数据和根据。

图7 ChAQP1与其它物种水通道蛋白的系统进化分析Fig.7 Phylogenetic analysis of ChAQP1 with AQP family members of other species置信水平通过在每个分支节点上进行1000次重复获得。标尺显示发生0.2%概率氨基酸位点变异的长度。序列信息由缩写名、物种全名和登录号构成。方框标示ChAQP1蛋白

图8 ChAQP1与其它物种AQP1的系统进化分析Fig.8 Phylogenetic analysis of ChAQP1 with AQP1 of other species
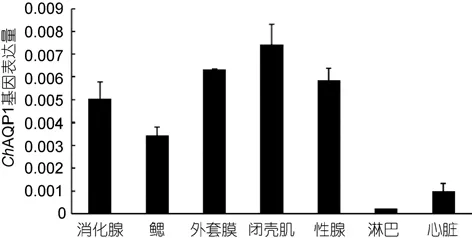
图9 ChAQP1 mRNA在不同组织表达量分布图Fig.9 Tissue distribution of ChAQP1 mRNA expression level每个bar代表平均值归一化的表达水平(n=3)
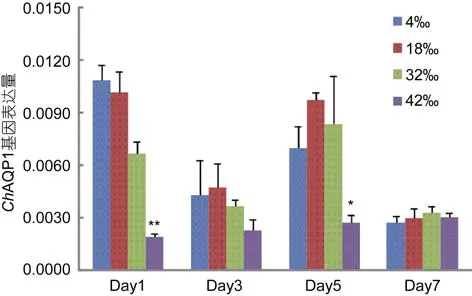
图10 7天盐度处理对ChAQP1基因表达的影响Fig.10 Relative expression level of ChAQP1 was analyzed under salinity stress in 7 days图中数据为平均值±S.E (n =5), 显著性差异用1个星号(P<0.05)和2个星号(P<0.01)标示
农业部渔业局, 2013. 中国渔业年鉴. 北京: 中国农业出版社
张跃环, 王昭萍, 闫喜武等, 2012. 香港巨牡蛎和长牡蛎幼虫及稚贝的表型性状. 生态学报32(4): 1105—1114
谢忠明, 2003. 海水经济贝类养殖技术. 北京: 中国农业出版社, 557—578
Agre P, Preston GM, Smith BLet al, 1993. Aquaporin CHIP: the archetypal molecular water channel. American Journal of Physiology-Renal Physiology, 265(4): F463—F476
Beitz E, Wu B H, Holm L Met al, 2006. Point mutations in the aromatic/arginine region in aquaporin 1 allow passage of urea, glycerol, ammonia, and protons. Proceedings of the National Academy of Sciences of the United States of America, 103(2): 269—274
Campbell E M, Ball A, Hoppler Set al, 2008. Invertebrate aquaporins: a review. Journal of Comparative Physiology B,178(8): 935—955
Giffard-Mena I, Boulo V, Aujoulat Fet al, 2007. Aquaporin molecular characterization in the sea-bass (Dicentrarchus labrax): The effect of salinity on AQP1 and AQP3 expression. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 148(2): 430—444
Huang C G, Lamitina T, Agre Pet al, 2007. Functional analysis of the aquaporin gene family inCaenorhabditis elegans.American Journal of Physiology-Cell Physiology, 292(5):C1867—C1873
Ishibashi K, Kondo S, Hara Set al, 2011. The evolutionary aspects of aquaporin family. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 300(3): R566—R576
Kyte J, Doolittle R F, 1982. A simple method for displaying the hydropathic character of a protein. Journal of Molecular Biology, 157(1): 105—132
Lam K, Morton B, 2003. Mitochondrial DNA and morphological identification of a new species ofCrassostrea(Bivalvia:Ostreidae) cultured for centuries in the Pearl River Delta,Hong Kong, China. Aquaculture, 228(1—4): 1—13
Meng J, Zhu Q H, Zhang L Let al, 2013. Genome and transcriptome analyses provide insight into the euryhaline adaptation mechanism ofCrassostrea gigas. PloS ONE, 8(3):e58563
Moon C, Preston G M, Griffin C Aet al, 1993. The human aquaporin-CHIP gene. Structure, organization, and chromosomal localization. The Journal of Biological Chemistry, 268(21): 15772—15778
Pieńkowska J R, Kosicka E, Wojtkowska Met al, 2014.Molecular Identification of First Putative Aquaporins in Snails. The Journal of Membrane Biology, http://dx.doi.org/10.1007/s00232-014-9629-0
Preston G M, Carroll T P, Guggino W Bet al, 1992. Appearance of water channels inXenopus oocytesexpressing red cell CHIP28 protein. Science, 256(5055): 385—387
Soto G, Alleva K, Amodeo Get al, 2012. New insight into the evolution of aquaporins from flowering plants and vertebrates: Orthologous identification and functional transfer is possible. Gene, 503(1): 165—176
Tamura K, Dudley J, Nei Met al, 2007. MEGA4: molecular evolutionary genetics analysis (MEGA) software version 4.0.Molecular Biology and Evolution, 24(8): 1596—1599
Tipsmark C K, Sørensen K J, Madsen S S, 2010. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation. The Journal of Experimental Biology, 213(3): 368—379
Yang B X, 2000. The human aquaporin gene family. Current Genomics, 1(1): 91—102
