非编码小RNA (RyhB)调控禽致病性大肠杆菌毒力相关基因的分析
2015-03-22祁克宗周秀红刘红梅张艳娜
尹 磊,祁克宗, 涂 健,周秀红,刘红梅,王 曼,张艳娜
(安徽农业大学动物科技学院,合肥 230036)
非编码小RNA (RyhB)调控禽致病性大肠杆菌毒力相关基因的分析
尹 磊,祁克宗*, 涂 健,周秀红,刘红梅,王 曼,张艳娜
(安徽农业大学动物科技学院,合肥 230036)
以小RNA(RyhB)为研究对象,探索RyhB对禽致病性大肠杆菌相关毒力基因的调控研究。采用Red同源重组技术构建APEC野生株(AE17)RyhB的缺失株△RyhB以及构建出回复株△RyhB-comp。运用活菌计数法分别观察AE17、△RyhB、△RyhB-comp黏附鸡胚成纤维细胞DF-1的能力,并且利用Real-time PCR检测AE17、△RyhB和△RyhB-comp的 8个毒力基因转录水平。结果成功构建出了基因缺失株△RyhB和回复株△RyhB-comp,△RyhB黏附细胞能力较AE17均有显著地降低,约为AE17的62.5%,△RyhB-comp较△RyhB黏附能力显著上升,为△RyhB的1.4倍。同时,Real-time PCR结果显示,△RyhB的bcfA、fyuA、tsh、luxS、fimC、ompA毒力基因的转录水平均极显著下降(P<0.01),其mRNA转录水平分别约为AE17的19%、52%、20%、14%、28%、52%;△RyhB的iss、ibeA毒力基因表达水平分别上调约1.14倍和1.2倍。表明RyhB的缺失能够减弱APEC黏附DF-1的能力,并且使毒力基因的转录水平有所降低。根据以上结果,推测RyhB对APEC的毒力具有极其重要的调节作用。
禽致病性大肠杆菌; 非编码小RNA;Red同源重组;RyhB;毒力基因
禽大肠杆菌病(avian colibacillosis)是由致病性大肠杆菌(pathogenicEscherichiacoli)引起的一种传染病,该病存在于世界各地的家禽群体中。临床表现为气囊炎、心包炎、肝周炎、脑炎、腹膜炎、脐炎、输卵管炎等症状,给养禽业的发展带来了严重的危害[1]。
非编码RNA (small non-coding regulatory RNA,sRNA),又称小RNA,是近年来新发现的一类基因调节子,其长度为40~500个核苷酸,在基因组中被转录,但是不编码蛋白质[2]。它是致病菌诸多调控网络的关键组成部分,致病菌进入宿主体内后感受到环境的改变,通过快速调整自身的毒力基因表达和生理特征来适应变化的环境,从而利于致病菌在宿主中的侵染和存活,对细菌致病性的调节发挥重要作用[3]。
RyhB是目前己知调控细菌靶mRNA数目最多的sRNA,它作为一种有效的调节分子,对细胞内铁代谢的调控和对致病菌致病力的调节具有重要作用[4-5]。RyhB最初是在大肠杆菌中发现的。随着研究的深入,在其他细菌中发现了许多与大肠杆菌RyhB同源的或者功能类似的小分子RNA。该类小分子RNA对细菌致病力的调节主要通过影响细菌铁代谢、生物膜生成、趋化性和耐酸性的方面来实现的[6-7]。霍乱弧菌和大肠杆菌同源性很高,其Fur和铁负调控RyhB[8-9],当RyhB基因缺失后,小鼠体内生物膜的形成和趋化性能力丧失,当加入铁后其能力又恢复[10-12]。所以RyhB本身不是毒力形成所必须的,而后两者是毒力决定因子。RyhB可抑制VirB来调控毒力,VirB是重要的毒力致病基因(ipa、mxi、spa)激活剂。对于寄居在肠道中的弗氏志贺菌,其毒力致病因子的表达是通过RyhB解除对VirB的抑制,从而有利于细菌在肠道的感染[13]。这些都表明RyhB的功能与细菌的毒力有关,但是RyhB与APEC毒力相关的靶mRNA,以及对APEC毒力的影响却还不清楚。
因此,本试验以sRNA(RyhB)为研究对象,通过Red重组系统构建RyhB的缺失株,并构建了可回复表达的回复株,以此来研究RyhB缺失对禽致病性大肠杆菌的毒力基因表达以及对细胞黏附能力的影响,为RyhB对禽致病性大肠杆菌毒力调控机制的研究提供理论依据。
1 材料与方法
1.1 试剂与试剂盒
PremixTaq、PrimeSTAR Max Premix(2x)、DNA Marker、DNA胶回收试剂盒、反转录试剂盒、质粒提取试剂盒、T4 DNA连接酶及限制性内切酶(EcoRⅠ、Hind Ⅲ)均购自大连宝生物公司;TransStart Top Green qPCR SuperMix、EasyPureTMRNA Kit购自北京全式金生物技术有限公司。
1.2 菌株与质粒
选取的同源重组出发菌株为经过分离鉴定的大肠杆菌AE17(从患有败血症的禽源分离,经传代培养,血清凝集试验以及一系列生化试验后,鉴定为O2血清型的大肠杆菌)。Red同源重组所用到的质粒:pKD46(同源重组的协助质粒,可在阿拉伯糖的诱导下表达3个λ噬菌体重组酶——Gam、Beta和Exo,具有温度敏感性,在温度高于37 ℃时会丢失);pKD3(氯霉素抗性基因PCR扩增模板,并且氯霉素抗性基因两端携带可被FLP重组酶识别的FRT位点);pCP20(温度敏感型,42 ℃可表达FLP重组酶,用于消除FRT位点间的氯霉素抗性基因)。以上质粒均为中国农业科学院上海兽医研究所禽病研究室惠赠。pSTV28用于构建回复质粒,购自大连宝生物公司。
1.3 禽致病性大肠杆菌缺失株△RyhB和回复株△RyhB-comp的构建
1.3.1 PCR引物的设计 根据GenBank中已发布的APEC O1型基因序列设计引物,对AE17、RyhB-IN、RyhB-OUT进行鉴定。根据测序结果设计用于red同源重组的引物RyhB-UP、RyhB-Down、PKD3-Cm-lap-RyhB,其中RyhB-lap-cm-UP和RyhB-lap-cm-Down下划线的序列与质粒pKD3-F、pKD3-R上的氯霉素抗性基因的序列互补,而PKD3-Cm-lap-RyhB下划线序列与RyhB-UP-R、RyhB-Down-F的基因序列互补。用于构建回复株的AE17-RyhB下划线分别为保护性碱基和酶切位点(EcoRⅠ、Hind Ⅲ)。引物序列见表1。
表1 用于基因敲除和回复的引物序列
Table 1 Primers used in the gene deletion and complemented
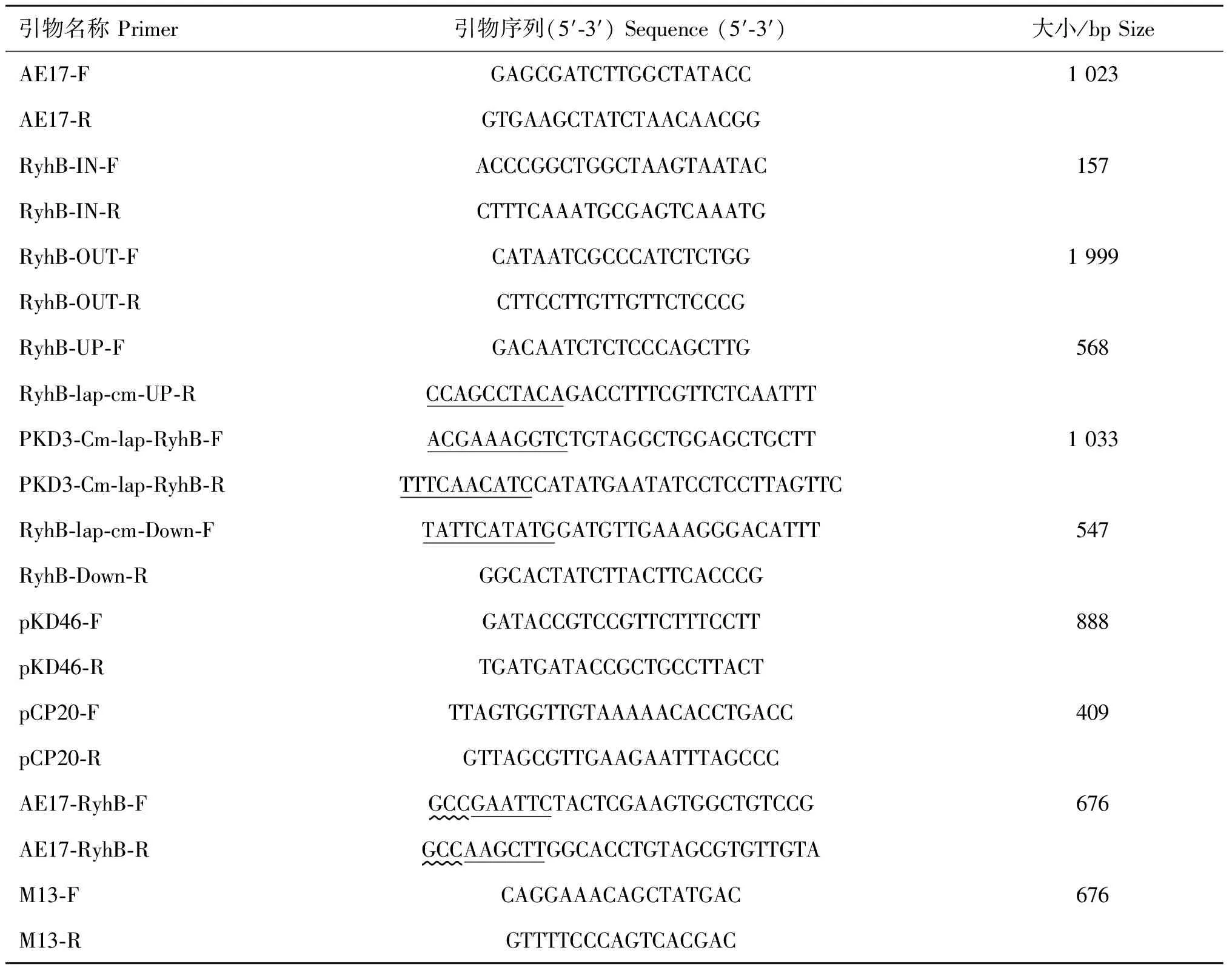
引物名称Primer引物序列(5′⁃3′)Sequence(5′⁃3′)大小/bpSizeAE17⁃FGAGCGATCTTGGCTATACC1023AE17⁃RGTGAAGCTATCTAACAACGGRyhB⁃IN⁃FACCCGGCTGGCTAAGTAATAC157RyhB⁃IN⁃RCTTTCAAATGCGAGTCAAATGRyhB⁃OUT⁃FCATAATCGCCCATCTCTGG1999RyhB⁃OUT⁃RCTTCCTTGTTGTTCTCCCGRyhB⁃UP⁃FGACAATCTCTCCCAGCTTG568RyhB⁃lap⁃cm⁃UP⁃RCCAGCCTACAGACCTTTCGTTCTCAATTTPKD3⁃Cm⁃lap⁃RyhB⁃FACGAAAGGTCTGTAGGCTGGAGCTGCTT1033PKD3⁃Cm⁃lap⁃RyhB⁃RTTTCAACATCCATATGAATATCCTCCTTAGTTCRyhB⁃lap⁃cm⁃Down⁃FTATTCATATGGATGTTGAAAGGGACATTT547RyhB⁃Down⁃RGGCACTATCTTACTTCACCCGpKD46⁃FGATACCGTCCGTTCTTTCCTT888pKD46⁃RTGATGATACCGCTGCCTTACTpCP20⁃FTTAGTGGTTGTAAAAACACCTGACC409pCP20⁃RGTTAGCGTTGAAGAATTTAGCCCAE17⁃RyhB⁃FGCCGAATTCTACTCGAAGTGGCTGTCCG676AE17⁃RyhB⁃RGCCAAGCTTGGCACCTGTAGCGTGTTGTAM13⁃FCAGGAAACAGCTATGAC676M13⁃RGTTTTCCCAGTCACGAC
1.3.2 禽致病性大肠杆菌缺失株△RyhB的构建
1.3.2.1RyhB同源重组片段构建:利用Red 同源重组的方法对AE17中的RyhB进行敲除构建。首先,用RyhB-UP-F、RyhB-lap-cm-UP-R和RyhB-lap-cm-Down-F、RyhB-Down-R以及PKD3-Cm-lap-RyhB-F、PKD3-Cm-lap-RyhB-R三对引物扩增出RyhB上游、下游同源臂及氯霉素抗性片段,进行胶回收。然后,运用Overlap的方法,将RyhB上下游同源臂及氯霉素抗性片段等摩尔混合,以此混合模板为DNA模板,用RyhB的上游引物(RyhB-UP-F)及下游引物(RyhB-Down-R)扩增,扩增出来的RyhB上游同源臂-cm-下游同源臂即为用于Red同源重组片段。
1.3.2.2 感受态细胞的制备和电转化:将电转化有pKD46的AE17菌株接种于2 mL LB液体培养基(氨苄青霉素质量浓度为100 mg·mL-1),28 ℃培养箱培养过夜作为种子液,次日按1∶100比例接种至100 mL LB培养基, 28 ℃振荡培养至 OD600 nm为0.2~0.3,加入L-阿拉伯糖至终浓度为20~30 mmol·L-1,继续培养至OD600 nm为0.5~0.6,使 pKD46充分表达Exo、Bet和Gam三个重组酶。50 mL离心管分装,冰浴20 min,4 ℃ 6 000 r·min-1离心5 min,弃培养基;然后用预冷的双蒸水重悬,4 ℃ 6 000 r·min-1离心5 min,重复洗涤2次;最后用预冷的10%甘油离心洗涤1次,最后用1/100体积的甘油重悬,浓缩成1 mL的感受态细胞,每管分装100 μL,存放在-70 ℃冰箱待用。
取制备好的100 μL感受态细胞与1 μg扩增出的RyhB上游同源臂-cm-下游同源臂PCR产物混匀,将混合物加入冰上预冷的0.2 cm Bio-Rad电击杯中进行电转化,电击条件为电压 2.5 kV,电阻200 Ω,脉冲25 μF,电击。电击后迅速加入900 μL 预热的SOC培养基,28 ℃培养1 h,常温6 000 r·min-1离心5 min,取200 μL SOC重悬后涂于氯霉素平板 (氯霉素34 μg·mL-1)。37 ℃培养24 h后,筛选阳性菌落,用RyhB-IN-F/RyhB-IN-R、RyhB-OUT-F/ RyhB-OUT-R两对引物进行阳性氯霉素重组子的鉴定,以确定AE17是否敲除了RyhB基因。
1.3.2.3 氯霉素抗性基因的消除:鉴定正确的阳性重组子按上述方法制成感受态细胞,将pCP20质粒电转化导入该感受态细胞中,涂布于含氨苄和氯霉素双抗性 LB 平板上,28 ℃过夜培养,筛选阳性转化子。然后将获得的阳性转化子接种于无抗性的LB培养基中,42 ℃培养过夜,热诱导 FLP 重组酶表达,通过重组删除 FRT位点间的序列,只保留一个 FRT位点,用RyhB-IN-F/RyhB-IN-R、RyhB-OUT-F/ RyhB-OUT-R进行PCR验证。
1.3.3 禽致病性大肠杆菌回复株△RyhB-comp的构建
1.3.3.1RyhB基因扩增:根据已发布的APEC O1型基因序列设计AE17-RyhB-F/AE17-RyhB-R引物,用PCR扩增出RyhB完整片段,胶回收目的片段待用。
1.3.3.2 RyhB-pSTV28回复质粒的构建:将1.3.3.1所得RyhB目的片段和pSTV28载体分别用EcoRⅠ和Hind Ⅲ双酶切,然后用T4连接酶连接,将连接产物转化至大肠杆菌DH5α感受态细胞中,氯霉素抗性平板筛选阳性克隆。
1.3.3.3 回复质粒的鉴定:挑单克隆接种含CM抗性的LB培养基,37 ℃摇床培养,采用菌液PCR的方法,以检测引物m13-F/m13-R扩增,电泳鉴定,以确定获得回复质粒pSTV28-RyhB。
1.3.3.4 回复株的构建:将回复质粒pSTV28-RyhB电击导入△RyhB,经CM抗性筛选获得回复株△RyhB-comp,用RyhB-OUT-F/RyhB-OUT-R和m13-F/m13-R两对引物进行鉴定。
1.4 qRT-PCR检测缺失株和回复株毒力基因转录水平的变化
1.4.1 引物的设计与合成 根据GenBank中已发布的内参基因dnaE,同时选取禽致病性大肠杆菌毒力基因bcfA、fyuA、tsh、iss、luxS、fimC、ompA、ibeA,用 Primer(Version 5.0)软件分析并设计特异性引物。引物序列见表2。
1.4.2 细菌总RNA的提取和cDNA的合成 挑取禽致病性大肠杆菌AE17、△RyhB和△RyhB-comp的单菌落,于液体培养基37 ℃过夜培养;第2天转接于相应的LB培养基或氯霉素抗性LB培养基培养至对数期,取适量的菌液,4 ℃、12 000 g离心2 min,收集菌液,彻底去除所有培养基上清,用含有溶菌酶的100 μL TE缓冲液(1 mg lysozyme溶于100 μL TE中)彻底重悬菌体。参照EasyPureTMRNA Kit说明书提取三组细菌的总RNA。核酸蛋白浓度测定仪检测RNA浓度,并用1%琼脂糖凝胶电泳检测RNA的完整性。釆用反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser消除提取产物中的基因组DNA并对RNA进行反转录。基因组DNA去除反应体系20 μL:5×gDNA Eraser Buffer 4.0 μL,gDNA Eraser2.0 μL,Total RNA 1.0 μg,RNase-free ddH2O补至20 μL。42 ℃水浴2 min后迅速置于冰上;反转录反应体系40 μL:PrimerScript RT Enzyme MIX 2.0 μL,RTprimer MIX 2.0 μL,5×PrimerScript Buffer2 8.0 μL,RNase-free ddH2O 8.0 μL,上一步除去DNA的总RNA 20.0 μL。37 ℃水浴 15 min后,85 ℃水浴5 s。将合成的cDNA保存于-20 ℃。1.4.3 qRT- PCR反应 采用TransStart Top Green qPCR SuperMix荧光定量试剂盒,用实时荧光定量PCR对APEC毒力基因的表达进行相对定量的检测。将各样品的cDNA 10倍系列稀释,反应体系20 μL:Forward Primer(10 μmol·L-1)0.4 μL,Reverse Primer(10 μmol·L-1)0.4 μL,2×TransStart Top Green qPCR SuperMix 10.0 μL,Passive Reference Dye(50×)0.4 μL,cDNA 1.0 μL,ddH2O 7.8 μL。扩增条件:50 ℃2 min,95 ℃预变性10 min;95 ℃变性15 s;60 ℃荧光信号采集1 min,循环次数40次,测试样品重复三管;熔解曲线分析并鉴定引物特异性:95 ℃15 s,60 ℃1 min,95 ℃15 s。数据采用2-△△CT法计算毒力基因mRNA的转录水平。
1.5 AE17、△RyhB、△RyhB-comp对DF-1细胞的黏附试验
1.5.1 细菌的培养和处理 将菌株AE17、△RyhB和△RyhB-comp接种于相应的LB培养基或氯霉素抗性LB培养基培养,振荡培养至对数期,离心收集菌体并用无菌PBS洗涤3~4次,最后用无抗生素DMEM营养液重悬细菌待用。
表2 用于荧光定量的引物序列
Table 2 Primers used in the Real time PCR

目标基因Gene引物名称Primer引物序列(5′—3′)Sequence(5′—3′)大小/bpSizednaEdnaE⁃FdnaE⁃RGATTGAGCGTTATGTCGGAGGCGCCCCGCAGCCGTGAT80luxSluxS⁃FluxS⁃RACGCCATTACCGTTAAGATGAGTGATGCCAGAAAGAGGGA81Tshtsh⁃Ftsh⁃RGCACGAACTGGGAAGTATGGAGGCATAGAAACCACCACCCC118ibeAibeA⁃FibeA⁃RTTGTTTTGGCGGAATGATGCATTGATTTTGCCGTTTCTTCT118Ississ⁃Fiss⁃RCCGACAGCAGTAACACCAAAGGTTCTGCACCGCCAACAAATT105ompAompa⁃Fompa⁃RTCCAGAGCAGCCTGACCTTCGCTGAGCCTGGGTGTTTCCT152Fimcfimc⁃Ffimc⁃RGCCGATGGTGTAAAGGATGGAACTTTCCCGATCCTGTGGC127fyuAfyuA⁃FfyuA⁃RTTGGCGACCAGGGTAAGAGCAGACCCGCAGTAGGCACGAT145bcfAbcfA⁃FbcfA⁃RTGACGCTGCCTGTTCTGTTTGCAGTCTTCCAGTTTGATGGTG136
1.5.2 DF-1细胞的培养和处理 将液氮中冻存的DF-1细胞取出在37 ℃水浴中溶解1~2 min,使其复温;迅速加入含10%胎牛血清和1%双抗的DMEM营养液,转接于细胞培养瓶中,于37 ℃、5%CO2、饱和湿度的条件下在细胞培养箱中进行复苏传代。当细胞状态良好并稳定时,接种于24孔细胞培养板中,每孔加入200 μL约含105个细胞悬液培养。在倒置显微镜下观察,当细胞长满孔底时,吸去培养基并用无菌PBS洗涤3~4次备用。
1.5.3 细胞黏附试验 将处理好的三组细菌以感染复数(multiplicity of infection,MOI)=200分别加入到DF-1细胞中,对照组加入等体积的无抗生素DMEM,每个菌株重复3孔。400 r·min-1低速离心5 min,使细菌沉降到孔底与细胞充分结合。37 ℃细胞培养箱中孵育1.5 h,无菌PBS洗5次,然后每孔加入200 μL 0.1% Triton X-100,室温下作用10 min,用于裂解细胞,取细胞液倍比稀释,用挂板计数法37 ℃培养过夜后进行细胞计数。
2 结 果
2.1 禽致病性大肠杆菌缺失株△RyhB的鉴定
将含氯霉素抗性基因的△RyhB-cat PCR产物电转入含质粒pKD46的AE17中,通过氯霉素抗性LB固体培养基筛选阳性克隆,挑取阳性菌接种LB液体培养基,运用PCR检测的方法鉴定缺失株△RyhB-cat是否构建成功。第一次重组后,以RyhB-IN-F/RyhB-IN-R为引物, AE17未扩增出目的片段;而以 RyhB-OUT-F/RyhB-OUT-R为引物,AE17扩增出2 875 bp大小的目的片段。将质粒pCP20导入一次重组菌,于28 ℃培养并筛选阳性克隆,将鉴定正确的阳性克隆接种于LB液体培养基,42 ℃过夜培养,消除质粒pCP20。运用PCR检测的方法鉴定缺失株△RyhB是否构建成功,结果如图1,其中以RyhB-IN-F/RyhB-IN-R为引物,第二次重组后,AE17未扩增出目的片段;而以 RyhB-OUT-F/RyhB-OUT-R为引物,第二次重组后,AE17扩增出1 842 bp大小的目的片段。
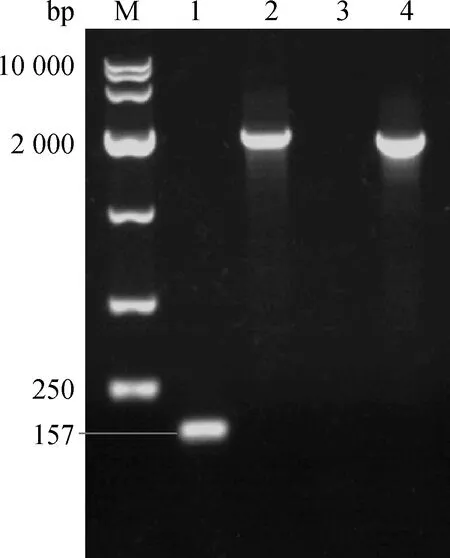
M.10 000 bp DNA相对分子质量标准;1.RyhB-IN-F/RyhB-IN-R PCR产物(157 bp);2.RyhB-OUT-F/RyhB-OUT-R PCR产物(1 999 bp);3.RyhB-IN-F/RyhB-IN-R,第二次重组产物;4.RyhB-OUT-F/RyhB-OUT-R,第二次重组PCR产物(1 842 bp)M.10 000 bp DNA marker;1.RyhB-IN-F/RyhB-IN-R PCR amplification(157 bp);2.RyhB-OUT-F/ RyhB-OUT-R PCR amplification (1 999 bp);3.RyhB-IN-F/RyhB-IN-R,the PCR amplification of second crossing over;4.RyhB-OUT-F/RyhB-OUT-R,the PCR amplification of second crossing over (1 842 bp) 图1 二次重组菌AE17△RyhB的PCR鉴定Fig.1 Identification of AE17△RyhB mutant by PCR
2.2 禽致病性大肠杆菌回复株△RyhB-comp的鉴定
将构建的回复质粒转化大肠杆菌DH5α感受态细胞,挑取转化子,提取质粒,将鉴定正确的回复质粒转化入相应的缺失株,挑取阳性转化菌株即为回复菌株。PCR检测方法鉴定回复株△RyhB-comp构建成功,如图2。
2.3RyhB调控毒力基因的表达量变化
内参基因和毒力基因的熔解曲线分析结果均具有良好的特异性,标准曲线的扩增效率均为95% 以上,可以运用2-△△CT法对毒力基因的转录水平进行分析。
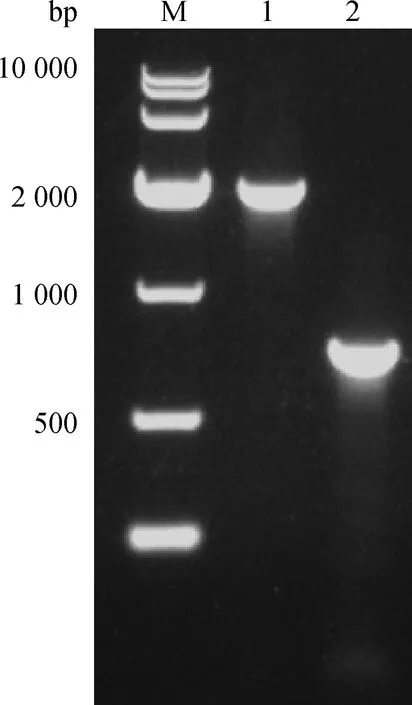
M.10 000 bp DNA相对分子质量标准;1.RyhB-OUT-F/ RyhB-OUT-R PCR产物(1 842 bp);2.m13-F/m13-R PCR产物(676 bp) M.10 000 bp DNA marker;1.RyhB-OUT-F/RyhB-OUT-R PCR amplification(1 842 bp);2.m13-F/m13-R PCR amplification (676 bp)图2 回复株△RyhB-comp的PCR鉴定Fig.2 Identification of △RyhB-comp by PCR
对AE17、△RyhB和△RyhB-comp毒力基因的mRNA转录分析显示,△RyhB的bcfA、fyuA、tsh、luxS、fimC、ompA毒力基因的转录水平均极显著下降(P<0.01),其mRNA转录水平分别约为AE17的19%、52%、20%、14%、28%、52%;△RyhB的iss、ibeA毒力基因表达水平上调,分别约为AE17的1.14倍和1.2倍。△RyhB-comp的bcfA、fyuA、tsh、luxS毒力基因的转录水平相比缺失株,其回复力和缺失株无明显差异(P>0.05);△RyhB-comp的iss、ibeA毒力基因的转录水平相比缺失株,其回复力极显著下降(P<0.01),分别为62%、64%;△RyhB-comp的fimC和ompA毒力基因的转录水平相比缺失株,其回复力极显著上升(P<0.01),分别为69%、48%(图3)。
2.4 DF-1细胞黏附试验
对DF-1细胞的黏附试验结果显示,AE17菌株对DF-1的黏附能力为24×105CFU·孔-1;△RyhB相比野生株,其黏附能力极显著减弱(P<0.01),为13×105CFU·孔-1;△RyhB-comp相比缺失株,其黏附能力显著恢复(P<0.05),为20×105CFU·孔-1(图4)。
3 讨 论
本试验基于λRed重组系统,由PCR反应介导的抗性基因片段与目的基因发生同源重组,用抗性基因替换染色体中的目的基因,该方法不需要构建打靶质粒,缩短了试验的周期。因其方法具有试验周期短、重组效率高、操作方便以及可以在任何位置进行点突变、缺失、插入等优点,所以逐渐成为探索基因功能的有效手段[14]。sRNA的长度一般为50~200 bp,一步敲除法往往很难成功,本试验中RyhB是177 bp大小的片段,使用一步法敲除重组效率低,未能成功,但使用二步敲除法,通过构建上下游同源臂与抗性基因片段连接,同源重组效率增强,成功构建了RyhB的敲除株,为研究sRNA功能提供了有力的工具。

图3 AE17、△RyhB和△RyhB-comp各毒力基因的mRNA转录水平Fig.3 The virulence genes mRNA levels of AE17,△RyhB和△RyhB-comp strains
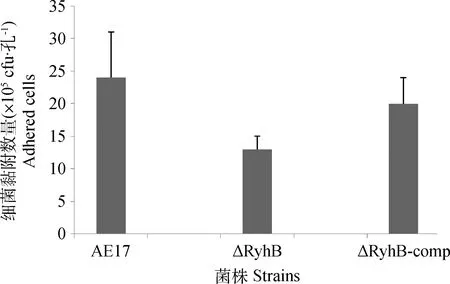
图4 AE17、△RyhB和△RyhB-comp对DF-1细胞的黏附试验Fig.4 DF-1 cells adherence assays of AE17、△RyhB和△RyhB-comp strains
毒力因子是指通过吸附在宿主细胞上,进而破坏宿主细胞代谢或阻挠宿主免疫反应来直接影响宿主,从而促进细菌本身生存、生长和传播的因子。本试验中选取的毒力因子包括密度感应系统、铁摄取调控系统、外膜蛋白、侵袭素、黏附素以及菌毛亚单位等,这些毒力因子都是APEC通过在宿主内黏附、侵袭、抗吞噬以及宿主细胞毒性来完成其致病过程所必需的。而研究表明,病原菌 sRNA在调控细菌代谢尤其是毒力基因的表达上具有十分重要的作用[15]。因此通过构建缺失株△RyhB和回复株△RyhB-comp,开展RyhB在APEC中的毒力相关基因的表达和细胞的黏附能力等方面的研究,其目的在于揭示RyhB对APEC毒力的影响,为防控疾病和开发sRNA核酸药物提供新的靶点。
Real-time PCR结果显示,△RyhB的毒力基因bcfA、fyuA、tsh、luxS、fimC、ompA表达水平均下调,推测RyhB可能通过调控外膜蛋白、黏附素相关因子、与摄铁相关因子、菌毛及其它未发现的病原相关基因的表达来影响细菌的毒力;DF-1细胞黏附试验结果表明△RyhB的黏附能力显著低于AE17,而△RyhB-comp的黏附能力相比较△RyhB有所回复。黏附素是存在于细菌表面的一些特殊结构的蛋白质,它通过与宿主细胞表面受体结合,避免被宿主清除体外,是病原菌重要的毒力因子之一。它与致病性密切相关。研究表明ompA和bcfA、fimC基因编码相关黏附因子,对细菌黏附宿主细胞的能力有一定的影响[16],推测ompA、bcfA、fimC基因转录水平的下降可能会导致APEC的黏附能力下降,与试验结果相一致。
综合试验结果,RyhB的缺失对APEC毒力的降低是显著的,提示低致病性、无抗性的RyhB缺失株是否可以作为新型疫苗,来防控APEC的感染还有待进一步的研究和探讨。同时,RyhB对细菌毒力的调控往往不是单方面的,它可能是多种毒力基因、调控系统同时作用;MicA在基因组中的位置与群体感应信号分子AL-2合成酶luxS毗邻,它是生物膜形成过程中十分重要的sRNA分子,其多种靶基因如phoP/Q二元调控系统和外膜蛋白ompA等均与生物膜的形成有关[17]。揭示了RyhB对APEC致病性调控的过程中,可能涉及了多个毒力基因,多个调控系统的共同作用,其与phoP/Q二元调控系统是否存在着必然的关系,共同调控APEC的致病性以及RyhB在致病菌调控网络中以何种机制触动其发挥作用,将是我们以后需要研究解决的问题。
4 结 论
成功构建禽致病性大肠杆菌的RyhB缺失株和回复表达株,RyhB的缺失能显著地降低禽致病性大肠杆菌毒力基因的转录水平和对DF-1细胞的黏附能力,为探明RyhB对禽致病性大肠杆菌毒力调控机制的研究提供理论依据。
[1] SCHOULER C,SCHAEFFER B,BRÉE A,et al.Diagnostic strategy for identifying avian pathogenicEscherichiacolibased on four patterns of virulence genes[J].JClinMicrobiol,2012,50(5):1673-1678.
[2] WASSARMAN K M,ZHANG A,STORZ G.Small RNAs inEscherichiacoli[J].TrendsMicrobiol,1999,7(1):37-45.
[3] WATERS L S,STORZ G.Regulatory RNAs in bacteria[J].Cell,2009,136(4):615-628.
[4] MASSÉ E,VANDERPOOL C K,GOTTESMAN S.Effect of RyhB small RNA on global iron use inEscherichiacoli[J].JBacteriol,2005,187(20):6962-6971.
[5] VECEREK B,MOLL I,BLSI U.Control of Fur synthesis by the non-coding RNA RyhB and iron-responsive decoding[J].EMBOJ,2007,26(4):965-975.
[6] MASSÉ E,GOTTESMAN S.A small RNA regulates the expression of genes involved in iron metabolism inEscherichiacoli[J].ProcNatlAcadSciUSA,2002,99(7) :4620-4625.
[7] WASSARMAN K M,REPOILA F,ROSENOW C,et al.Identification of novel small RNAs using comparative genomics and microarrays[ J ].GenesDev,2001,15(13):1637-1651.
[8] MEY A R,CRAIG S A,PAYNE S M.Characterization ofVibriocholeraeRyhB:the RyhB regulon and role of ryhB in biofilm formation[J].InfectImmun,2005,73(9):5706-5719.
[9] DAVIS B M,QUINONES M,PRATT J,et al.Characterization of the small untranslated RNA RyhB and its regulon inVibriocholerae[J].JBacteriol,2005,187(12):4005-4014.
[10] OGLESBY A G,MURPHY E R,IYER V R,et al.Fur regulates acid resistace in Shigella flexneri via RyhB and ydeP[J].MolMicrobiol,2005,58(5):1354-1367.
[11] WILDERMAN P J,SOWA N A,FITZGERALD D J,et al.Identification of tandem duplicate regulatory small RNAs in Pseudomonas aeruginosa involved in iron homeostasis[J].ProcNatlAcadSciUSA,2004,101(26):9792- 9797.
[13] MURPHY E R,PAYNE S M.RyhB,an iron-responsive small RNA molecule,regulates Shigella dysenteriae virulence[J].InfectImmun,2007,75(7):3470-3477.
[14] MUYRERS J P,ZHANG Y,STEWART A F.Techniques:Recombinogenic engineering-new options for cloning and manipulating DNA[J].TrendsBiochemSci,2001,26(5):325-331.
[15] GRIPENLAND J,NETTERLING S,LOH E,et al.RNAs:regulations of bacterial virulence[J].NatRevMicrobiol,2010,8(12):857-866.
[16] JONES C H,PINKNER J S,NICHOLES A V,et al.FimC is a periplasmic PapD-like chaperone that directs assembly of type 1 pili in bacteria[J].ProcNatlAcadSciUSA,1993,90(18):8397-8401.
[17] KINT G,DE C D,MARCHAL K,et al.The small regulatory RNA molecule MicA is involved inSalmonellaentericaserovar Typhimurium biofilm formation[J].BMCMicrobiol,2010,10:276.
(编辑 白永平)
Analysis of the Regulation of Small Non-coding RNA (RyhB) on Avian PathogenicEscherichiacoliVirulence-related Genes
YIN Lei,QI Ke-zong*,TU Jian,ZHOU Xiu-hong,LIU Hong-mei,WANG Man,ZHANG Yan-na
(CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei230036,China)
Taking small RNA(RyhB)as the object of study,the experiment explored the regulation ofRyhBon avian pathogenicEscherichiacoli(APEC) virulence-related genes.The Red homologous recombination method was used to construct theRyhBgene deletion strain (△RyhB) and the complemented strain (△RyhB-comp) by transforming the fusion plasmid pSTV28-RyhB into △RyhB.Viable bacteria counting method was used to evaluate the effects of AE17,△RyhB and △RyhB-comp on the capability of APEC to adhere and invade DF-1 cell.Their effects on the mRNA levels of the eight virulence genes were analyzed by Real-time PCR.The results showed that APEC strains △RyhB and △RyhB-comp were constructed successfully.The adherence of △RyhB was decreased by 62.5% compared to AE17,and that of △RyhB-comp was increased about 1.4 folds compared to △RyhB.Real-time PCR revealed that the transcription ofbcfA,fyuA,tsh,luxS,fimC,ompAgenes of △RyhB were decreased by 19%,52%,20%,14%,28% and 52%,respectively;while theissandibeAgenes were increased about 1.14 folds and 1.2 folds respectively.It showed that the deletion of RyhB can reduce the adhesive power of APEC to DF-1 cells and decrease the transcription of virulence genes.Our study demonstrates thatRyhBplays a very important role in regulating the virulence of APEC.
avian pathogenicEscherichiacoli;small non-coding RNA;Red recombination;RyhB;the virulence genes
10.11843/j.issn.0366-6964.2015.08.017
2014-11-24
国家自然科学基金项目(31372402)
尹 磊(1989-),男,安徽巢湖人,硕士,主要从事动物病理学研究,E-mail:ylshouhu1989@163.com
*通信作者:祁克宗,教授,E-mail:qkz@ahau.edu.cn
S852.612
A
0366-6964(2015)08-1409-08
