糖皮质激素激活自噬对软骨细胞衰老的影响*
2015-03-22薛恩兴陈成旺温州医科大学附属第二医院关节外科手术室浙江温州35000
薛恩兴,张 雪,陈成旺,张 宇(温州医科大学附属第二医院关节外科,手术室,浙江温州35000)
糖皮质激素激活自噬对软骨细胞衰老的影响*
薛恩兴1△,张雪2,陈成旺1,张宇1
(温州医科大学附属第二医院1关节外科,2手术室,浙江温州325000)
目的:探讨糖皮质激素对关节软骨细胞衰老和自噬影响,并分析自噬在其中的作用及机制。方法:培养SD大鼠软骨细胞,阿利辛染色和collagen II免疫组化进行鉴定。使用不同浓度的地塞米松作用于软骨细胞不同的时间后,LysoTracker Red和MDC染色观察自噬囊泡的生成,Western blot检测LC3、beclin-1、P62、p70S6K 和4EBP1蛋白表达的变化。β-半乳糖苷酶染色分析糖皮质激素对软骨细胞衰老的影响,并使用自噬抑制剂来探讨自噬对地塞米松作用下软骨细胞衰老的作用。结果:地塞米松可以显著提高软骨细胞的自噬水平,尤其是在作用4 d后,LC3-II表达随着地塞米松浓度的增加而升高,而P62和beclin-1的表达也验证自噬水平的升高。LysoTracker Red和MDC染色发现软骨细胞中自噬泡的生成随着地塞米松浓度的升高而增加。mTOR信号通路上的p70S6K和4EBP1的磷酸化均被地塞米松抑制。更重要的是,地塞米松可以引起软骨细胞的衰老,而使用3-MA抑制自噬后,细胞进一步衰老。结论:糖皮质激素激活软骨细胞中的自噬,并同时诱导软骨细胞的衰老,而自噬在这过程中对细胞的衰老可能具有代偿性的保护作用。同时糖皮质激素抑制mTOR信号通路,可能与自噬的激活相关。
糖皮质激素;软骨细胞;自噬;衰老
[ABSTRACT]AIM: To explore the effect of glucocorticoid on autophagy and senescence in the chondrocytes.METHODS: The collagen II in the normal chondrocytes isolated from the SD rats was checked.After stimulation with glucocorticoid,LysoTracker Red staining,MDC staining and Western blot were used to detect the level of autophagy in the chondrocytes.The mTOR pathway related molecules were investigated by Western blot.Cell senescence was analyzed by SA-β-gal staining.RESULTS: A dose-dependent increase in the number of autophagic vacuoles was observed in the dexamethasone-treated chondrocytes,which was demonstrated by the LysoTracker Red and MDC staining.The expression of LC3-II and beclin-1 was increased by dexamethasone,especially in the cells treated with dexamethasone for 4 d.However,P62 expression was decreased.SA-β-gal staining showed that the percentage of cell senescence was increased by dexamethasone.Surprisingly,the cell senescence induced by dexamethasone was exacerbated by the autophagic inhibitor 3-MA.CONCLUSION: Autophagy induced by dexamethasone protects chondrocyte from senescence.The mTOR pathway may be involved in the autophagy activation.
[KEY WORDS]Glucocorticoids; Chondrocyte; Autophagy; Senescence
骨关节炎是骨科常见的疾病,在美国25岁以上人群的骨性关节炎发病率约14%,每年近40万骨性关节炎患者住院[1]。临床上,局部关节腔内注射糖皮质激素可以明显缓解骨关节炎,具有显著的抗炎、止痛和减轻膝关节功能障碍的作用,但是长期、反复注射糖皮质激素又会干扰软骨细胞代谢,加速软骨细胞凋亡坏死,最终加重骨关节炎病情。骨关节炎是与年龄密切相关的疾病,细胞衰老是关节炎发生发展的重要参与因素,然而糖皮质激素对软骨细胞衰老的影响尚缺乏研究。
自噬被认为是软骨细胞的自我保护机制,且外源性激发自噬亦可以保护软骨细胞和关节软骨[2-3],但是糖皮质激素对软骨细胞自噬水平的调节作用,以及自噬对细胞衰老的具体作用仍然未知。本文拟使用地塞米松(dexamethasone,DEX)作用软骨细胞,并检测自噬与衰老指标以了解糖皮质激素对软骨细胞衰老和自噬的影响,以及自噬在其中所扮演的作用。
材料和方法
1实验试剂与材料
地塞米松、3-甲基腺嘌呤(3-methyladenine,3-MA)、胎牛血清和青/链双抗购自Sigma; DMEM-F12培养基、0. 25%胰蛋白酶、II型胶原酶和MDC荧光染料均购自Gibco;细胞裂解液、PMSF、SDS上样缓冲液、总蛋白提取和BCA蛋白分析试剂盒、SDS-PAGE凝胶配制试剂盒、PVDF膜和Lyso-Tracker Red试剂盒均购自江苏碧云天公司;兔抗鼠多克隆抗体、II型胶原、LC3、beclin-1、P62、p-p70S6K、p70S6K、p-4EBP1、4EBP1、β-actin购自CST;细胞培养瓶和多孔板购自Corning。
2关节软骨细胞培养和处理
30只雄性SD大鼠(3月龄,250~300 g),使用10%水合氯醛(3. 5 mL/kg)麻醉后安乐死。整体取出膝关节,在显微镜下分离膝关节软骨组织。首先使用0. 25%胰酶消化30 min,再使用0. 1% II型胶原酶在37℃消化软骨组织4 h,再使用200目的滤网过滤细胞。软骨细胞培养在25 cm2的培养瓶中,使用含有10%胎牛血清(fetal bovine serum,FBS)的高糖DMEM(1×105U/L青霉素、100 mg/L链霉素) 在5% CO2、37℃培养箱中进行培养。当细胞融合到80%~90%的时候,使用0. 25%的含EDTA的胰酶进行消化传代。本实验所有的细胞均为软骨细胞第2代。
在DEX处理之前,用1% FBS培养基处理12 h,按地塞米松浓度分为5组: 0 mg/L、0. 1 mg/L、1 mg/ L、25 mg/L、50 mg/L组,作用时间分别为2 d、4 d和6 d。3-MA与地塞米松混合分为4组:正常对照(control)组、3-MA(10 mmol/L)组、3-MA + DEX(25 mg/L)组和DEX。因为本实验所涉及的地塞米松是使用培养基和无水乙醇进行配置,以上对照组中,均加入1 mL/L的无水乙醇作为对照。
3实验方法
3.1LysoTracker Red染色细胞以2×105的密度铺在24孔板上,以上述不同浓度的地塞米松处理细胞4 d后。使用新鲜的培养基洗涤细胞3遍,使用培养基将LysoTracker Red稀释成66 mmol/L,滴加1 mL后,在37℃的培养箱中培养30 min。使用PBS洗涤3遍后,在倒置荧光显微镜下使用绿色滤光片观察细胞的染色情况。
3.2MDC染色在体外研究中,MDC是被广泛地用来标记细胞中自噬囊泡的水平。与LysoTracker Red染色相似,处理关节软骨细胞后使用PBS清洗3遍后,在不固定软骨细胞的情况下,使用0. 05 mmol/L MDC在37℃培养箱孵育30 min。PBS洗涤细胞3次,直接在倒置荧光显微镜下观察细胞,使用紫外激发光。为了观察细胞的自噬率,上述染色后的细胞再上流式细胞仪进行检测。
3.3Western blot将处理过的细胞用PBS洗涤,常规裂解提取蛋白,使用BCA试剂盒测算总蛋白浓度并制成蛋白样品。上样量为30 μg,总体积是20 μL,使用12%的分离胶分离蛋白后,将LC3目的蛋白转至0. 22 μm大小的PVDF膜上,而beclin-1、p62和内参照则转至0. 45 μm的膜上。300 mA恒流转膜,LC3转移20 min,beclin-1转移55 min,而P62转移90 min。5%脱脂奶粉室温封闭2 h。TBST洗涤3次,每次5 min。LC3、beclin-1和p62的I抗均1∶1 000稀释。膜洗净后放在I抗中,4℃摇床孵育过夜。再次使用TBST洗涤3次,取出膜后放置在II抗中,II抗使用5%脱脂奶粉稀释(1∶5 000),37℃室温2 h。取出膜后再使用上述方法洗涤。预先将ECL试剂A液、B液等体积混合,制成反应液后,滴加至PVDF膜上,使液体覆盖到整张膜。将滴加了发光液的膜转移至化学发光显像仪。
3.4β-半乳糖苷酶染色25 mg/L的地塞米松处理软骨细胞24 h、48 h和72 h,使用试剂盒中β-半乳糖苷酶的固定液在室温下固定15 min。PBS清洗3遍,使用β-半乳糖苷酶染液染色12 h,β-半乳糖苷酶染液含有1 g/L 5-溴-4-氯-3-吲哚半乳糖苷、5 mmol/L亚铁氰化钾、5 mol/L铁氰化钾、150 mmol/L氯化钠和2 mmol/L氯化镁。染色后在倒置显微镜下观察细胞,在200倍的放大情况下观察阳性细胞在总细胞中的百分比。
4统计学处理
全部数据以均数±标准差(mean±SD)表示,采用SPSS 16. 0软件进行统计学分析,组间差异比较采用单因素方差分析,两两之间比较用Turkey’s方法进行检测,以P<0. 05为差异有统计学意义。
结果
1软骨细胞的鉴定
在相差显微镜下观察,关节软骨细胞呈现多边形和星形,且细胞胞质中含有丰富的颗粒。甲苯胺蓝和阿利辛染色分别将细胞染成紫色和浅蓝色,这说明细胞中含有丰富的蛋白多糖,II胶原的免疫组化表明细胞中含有大量的II型胶原,并主要分布在细胞核周围,上述结果证明该细胞为能分泌蛋白多糖和II型胶原的关节软骨细胞,见图1。

Figure 1.The culture and identification of nucleus pulposus cells.A: the observation of the cells under phasecontrast microscopy; B: Toluidine blue staining; C: Alcian blue staining; D: immunochemistry for collagen II.图1 软骨细胞的培养和鉴定
2糖皮质激素促进关节软骨细胞中自噬泡合成
为了解糖皮质激素是否可以促进软骨细胞发生自噬,我们使用不同浓度的地塞米松作用软骨细胞4 d,并使用LysoTracker Red染色和MDC染色观察软骨细胞中的自噬泡。对照情况下,仅有少量的软骨细胞LysoTracker Red染色呈现阳性,但是随着地塞米松浓度的增大,呈LysoTracker Red染色阳性的细胞越来越多。在50 mg/L的地塞米松作用4 d后,大部分的软骨细胞的LysoTracker Red的染色呈阳性,说明地塞米松可以促进软骨细胞自噬泡的合成,见图2。
与LysoTracker Red染色相似,在正常对照组,只有少数细胞可以吸收MDC染色,因此只有少量细胞含有高亮的点状荧光,但是随着地塞米松浓度的增加,含有高亮点状自噬泡的软骨细胞逐渐增多。将MDC染色后的软骨细胞使用流式细胞仪进行检测,1 mg/L、25 mg/L和50 mg/L的地塞米松作用4 d后,自噬的发生率与对照组相比明显升高(P<0. 05)。在50 mg/L组,自噬的发生率平均为56. 74%,见图3。
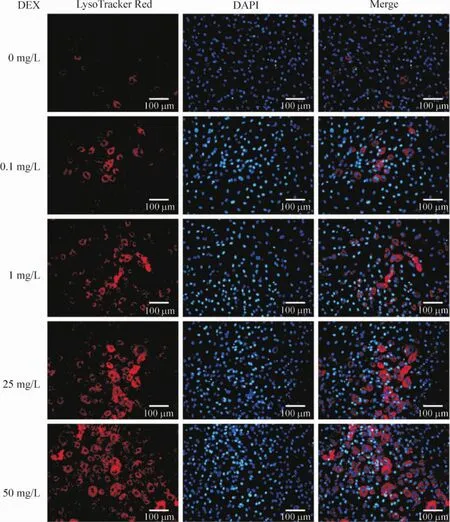
Figure 2.The LysoTracker Red staining of chondrocytes treated with dexamethasone at different concentrations.An dose-dependent increase in the intensity of LysoTracker Red staining in chondrocytes stimulated with dexamethasone was found.图2 软骨细胞的LysoTracker Red染色

Figure 3.The MDC staining and flow cytometry analysis of chondrocytes treated with dexamethasone.Mean±SD.n =3.*P<0. 05,**P<0. 01 vs 0 mg/L.图3 软骨细胞的MDC染色和流式细胞仪检测结果
3糖皮质激素上调自噬相关蛋白
为了进一步分析糖皮质激素对关节软骨细胞自噬的调节作用,我们使用Western blot法分析地塞米松作用软骨细胞后LC3、beclin-1和p62的表达水平。当地塞米松作用软骨细胞2 d后,不同组之间的LC3-II/β-actin的区别并不明显;但是在作用4 d后,LC3-II/β-actin的水平随着地塞米松剂量的增加明显升高;而在作用6 d后,高浓度(50 mg/L)地塞米松组的LC3-II/β-actin水平出现了一定的下降。而p62 和beclin-1表达的变化基本与LC3-II的变化一致,但p62在作用2 d的时候就已经随着地塞米松浓度的增加而逐渐的下降,见图4。
4糖皮质激素抑制mTOR信号通路
自噬的激活机制主要涉及到mTOR依赖和非mTOR依赖的信号通路,p70S6K和4EBP1是mTOR下游的信号分子。1 mg/L和25 mg/L的地塞米松作用后,p-p70S6K和p-4EBP1的表达水平相对于对照组明显降低,这说明在糖皮质激素的作用下,mTOR信号通路被抑制,见图5。
5糖皮质激素及自噬对软骨细胞衰老的作用
随着25 mg/L的糖皮质激素作用时间的延长,关节软骨细胞的β-半乳糖苷酶阳性率明显升高,作用72 h后最高。由于细胞的衰老,β-半乳糖苷酶阳性的细胞胞浆中染成蓝色。但是使用3-MA与地塞米松共同作用软骨细胞72 h,3-MA抑制自噬水平后,软骨细胞中β-半乳糖苷酶的阳性率相对于单纯糖皮质激素的明显升高,并且单纯的3-MA并没有引起阳性细胞的增多,见图6。
讨论
在本研究中,我们证实了糖皮质激素可以通过抑制mTOR信号通路激活关节软骨细胞中的自噬,同时糖皮质激素可以引起软骨细胞的衰老,而自噬对于糖皮质激素作用下的细胞的衰老具有一定的抑制作用,抑制自噬后,细胞的衰老反而加剧。
糖皮质激素被广泛地用于治疗骨关节炎引起的各种症状,但是长期、反复的使用往往带来各种不同的并发症[4-5],更重要的是糖皮质激素会引起软骨细胞的凋亡,阻止软骨细胞的生长和降低软骨细胞的活性[5-6]。软骨细胞凋亡会引起软骨中细胞数量的减少,并减少细胞外基质如蛋白多糖和II型胶原的合成的减少,因此软骨细胞的凋亡是骨关节炎发生发展的重要因素[7-8]。而自噬与凋亡相似,亦是程序性细胞死亡,虽然有研究报道糖皮质激素可以促进软骨细胞自噬[9],但是其具体作为以及激活机制尚不明确。

Figure 4.The expression of autophagy-related protein in chondrocytes treated with dexamethasone (DEX).Mean±SD.n =3.*P<0. 05,**P<0. 01 vs 0 mg/L.图4 软骨细胞中自噬相关蛋白的表达
自噬不仅与细胞的凋亡有密切关系,而且有减轻骨关节炎的作用[3]。自噬是细胞清除细胞中错构蛋白质和失去功能的细胞及大分子的一种必要的细胞维持自身稳态平衡的机制[10]。当细胞受到外界环境的刺激、处于应激状态或者是受到细菌的侵袭的时候,大多数哺乳动物的细胞质中会产生双层膜的结构,成为自噬体,自噬体将细胞质中的蛋白质和细胞器包绕起来,溶酶体结合形成自噬溶酶体,从而利用溶酶体中的酶将这些细胞器和蛋白质进行降解,为细胞提供能量和氨基酸,从而保护细胞[11]。在体外,软骨细胞中的自噬可以抑制细胞的凋亡,并且可以阻止IL-1β引起的细胞外基质的降解[12],而在体内研究中,不论是腹腔注射雷帕霉素还是关节腔内局部注射雷帕霉素来促进软骨细胞中的自噬水平,均可以缓解关节软骨退变的进展[2]。在本实验中,我们发现地塞米松可以显著地促进软骨细胞中的自噬水平,我们推测这可能是软骨细胞对地塞米松应激的一种代偿性作用。
激活自噬关键的“开关”往往是在mTOR复合物1中的mTOR分子,根据这一现象,自噬激活的通路也主要分为mTOR依赖性和mTOR非依赖性[13]。抑制mTOR后可以引起细胞中自噬的一系列过程。mTOR下游的信号分子主要为p70S6K和4EBP1。我们发现糖皮质激素可以显著抑制软骨细胞中p70S6K和4EBP1磷酸化水平,说明糖皮质激素激活软骨细胞中的自噬与其抑制mTOR信号通路有关。相似的是,治疗关节软骨的葡萄糖氨也是通过抑制mTOR信号通路激活自噬的[14]。这说明软骨细胞中mTOR信号通路可能是自噬激活的主要信号通路。
糖皮质激素可以引起多种细胞的生长阻滞并抑制细胞的活性,Poulsen等[15]发现糖皮质激素可以引起肌腱细胞的生长周期阻滞,并诱发细胞衰老,但是糖皮质激素是否可以引起软骨细胞的衰老目前仍然未见报道。当细胞生长发生停滞的时候,其既可以是静止状态也可以是细胞发生衰老。细胞发生衰老的时候,细胞扩增能力丧失但是细胞的体积仍然增大,导致衰老的细胞相对正常细胞更加肥大[16]。本研究中,我们发现地塞米松也可以促进关节软骨细胞的衰老,并且随着时间的延长作用更加明显。因为软骨细胞的衰老参与了骨关节炎的进展,因此长期使用糖皮质激素引起的软骨细胞的衰老可能是其引起关节软骨变性、坏死的作用机制之一。
自噬与细胞的衰老密切相关,但是目前关于两者之间的关系尚未有统一的意见。Kamalakannan等[17]发现自噬可以阻止热休克蛋白引起的单核细胞衰老,但是在肺支气管上皮细胞中,自噬又介导了氧化应激引起的细胞衰老。而在关节软骨细胞中,我们使用3-MA抑制自噬水平发现细胞的衰老反而进一步加重,这说明糖皮质激素作用下细胞自噬可能是代偿性延缓细胞衰老。
总之,本实验发现糖皮质激素不仅可以通过抑制mTOR信号通路激活软骨细胞自噬,而且会诱发细胞衰老,并且自噬具有延缓细胞衰老作用,这或许为临床上防治糖皮质激素的并发症提供新的思路。
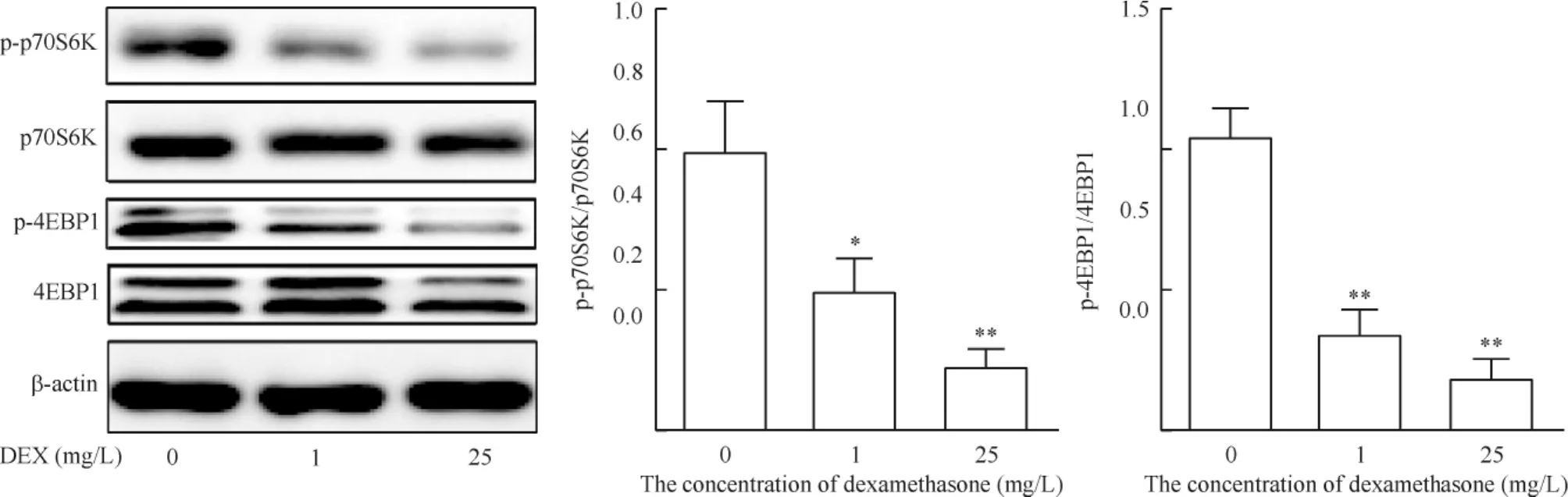
Figure 5.The protein levels of mTOR pathway molecules in the chondrocytes treated with dexamethasone (DEX).Mean±SD.n =3.*P<0. 05,**P<0. 01 vs 0 mg/L.图5 糖皮质激素对软骨细胞mTOR信号通路的作用
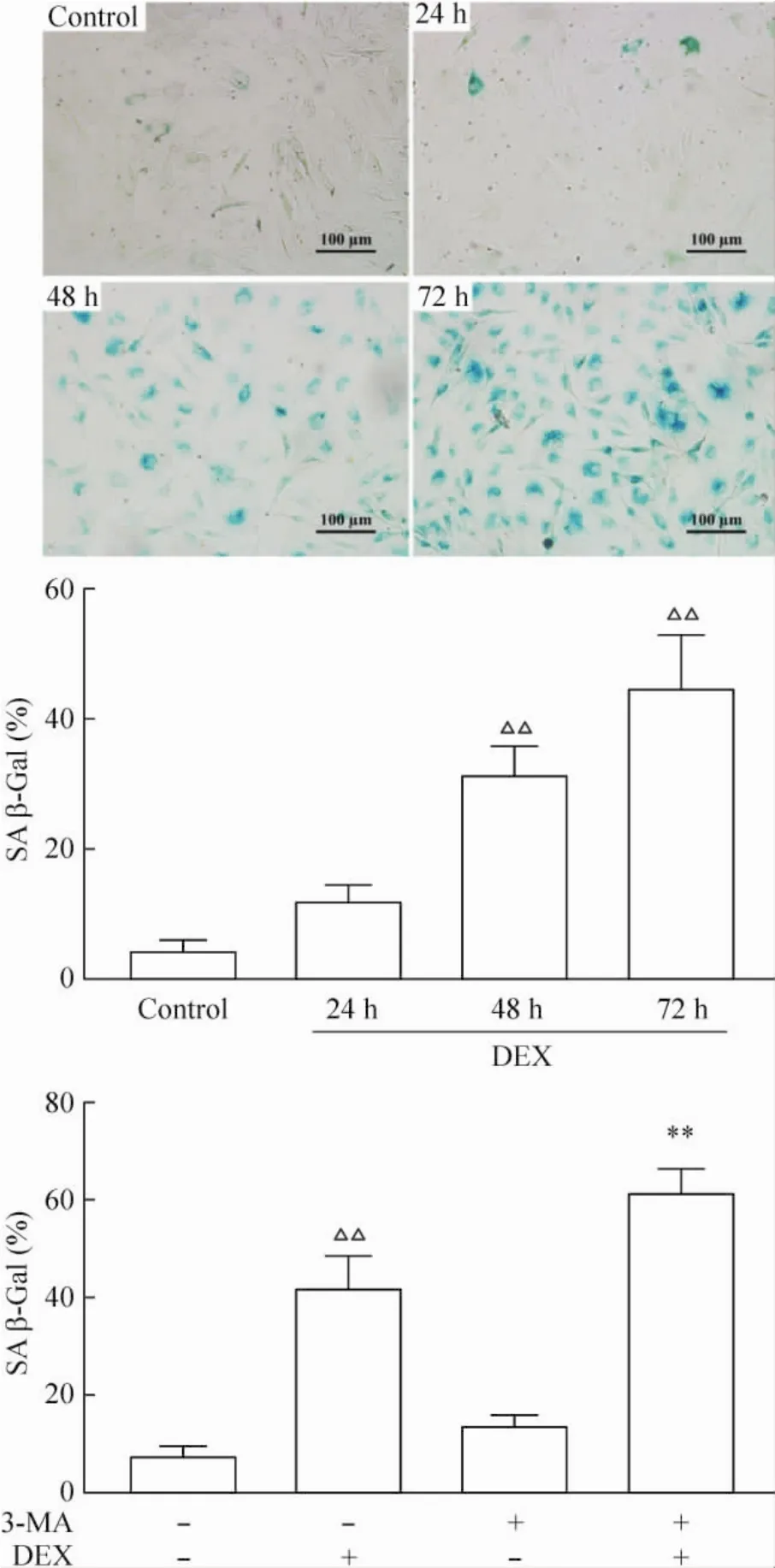
Figure 6.β-galactosidase (β-Gal) staining of chondrocytes treated with glucocorticoids and/or 3-MA.Mean±SD.n =3.△△P<0. 01 vs control;**P<0. 01 vs DEX.图6 软骨细胞的β-半乳糖苷酶染色
[1]Hunter DJ,Altman RD,Cicuttini F,et al.OARSI clinical trials recommendations: knee imaging in clinical trials in osteoarthritis[J].Osteoarthritis Cartilage,2015,23 (5) : 698-715.
[2]Takayama K,Kawakami Y,Kobayashi M,et al.Local intra-articular injection of rapamycin delays articular cartilage degeneration in a murine model of osteoarthritis[J].Arthritis Res Ther,2014,16(6) : 482.
[3]López de Figueroa P,Lotz MK,Blanco FJ,et al.Autophagy activation and protection from mitochondrial dysfunction in human chondrocytes[J].Arthritis Rheumatol,2015,67(4) : 966-976.
[4]Tu Y,Xue H,Francis W,et al.Lactoferrin inhibits dexamethasone-induced chondrocyte impairment from osteoarthritic cartilage through up-regulation of extracellular signal-regulated kinase 1/2 and suppression of FASL,FAS,and Caspase 3[J].Biochem Biophys Res Commun,2013,441(1) : 249-255.
[5]Zaman F,Chrysis D,Huntjens K,et al.Dexamethasone differentially regulates Bcl-2 family proteins in human proliferative chondrocytes: role of pro-apoptotic Bid[J].Toxicol Lett,2014,224(2) : 196-200.
[6]Hong D,Chen HX,Yu HQ,et al.Quantitative proteomic analysis of dexamethasone-induced effects on osteoblast differentiation,proliferation,and apoptosis in MC3T3-E1 cells using SILAC[J].Osteoporos Int,2011,22 (7) : 2175-2186.
[7]Aigner T,Hemmel M,Neureiter D,et al.Apoptotic cell death is not a widespread phenomenon in normal aging and osteoarthritis human articular knee cartilage: a study of proliferation,programmed cell death (apoptosis),and viability of chondrocytes in normal and osteoarthritic human knee cartilage[J].Arthritis Rheum,2001,44(6) : 1304-1312.
[8]叶志强,张荣凯,陈郁鲜,等.Egr-1介导了IL-1β诱导的小鼠软骨细胞凋亡[J].中国病理生理杂志,2012,28(8) : 1482-1487.
[9]Zhao Y,Zuo Y,Huo HJ,et al.Glucocorticoid induced autophagy in N1511 chondrocyte cells[J].Eur Rev Med Pharmacol Sci,2014,18(23) : 3573-3579.
[10]Wu X,Won H,Rubinsztein DC.Autophagy and mammalian development[J].Biochem Soc Trans,2013,41(6) : 1489-1494.
[11]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1) : 27-42.
[12]Sasaki H,Takayama K,Matsushita T,et al.Autophagy modulates osteoarthritis-related gene expressions in human chondrocytes[J].Arthritis Rheum,2011,64(6) : 1920-1928.
[13]Alayev A,Holz MK.mTOR signaling for biological control and cancer[J].J Cell Physiol,2013,228 (8) : 1658-1664.
[14]Carames B,Kiosses WB,Akasaki Y,et al.Glucosamine activates autophagy in vitro and in vivo[J].Arthritis Rheum,2013,65(7) : 1843-1852.
[15]Poulsen RC,Watts AC,Murphy RJ,et al.Glucocorticoids induce senescence in primary human tenocytes by inhibition of sirtuin 1 and activation of the p53/p21 pathway: in vivo and in vitro evidence[J].Ann Rheum Dis,2014,73(7) : 1405-1413.
[16]Muller M.Cellular senescence: molecular mechanisms,in vivo significance,and redox considerations[J].Antioxid Redox Signal,2009,11(1) : 59-98.
[17]Kamalakannan V,Shiny A,Babu S,et al.Autophagy protects monocytes from wolbachia heat shock protein 60-induced apoptosis and senescence[J].PLoS Negl Trop Dis,2015,9(4) : e0003675.
(责任编辑:陈妙玲,余小慧)
Effect of glucocorticoid induced autophagy on senescence in chondrocytes
XUE En-xing1,ZHANG Xue2,CHEN Cheng-wang1,ZHANG Yu1
(1Department of Joint Surgery,2Operating Room,Second Affiliated Hospital of Wenzhou Medical University,Wenzhou 325000,China.E-mail: xueenxing@163.com)
R363; R339. 3+8
A
10.3969/j.issn.1000-4718.2015.10.002
1000-4718(2015)10-1737-07
2015-04-20
2015-06-05
温州市科技局项目(No.Y20140582)
△Tel: 0577-88002808; E-mail: xueenxing@163.com
