8种湿地植物的生长状况及泌氧能力*
2015-03-20林剑华麦晓蓓
林剑华,杨 扬,2,李 丽,麦晓蓓
(1:暨南大学水生生物研究中心,广州 510632;2:暨南大学热带亚热带水生态工程教育部工程研究中心,广州 510632)
8种湿地植物的生长状况及泌氧能力*
林剑华1,杨 扬1,2**,李 丽1,麦晓蓓1
(1:暨南大学水生生物研究中心,广州 510632;2:暨南大学热带亚热带水生态工程教育部工程研究中心,广州 510632)
湿地植物是人工湿地的核心部分,筛选优良的植物种类,将有利于充分发挥湿地植物的功能,提高人工湿地污水处理的能力.分析4种须根型植物香蒲(Typhaorientalis)、美人蕉(Cannaindica)、灯芯草(Juncuseffusus)、纸莎草(Cyperuspapyrus)和4种根茎型植物菖蒲(Acoruscalamus)、再力花(Thaliadealbata)、芦竹(Arundodonax)、黄菖蒲(Irispseudacorus)在厌氧、水培条件下的生长状况及根系泌氧特性;比较它们的根和茎叶生物量、相对生长速率(RGR)、根长、根孔隙度和泌氧量(率)等生理生态特性.结果表明,8种湿地植物在厌氧条件下生长状况良好;其中,须根型植物的生物量、RGR和泌氧能力均显著优于根茎型植物.在相同光照条件下,灯芯草的泌氧率最大,为192.62μmol O2/(d·g (DWroot)),而黄菖蒲的根系泌氧率最小,仅为68.81μmol O2/(d·g(DWroot)).各植物根系泌氧率大小为:灯芯草>纸莎草>香蒲>美人蕉>菖蒲>再力花>芦竹>黄菖蒲.方差分析显示:植物根系泌氧率与根孔隙度呈极显著正相关,而植物泌氧量与RGR、各生物量呈极显著正相关,但与根茎比呈显著负相关.
湿地植物;须根型;根茎型;厌氧条件;生长状况;根系泌氧
人工湿地是由植物、微生物、基质和动物等构成的复合生态系统,由于人工湿地在污水处理中具有低成本、低运行费用、高效率、管理方便和美观等特点,已被用来处理城市生活污水、矿山废水和养殖废水等,其应用前景越来越广泛[1].而湿地植物是其中的重要组成部分,它可以通过直接吸收利用污水中可利用态的营养物质、吸附和富集重金属及一些有毒、有害物质,从而达到净化水质的作用.
人工湿地间歇或长期渍水条件,导致湿地土壤氧化还原电势降低,还原物质积累进而会对植物产生毒害作用,严重影响植物生长[2].湿地植物根部泌氧能力发达[3],能在根区形成好氧、微好氧和厌氧区,为微生物提供各种适宜的微环境[4],进而加强人工湿地对污水的净化能力[5].研究胁迫条件下的植物生理,有助于对湿地植物的选择,为维持植物的正常生长提供依据[6].
不同湿地植物生理生态条件尤其是根部的生长状况直接影响着植物在湿地条件下的泌氧能力,对其构成的人工湿地净化污水的效果差异显著.目前,对湿地植物自然状态下的根系泌氧能力研究较多,但由于人工湿地长期处于厌氧环境[7],且植物根系在不同的溶氧状态,植物的泌氧量和泌氧方式有很大区别[8],因此,研究湿地植物在厌氧条件下的生长状况和泌氧能力对指导人工湿地生态工程的设计具有重要意义.此外,现有的研究主要集中在芦苇等少数几个物种上,虽然具有一定的代表性,但从物种多样性方面不能满足实际人工湿地的需求.因此,本研究结合华南地区条件,选择国内外常用的8种代表性湿地植物,采用静态水培法,模拟人工湿地中的厌氧环境,考察不同湿地植物的生长状况及泌氧能力的差异,为湿地系统的构建筛选优良的湿地植物,对进一步提高湿地系统对污水的净化能力有实际应用价值.
1 材料与方法
1.1 湿地植物的选择
实验选用8种常见的湿地植物为供试植物:分别为菖蒲(Acoruscalamus)、香蒲(Typhaorientalis)、再力花(Thaliadealbata)、芦竹(Arundodonax)、纸莎草(Cyperuspapyrus)、灯芯草(Juncuseffusus)、美人蕉(Cannaindica)和黄菖蒲(Irispseudacorus),所选植物依据文献[9-10]可分为根茎型(菖蒲、再力花、芦竹和黄菖蒲)和须根型(香蒲、美人蕉、灯芯草和纸莎草),所选植物均具有较发达的根系,且对常规污染物均具有较高的耐受能力和去除能力,植物幼苗取自广州花博园某苗圃.
1.2 实验系统的构建和运行
1.2.1 植物驯化 植物幼苗取回后首先将其根部用去离子水清洗干净,用剪刀小心剪去老根,然后移入盛有清水的桶中,每隔1h曝气1次,每次曝气30min,曝气2d.随后移入含1/2浓度的Hoagland培养液中预培养1周,待长出新根后开始实验[11].
1.2.2 实验设计 为了模拟人工湿地渍水条件下的缺氧环境,采用20L的黑色塑料培养箱(长×宽×高:40cm×25cm×30cm),加入1/2浓度的Hoagland培养液16L,营养液用N2吹脱,使其溶解氧浓度低于0.9mg/L,然后按0.1%(W/V)的比例加入琼脂溶液[12].因琼脂能阻止溶液的对流运动,能模拟淹水土壤中的气体组成变化,如O2减少、乙烯增加等[13-14].
挑选长势良好、大小均匀的植物幼苗(株高约20cm),移栽至培养箱(培养箱由塑料挡板均分成4个独立的区室)中,并以黑色泡沫板固定于液面(黑色泡沫板覆盖液面);每个塑料箱的各个区室分别种植1棵植物,每种植物4个平行.培养箱随机摆放于玻璃温室中,室内温度控制在白天(7:00-19:00)为25±1℃,夜晚为18±1℃.每周更换1次无氧琼脂营养液,实验周期为30d.实验结束后,记录所有植物的最大根长、并在55℃条件下,将植物烘至恒重,测定根和茎叶的干重.
1.3 根系泌氧量(率)的测定
湿地植物根部的泌氧量均利用柠檬酸钛比色法测定和计算.通过柠檬酸钛浓度与吸光度的标准曲线计算出各实验组的柠檬酸钛浓度后,分别用以下公式计算泌氧量,根系泌氧测定的全过程均在无氧的操作箱中进行[15-17].
ROL=c(y-z)
(1)
RROL=c(y-z)/g
(2)
式中,ROL为泌氧量(μmol O2/(株·d)),RROL为泌氧率(μmol O2/(d·g (DWroot))),c为加入每个试管的柠檬酸钛的起始体积(L),y为对照组柠檬酸钛溶液的浓度(μmol/L),z为放入植物6h后柠檬酸钛溶液的浓度(μmol/L),g为用于测定泌氧的根系干重(g).
1.4 根孔隙度的测定
测定泌氧之后每株植物选择大约0.6~0.8g鲜根,切成50mm的小段,利用比重瓶法[15]测定鲜根的孔隙度.即将植物鲜根在水下抽真空后,比较前后重量的变化.根的孔隙度(POR)计算公式为:
POR(%)=(m比重瓶+抽真空后鲜根-m比重瓶+鲜根)/[(m比重瓶+m鲜根)-m比重瓶+鲜根]×100
(3)
式中,m鲜根为鲜根的重量(g),m比重瓶为装水的比重瓶的重量(g),m比重瓶+鲜根为装水的比重瓶加鲜根的重量(g),m比重瓶+抽真空后鲜根为装水的比重瓶加抽真空后的鲜根的重量(g).
1.5 湿地植物生物量的测定
实验结束后,用清水将植物清洗干净,用剪刀将植物的根与茎叶部分分开,分别装入洁净的牛皮纸信封,做好标记,并在55℃条件下,将植物烘至恒重后称其干重,精确至0.01g.
1.6 湿地植物相对生长速率的测定
在比较不同湿地植物生长速率时,由于植物本身的大小会显著影响实验结果的可比性,为了充分体现不同大小的植株的生长程度,通常用相对生长速率(RGR,d-1)来衡量植物的生长状况[18].
RGR=(lnW2-lnW1)/t
(4)
式中,W1为第1次测定时的植物干重(g),W2为第2次测定时的植物干重(g),t为2次测定的时间间隔.
1.7 数据计算与分析
运用软件SPSS 18.0和Microsoft Excel 2010计算平均值和标准差,并用Origin 8.5软件生成图表.采用One-Way ANOVA和LSD检验(双尾)进行种间比较的方差分析及差异性分析.
2 结果与分析
2.1 湿地植物的生长状况
厌氧水培条件下,8种湿地植物均能正常生长,其中,须根型植物香蒲、美人蕉、灯芯草和纸莎草在4周的培养中长势良好,生长旺盛(表1),单株植物的总生物量分别达到1.91、2.10、1.17、1.23g;而根茎型植物再力花、黄菖蒲、菖蒲和芦竹在培养中生物量总体上比须根型植物小,其单株植物总生物量分别为1.09、0.91、0.66、0.67g.4种须根型植物的总生物量平均达到1.60g,而4种根茎型植物的总生物量平均为0.83g,两类根系植物总生物量差异显著(P=0.024).
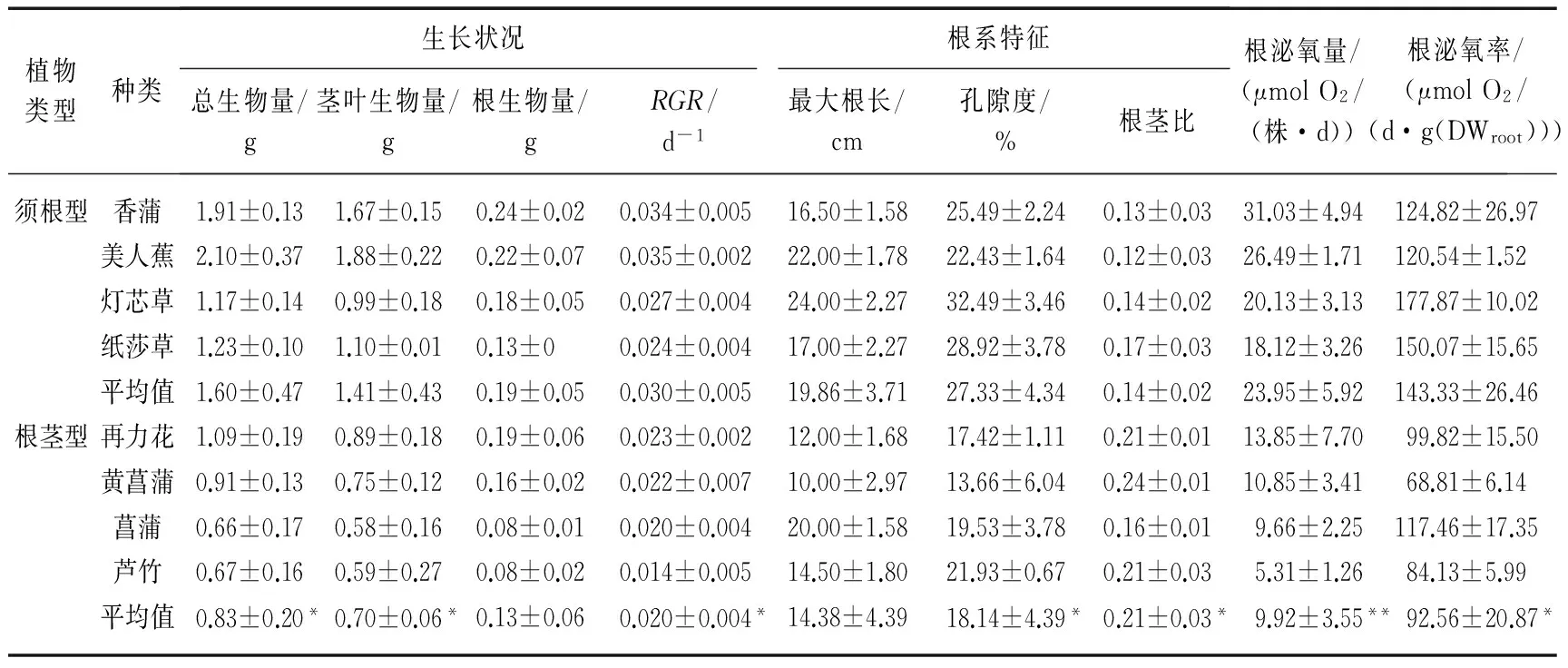
表1 须根型与根茎型湿地植物的生长状况、根系特征以及根泌氧量和泌氧率
*表示差异显著,P<0.05,**表示差异极显著,P<0.01.
从植物的RGR来看,须根型植物香蒲、美人蕉、灯芯草和纸莎草在4周的培养中长势较快,其RGR分别达到0.034、0.035、0.027、0.024d-1.而根茎型植物再力花、黄菖蒲、菖蒲和芦竹在培养中生长总体上比须根型植物慢,其RGR仅分别为0.023、0.022、0.020、0.014d-1.4种须根型植物的RGR平均达到0.030d-1,而4种根茎型植物的RGR平均为0.020d-1,两类根系植物RGR差异显著(P=0.022).
在4周的培养中,8种植物的根系生长情况不同,美人蕉和香蒲在厌氧培养中根系较发达,产生了大量不定根,而灯芯草和纸莎草由于大量分蘖产生较多不定根,黄菖蒲、菖蒲和芦竹的长势良好.再力花的根系也较发达,但有部分根出现腐烂死亡,这可能与其耐淹能力较差有关.总体上,须根型植物的根系较根茎型植物的根系发达.根生物量大小表现为香蒲>美人蕉>再力花>灯芯草>黄菖蒲>纸莎草>菖蒲≈芦竹.须根型植物单株根系的平均生物量为0.19g,根茎型植物单株根系的平均生物量为0.13g,两者间的差异不显著(P=0.132).
2.2 湿地植物的根系特征
8种湿地植物在厌氧水培条件下的最大根长各不相同,须根型植物的最大根长普遍较长,其中,美人蕉和灯芯草的最大根长最长,分别达到22.00和24.00cm,其次是纸莎草,而香蒲的最大根长最短,为16.50cm(表1).而根茎型植物中除了菖蒲的最大根长为20.00cm外,其它3种湿地植物的最大根长均小于15cm,总体而言,须根型植物的最大根长比根茎型植物长,8种植物的最大根长大小排序为灯芯草>美人蕉>菖蒲>纸莎草>香蒲>芦竹>再力花>黄菖蒲.4种须根型植物的平均最大根长为19.86cm,根茎型植物的平均最大根长为14.38cm,2种类型植物的最大根长之间差异不显著(P=0.104).
2种类型湿地植物的孔隙度之间的差异与最大根长不同,须根型湿地植物的孔隙度平均为27.33%,根茎型湿地植物的平均孔隙度为18.14%,两者间的差异显著(P=0.016)(表1).8种植物中孔隙度最高的是灯芯草,达到32.49%,其它3种须根型湿地植物香蒲、美人蕉和纸莎草的孔隙度也分别达到25.49%、22.43%和28.92%.而根茎型湿地植物中孔隙度最大的是芦竹,为21.93%,其次分别是菖蒲(19.53%)、再力花(17.42%)和黄菖蒲(13.66%).
从地上部分和地下部分的关系来看,实验中根茎型湿地植物的根生物量与地上部分生物量的比值(0.21)是须根型植物相应值(0.14)的1.5倍,两者间差异显著(P=0.020).
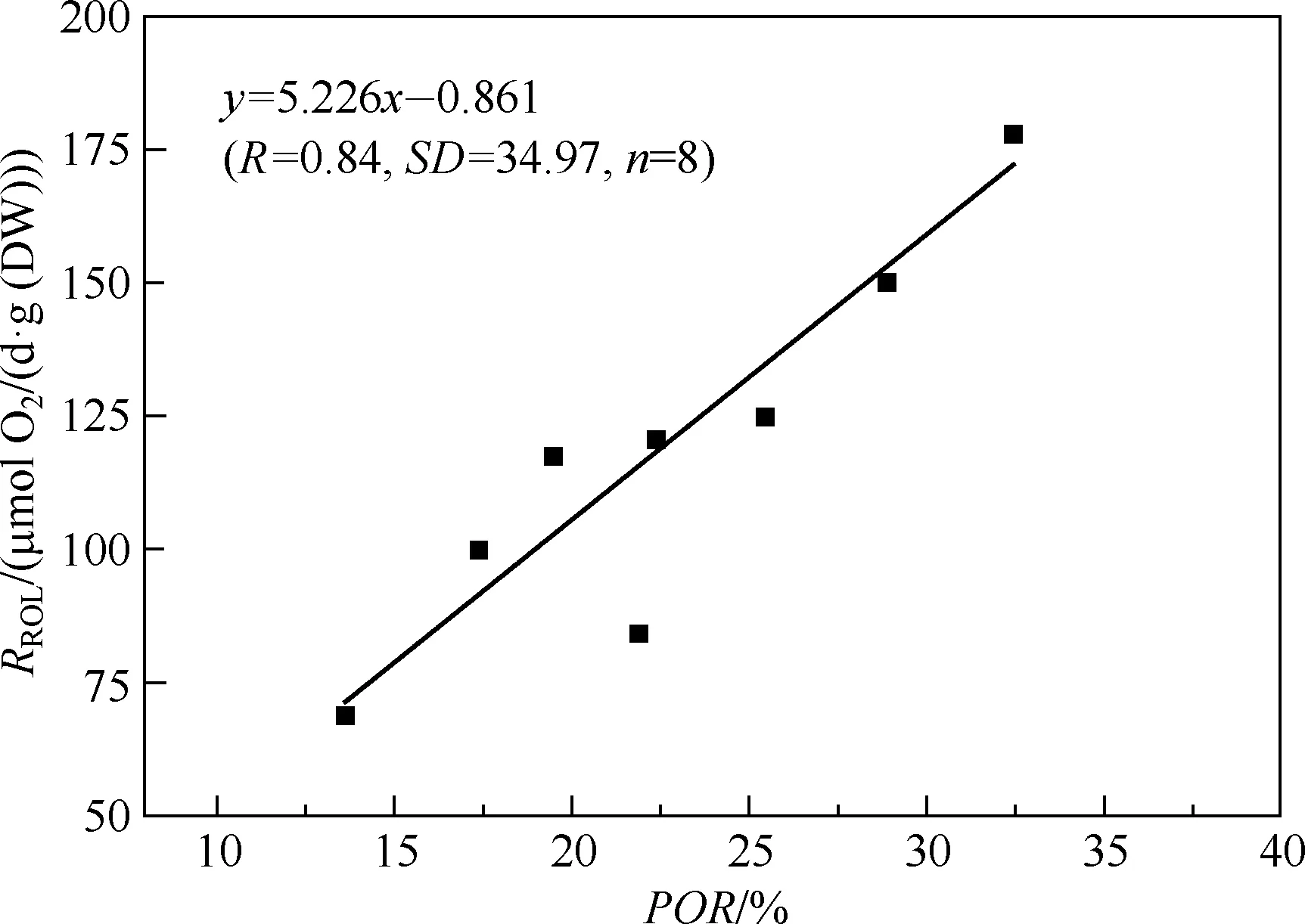
图1 孔隙度与泌氧率相关性分析Fig.1 The correlation coefficient between POR and RROL
2.3 湿地植物的根系泌氧量(率)
8种湿地植物在相同光照条件下,其根系泌氧量(率)各不相同.4种须根型湿地植物泌氧率的平均值为143.33μmol O2/(d·g(DWroot)),而4种根茎型湿地植物泌氧率的平均值仅为92.56μmol O2/(d·g(DWroot)),两者间的差异显著(P=0.024)(表1).从整株植物的根系泌氧总量来看,香蒲、美人蕉由于其根部生物量较大、同时其根系泌氧率较高,因此,其单株植物泌氧量最大;而芦竹由于根生物量较小,且泌氧率相对较低,其单株植物的泌氧量最低.各种实验植物的根泌氧量按大小排序表现为香蒲>美人蕉>灯芯草>纸莎草>再力花>黄菖蒲>菖蒲>芦竹(表1).须根型植物根系的平均泌氧量为23.95μmol O2/(株·d),根茎型植物根系的平均泌氧量为9.92μmol O2/(株·d),两者间的差异极显著(P=0.007).
2.4 植物的根系泌氧与各生长指标的相关性
8种湿地植物的泌氧率与根孔隙度呈极显著正相关关系(P<0.01)(表2),对湿地植物的孔隙度与泌氧率进行线性回归分析(图1),结果显示,根孔隙度和泌氧率之间存在极显著的线性回归关系(P=0.001),可以通过以下方程根据孔隙率来预测植物的根系泌氧率:y=5.226x-0.861.
此外,植物的根泌氧量与各生物量呈极显著正相关(P<0.01),但与根茎比呈极显著负相关(P<0.01);植物的最大根长、孔隙度均与根泌氧率呈显著正相关(P<0.05);植物的RGR与根泌氧量呈极显著正相关(P<0.01),但与根茎比呈显著负相关(P<0.05)(表2).
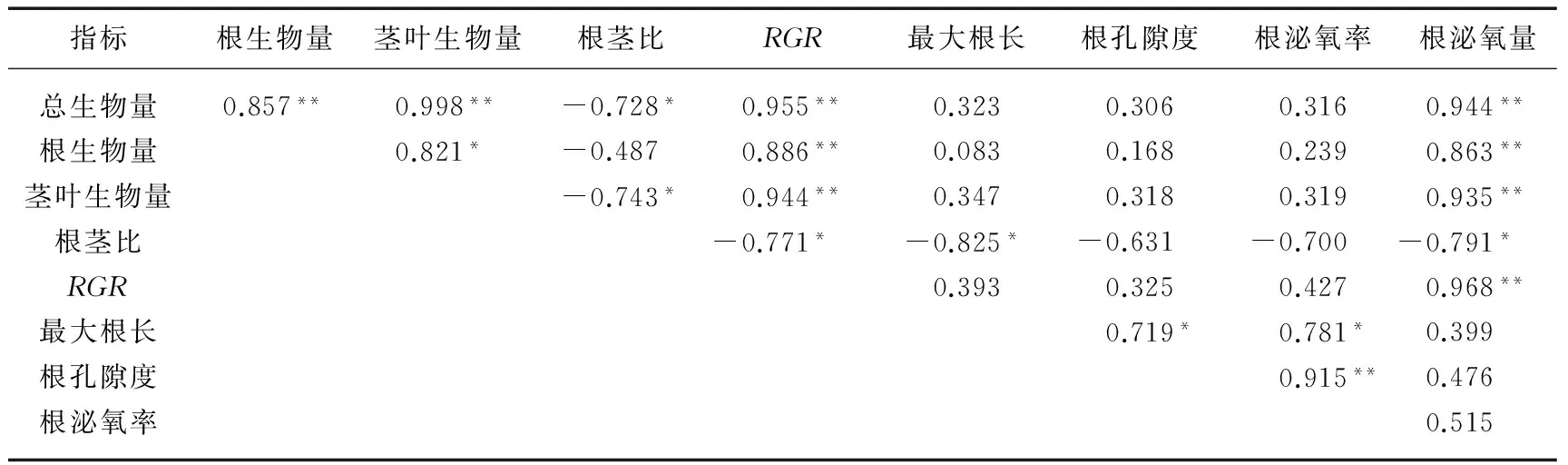
表2 植物的根系泌氧与各生理、生态指标的相关系数
*表示差异显著,P<0.05,**表示差异极显著,P<0.01;n=32.
3 讨论
本研究中的8种湿地植物,虽然生长特性存在差异,但在厌氧条件下均能良好生长,成活率达100%.湿地植物的生长状况直接影响到湿地系统的去除效率,湿地植物的良好生长状态,保证了对氮、磷和有机物的处理效果[19].本研究选用的湿地植物均有较强的抗逆性,适合用于人工湿地系统的构建.但8种湿地植物的生物量差异较大,其中美人蕉的根生物量、茎叶生物量都大于其它7种植物.有研究表明,植物的吸收、吸附和富集作用与植物的生长状况和根系发达程度呈正相关关系[20];并且,根系生物量越大、根长较长的植物能够大大的扩展人工湿地净化污水的空间,有利于微生物特别是好氧细菌向湿地深处分布[20-21],提高其净化污水的能力[22].因此,在选择湿地植物时要充分考虑其根系的生长状况,在人工湿地系统构建时,可以优先选用美人蕉.
成水平等在研究香蒲和灯芯草的根系分布时认为,它们的根系主要分布在25cm的区域[23],而两栖榕(Ficussp.)的根系在人工湿地中只能伸入地下20cm左右[23];藨草(Scirpustriqueter)根系主要集中在人工湿地12~15cm以上的表层[24];本研究中,须根型植物和根茎型植物经4周的厌氧培养,平均最大根长分别为19.86和14.38cm,也表明湿地植物的根系主要分布在25cm以内的区域,可以为人工湿地的建设提供参考.
根系泌氧是湿地植物的一个重要特性,植物通过泌氧能有效改善湿地缺氧的状态,在根际区形成好氧、兼性厌氧和厌氧渐变的环境,可以促进微生物的硝化和反硝化作用的进行,从而促进氮的去除.本研究中植物的最大根长与孔隙度呈显著正相关(P<0.05),而孔隙度高的植物泌氧率高,表明根长越长的植物更容易向厌氧区深入,能为更深层次的基质提供氧气.
植物自身良好的生长是湿地植物为基质提供氧气的前提,本研究中植物的泌氧量与RGR呈极显著正相关(P<0.01),表明植物的生长状况直接反映了植物的泌氧量,即长势较好的植物能为外界环境提供更多的氧气,这与Peter等的结论一致[25].本研究中须根型植物的泌氧量显著大于根茎型植物,其中美人蕉和香蒲的泌氧量显著大于其它种.
从植物的生物量看,植物的根系泌氧量与各部分生物量呈极显著正相关(P<0.01),这与Sorrell等的结论相似[26];同时植物的根系泌氧量还与根茎比呈显著负相关(P<0.05),这可能是因为低根茎比使根的呼吸耗氧少而气体传输能力强[27].因此,从泌氧量与根茎比的关系来看,选择植物时不但要考虑该种植物的生物量大小,还应尽量选择根茎比较低的植物,如香蒲、美人蕉.
从根的结构看,传输氧气的通气组织系统是湿地植物有能力生存于缺氧土壤或水体环境的一个重要的决定性因素,近年来国内外对湿地植物的通气组织和泌氧能力或泌氧方式等方面已有大量的研究[3,7,28-30],通常孔隙度较高的植物具有较强的泌氧能力,这种规律普遍存在且没有种的专一性.本研究中,8种湿地植物的根孔隙度与泌氧率之间呈极显著正相关,这与孔隙度影响气体传送的结论一致[31].
已有研究表明,湿地植物应对缺氧胁迫会通过泌氧和形成“泌氧屏障”等方式对根系进行保护,而泌氧类型的转变正是根系为适应外在环境的一种自我保护性应对.范子红等[8]在研究不同溶氧条件下美人蕉和风车草根系泌氧特征时发现,美人蕉在自然状态下根系均匀泌氧,在厌氧状态下根尖强烈泌氧;而风车草在自然状态下几乎不泌氧,在厌氧条件下除根基和根尖不泌氧外,其余部位均匀泌氧.Lai等[32]研究发现在自然水培状态下,5种湿地植物的泌氧能力表现为黄菖蒲>菖蒲>芦竹>美人蕉>香蒲.Mei等[33]研究表明,在50%的污水浓度下培养时4种湿地植物的泌氧能力表现为美人蕉>菖蒲>芦竹>黄菖蒲.而本研究中8种湿地植物在厌氧条件下的泌氧能力表现为香蒲>美人蕉>灯芯草>纸莎草>再力花>黄菖蒲>菖蒲>芦竹.表明不同植物在不同溶氧条件下的应对策略不同,从而也导致同一种植物在不同溶氧条件下泌氧能力的差异.
人工湿地因长期处于相对厌氧的环境,然而,人们对植物在厌氧环境下泌氧能力的研究还非常有限,为了更好的选择、利用湿地植物,构建污水净化效果好的湿地植物群落,还需对更多的湿地植物进行厌氧条件下泌氧能力的研究.
4 结论
1) 8种实验湿地植物都有较好的耐受性,在厌氧水培条件下均能良好生长,成活率达100%;各植物的生物量大小表现为美人蕉>香蒲>纸莎草>灯芯草>再力花>黄菖蒲>芦竹>菖蒲;根茎比表现为黄菖蒲>芦竹>再力花>纸莎草>菖蒲>灯芯草>香蒲>美人蕉;在构建湿地系统筛选植物时,应优先选择生物量大同时根茎比小的湿地植物.
2) 植物的生长状况直接反映植物的泌氧能力,8种植物的RGR表现为美人蕉>香蒲>灯芯草>纸莎草>再力花>黄菖蒲>菖蒲>芦竹;其中,须根型植物的RGR显著优于根茎型植物;在构建湿地植物群落时,可以考虑优先选用须根型植物.
3) 须根型植物较根茎型植物的通气组织发达,8种植物的孔隙度大小表现为灯芯草>香蒲>纸莎草>美人蕉>芦竹>菖蒲>再力花>黄菖蒲.
4) 美人蕉、香蒲有较大的生物量和较强的泌氧能力,同时,美人蕉、香蒲均有一定的观赏价值,在去污的同时还有很好的美化景观的作用,均是较优良的湿地植物.
[1] 徐德福,李映雪,华 方等.4种湿地植物的生理性状对人工湿地床设计的影响.农业环境科学学报,2009,28(3):587-591.
[2] Sorrell BK, Armstrong W. On the difficulties of measuring oxygen release by root systems of wetland plants.JournalofEcology, 1994, 82: 177-183.
[3] 邓 泓,叶志鸿,黄铭洪.湿地植物根系泌氧的特征.华东师范大学学报,2007,6:69-76.
[4] Coleman J, Hench K, Garbutt Ketal. Treatment of domestic wastewater by three plant species in constructed wetlands.Water,Air,andSoilPollution, 2001, 128(3/4): 283-295.
[5] 张 奎,曹文平,朱伟萍.人工湿地污水处理技术的研究.工业水处理,2007,27(8):16-21.
[6] 成水平,吴振斌,况琪军.人工湿地植物研究.湖泊科学,2002,14(2):179-184.DOI 10.18307/2002.0213.
[7] Pi N, Tam NFY, Wu Yetal. Root anatomy and spatial pattern of radial oxygen loss of eight true mangrove species.AquaticBotany, 2009, 90(3): 222-230.
[8] 范子红,刘超翔.溶氧条件对美人蕉和风车草根系泌氧特征的影响.城市环境与城市生态,2011,24(6):14-17.
[9] 陈文音,陈章和,何启凡等.两种不同根系类型湿地植物的根系生长.生态学报,2007,27(2):450-458.
[10] Lai WL, Wang SQ, Peng CLetal. Root features related to plant growth and nutrient removal of 35 wetland plants.WaterResearch, 2011, 45(13): 3941-3950.
[11] 吴海明,张 建,李伟江等.人工湿地植物泌氧与污染物降解耗氧关系研究.环境工程学报,2010,4(9):1973-1977.
[12] Wiengweera A, Greenway H, Thomson CJ. The use of agar nutrient solution to simulate lack of convection in waterlogged soils.AnnalsofBotany, 1997, 80(2): 115-123.
[13] Colmer TD. Long-distance transport of gases in plants: a perspective on internal aeration and radial oxygen loss from roots.Plant,CellandEnvironment, 2003, 26(1): 17-36.
[14] Sorrell BK. Effect of external oxygen demand on radial oxygen loss by Juncus roots in titanium citrate solutions.Plant,CellandEnvironment, 1999, 22: 1587-1593.
[15] Zehnder AJ, Wuhrmann K. Titanium(Ⅲ) citrate as a nontoxic oxidation-reduction buffering system for the culture of obligate anaerobes.Science, 1976, 194(4270): 1165-1166.
[16] Kludze H, DeLaune R, Patrick W. Aerenchyma formation and methane and oxygen exchange in rice.SoilScienceandSocietyofAmericaJournal, 1993, 57(2): 386-391.
[17] DeLaune HKKRD. Straw Application effects on methane and oxygen exchange and growth in rice.SoilScienceandSocietyofAmerieaJounal, 1995, 59: 824-830.
[18] Hadad HR, Maine MA, Bonetto CA. Macrophyte growth in a pilot-scale constructed wetland for industrial wastewater treatment.Chemosphere, 2006, 63(10): 1744-1753.
[19] 吴振斌,陈辉蓉,贺 锋等.人工湿地系统对污水磷的净化效果.水生生物学报,2001,25(1):28-34.
[20] 成水平,况琪军,夏宜琤.香蒲、灯心草人工湿地的研究——Ⅰ.净化污水的效果.湖泊科学,1997,9(4):351-358.DOI 10.18307/1997.0410.
[21] Cheng SP, Wu ZB, Xia YC. Review on gas exchange and transportation in macrophytes.ActaHydrobiologicaSinica, 2003, 27(4): 413-417.
[22] Wu JQ, Ruan XH, Wang X. Selection and function of aquatic plants in constructed wetlands.WaterResourcesProtection, 2005, 21(1): 1-6.
[23] 成水平,夏宜琤.香蒲、灯心草人工湿地的研究——Ⅱ.净化污水的空间.湖泊科学,1998,10(1):62-66.DOI 10.18307/1998.0110.
[24] Edwards GS. Root distribution of soft-stem bulrush(Scirpusvalidus) in a constructed wetland. TVA Cooporation Forest study Program,TVA. Foresty Bulid, Norris, TN37828, USA.29054194G, 1992: 239-243.
[25] Peter MB, Marleen K, Chris B Cetal. Radial oxygen loss, a plastic property of dune slack plant species.PlantandSoil, 2005, 271(1/2): 351-364.
[26] Sorrell B. Effect of external oxygen demand on radial oxygen loss by Juncus roots in titanium citrate solutions.Plant,CellandEnvironment, 1999, 22(12): 1587-1593.
[27] 赖闻玲,胡菊芳,陈章和.四种挺水植物生理生态特性和污水净化效果研究.热带亚热带植物学报,2010,18(4):421-427.
[28] Jespersen DN, Sorrll BK, Brix H. Growth and root oxygen release byTyphalatifoliaand its effects on sediment methanogenesis.AquaticBotany, 1998, 61: 165-180.
[29] Wiesner A, Kuschk P, Stottmeister U. Oxygen release by roots ofTyphalatifoliaandJuncuseffususin laboratory hydroponic systems.ActaBiotechnologica, 2002, 22: 209-216.
[30] 夏 劲,王国祥,王文玲等.慈姑(Sagittariatrifolia)根系泌氧特征.生态与农村环境学报,2012,28(4):422-426.
[31] Pezeshki SR. Wetland plant responses to soil flooding.EnvironmentalandExperimentalBotany, 2001,46: 299-312.
[32] Lai WL, Wang SQ, Peng CLetal. Root features related to plant growth and nutrient removal of 35 wetland plants.WaterResearch, 2011, 45(13): 3941-3950.
[33] Mei XQ, Yang Y, Tam NFYetal. Roles of root porosity, radial oxygen loss, Fe plaque formation on nutrient removal and tolerance of wetland plants to domestic wastewater.WaterResearch, 2014, 50: 147-159.
Characteristics of growth and radial oxygen loss of eight wetland plants
LIN Jianhua1, YANG Yang1,2, LI Li1& MAI Xiaobei1
(1:ResearchCenterofHydrobiology,JinanUnivesity,Guangzhou510632,P.R.China2:MinistryofEducationEngineeringResearchCenterofTropicalandSubtropicalAquaticEngineering,JinanUniversity,Guangzhou510632,P.R.China)
Plant is the core component of constructed wetland. Selecting the superior varieties of wetland plants would make full use of their functions in constructed wetland, and then improve the efficiency of sewage water treatment. To investigate the growth characteristics and radial oxygen loss(ROL) from roots of wetland plants under extreme condition, 8 species of wetland plants which were cultured with synthetic water under anaerobic condition were collected for comparison. 8 wetland plants could divided into two groups, fibril-root plant(Typhaorientalisl,Cannaindica,Juncuseffusus,Cyperuspapyrus) and rhizomatic-root plant(Acoruscalamus,Thaliadealbata,Arundodonax,Irispseudacorus). The eco-physiological characteristics, such as biomass, relative growth rate(RGR) root length, root porosity, rootROLwere compared. Results showed that 8 kinds of wetland plants all grown well under anaerobic conditions. Fibril-root plants had greater biomass, higherRGRandROLthan rhizomatic-root plant. Under the same illumination,Juncuseffuseshad the maximumROLwhich reached 192.62μmol O2/(d·g (DWroot)), whileIrispseudacorushad the minimum, which was only 68.81μmol O2/(d·g (DWroot)). The ranking order ofROLof the 8 species wetland plants was:Juncuseffuses>Cyperuspapyrus>Typhaorientalis>Cannaindica>Acoruscalamus>Thaliadealbata>Arundodonax>Irispseudacorus. ANOVA analysis indicated that Rate ofROLwas positively correlated with root porosity. TheROLwas positively correlated with both ofRGRand biomass,while negatively related to root/shoot ratio.
Wetland plants; fibril root system; rhizomatic root system; anaerobic condition;growth conditions; radial oxygen loss
J.LakeSci.(湖泊科学), 2015, 27(6): 1042-1048
DOI 10.18307/2015.0608
©2015 byJournalofLakeSciences
*国家水体污染控制与治理科技重大专项(2012ZX07206-004)资助.
2015-01-26收稿;2015-03-05收修改稿.
林剑华(1988~),男,硕士研究生;E-mail:87513638@qq.com.
**通信作者;E-mail:yangyang@scies.org.
