不对称双席夫碱过渡金属配合物的电子光谱和非线性光学性质的理论研究
2015-03-20呼和满都拉
呼和满都拉
(内蒙古集宁师范学院物理系,乌兰察布012000)
1 引 言
自1864 年Hugo. Schiff 用水杨醛、Cu 离子和苯胺合成具有亚氨基的化合物席夫碱以来[1],配位化学领域出现了围绕利用席夫碱较强的孤对电子给予能力配位过度金属形成新型功能金属配合物的研究热潮[2-4]. 目前关于利用席夫碱合成新型金属有机晶体配合物的研究主要从席夫碱的种类(醛类、酮类、大环类)、对称性以及配位金属种类方面展开[5-8]. 其中合成的不对称双席夫碱及其金属配合物可作为一种金属有机晶体配合物,因其特殊的结构在金属酶模型化合物、抗菌、催化以及功能材料方面备受关注[9-10]. 在众多不对称席夫碱在功能材料应用中,有机电致发光领域利用不对称席夫碱合成一系列具有较高非线性光学响应性能的不对称席夫碱配合物成为了研究的热点[11-13],根据人们从理论和实验上对新型有机非线性光学材料进行的大量研究发现,共轭链的长度、电荷价态、配位金属的种类以及给受体基团的改变等都可以影响分子的非线性光学特性[14-16],一种优良的有机电致发光材料需要材料分子具有较强的π 电子共轭效应和较高的分子内电荷转移效率. 不对称双席夫碱过渡金属配合物可作为一种介于有机物和无机物之间的材料,具有高效的电子传输性能和π 电子共轭效应. 不同过度金属配位、可以局部改变分子共轭体系电荷跃迁的性质,提高分子内电子转移速率,进而影响此材料分子的非线性光学响应效率[17-18]. 一系列实验和理论研究表明嵌有给体受体取代基的席夫碱分子具有良好的电子转移特征和非线性光学性质[19-20]. 本文选择一种新颖的邻香草醛缩二乙烯三胺缩乙酰丙酮席夫碱以及水杨醛缩二乙烯三胺缩乙酰丙酮席夫碱的Co、Ni、Cu 金属配合物[21],研究其几何结构和非线性光学性质,并通过讨论TDDFT 计算结果分析电荷跃迁性质对配合物非线性光学性质的影响,希望理论研究结果对实验合成新型非线性光学材料分子提供有价值的信息.
2 计算方法与模型
采用密度泛函理论(DFT)计算含过渡金属的非线性光学材料性质有效且结果精确[22]. 本文使用密度泛函理M05 方法,金属原子采用SDD 基组,非金属原子用6-31++G**基组,对Cu、Co、Ni 配合物进行结构优化和频率计算,得到稳定构型. 在此基础上,使用TD-M05 方法,6-311++G**基组计算激发态性质,模拟紫外可见吸收光谱,所有计算均采用Gaussian 09w 程序完成[23].
在均匀静电场中分子的体系能量可用有限场(FF)方法按泰勒级数展开,公式如下[24]:
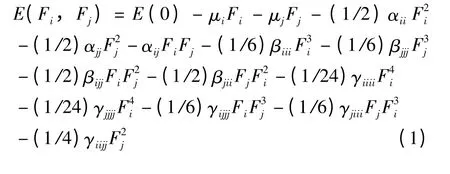
图2 所示结构为实验给出的预测配位形上式下角标取笛卡尔直角坐标. βiii等为一阶超极化率(二阶非线性光学性质)张量的分量,γiiii等为二阶超极化率(三阶非线性光学性质)张量的分量. 计算不同电场强度下分子的总能量得方程组,以有限场方法用FORTRAN 程序编程计算,得到非线性光学性质的各个分量. 再用下公式求得偶极矩方向上的静态一阶超极化率βμ和二阶超极化率γ.

式中μx,μy,μz分别为偶极矩在x、y、z 方向的分量,βi是一阶超极化率在i 方向的分量,βiii等为一阶超极化率三阶张量分量,γxxxx等为二阶超极化率四阶张量分量. 计算0.001 -0.004a. u. 不同倍率电场下的非线性光学性质,绘制β 和γ 关于电场强度的二维曲线图,在平滑段的电场选择非线性光学系数取值. 相关计算模型如图1

图1 计算所用的分子结构模型Fig.1 Calculation models of the molecule structure
3 结果与讨论
3.1 几何结构

图2 实验预测的三种金属与两类配体配位络合的分子结构Fig.2 The molecule structures of three metals and the two types of ligands complexes by experiment prediction
式[21],我们通过较为精确的理论计算优化得到的分子为图3 所示三种金属在与两种不对称双席夫碱配体(L1、L2)配位络合后的稳定结构. 由图2可以看出,N(2)与金属原子距离更近,说明N(2)原子更容易与金属原子络合成键,且亚氨基N比羰基O 氧的配位能力强. 显然,图3 所示结构更为合理.

图3 理论计算得到的三种金属与两类配体配位络合的分子结构Fig.3 The molecule structures of three metals and the two types of ligands complexes by theoretical calculation
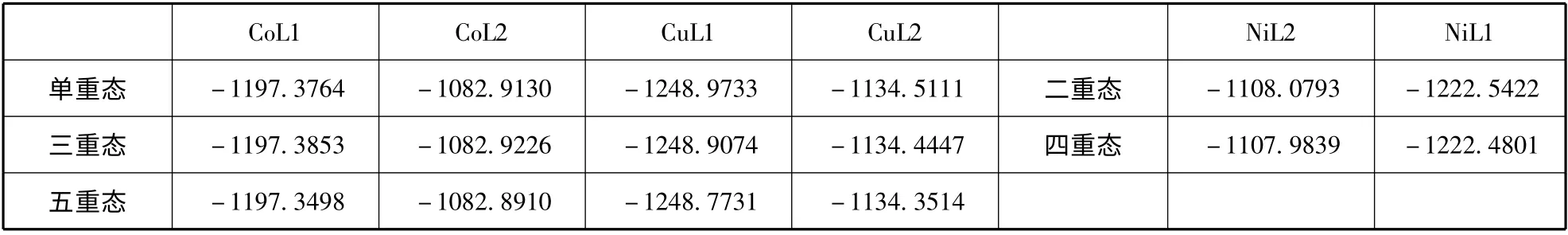
表1 配合物能量Table 1 The zero-point energies of the complexes (in a.u.)
考虑到过渡金属配合物可能存在多重态更稳定的情况,我们优化计算了多种自旋多重态下过度金属与两类不对称席夫碱配体配位络合的分子结构,计算所得的绝对能量见表1. 比较表1 中各个金属配合物在不同自旋多重态时的绝对能量可知:对金属Co 来说,与两种配体配位得到配合物的最佳稳定结构均为三重态时的结构,对金属Cu 来说最佳稳定结构为单重态时的结构,对金属Ni 来说因其本身存在单电子,我们计算了其二重态和四重态时稳定结构的能量,结果表明金属Ni与两种配体配位络合的最佳稳定结构为二重态时的结构. 因此选择三重态的Co 配合物,二重态的Ni 配合物和单重态的Cu 配合物来计算其紫外可见光谱和非线性光学性质.
有机非线性光学材料的分子结构将直接影响其电子跃迁的能力和类型,考虑到我们研究的是比较三种不同的金属与两类不对称席夫碱配位络合后分子的非线性光学性质. 金属原子与配体配位能力的强弱与大小将直接影响分子结构的共轭程度从而导致不同的非线性光学性质,为此我们计算给出了Co、Cu、Ni 三种金属分别与两类配体L1、L2 配位后各主要配位键的键长数据,见表2. 由表2 可知,比较三种金属与配体L1 配位后各配位键的键长可知金属Co 与L1 配位后各配位键的键长均大于金属Cu 和金属Ni,同时金属Ni 与L1 配位后各配位键长大于金属Cu,键长越长说明配位键越弱,配位能力越差,由此说明三种金属与不对称双席夫碱L1 配位后配位能力顺序为Cu >Ni >Co. 同样比较三种金属与配体L2 配位后各配位键的键长可以得到相同的规律,三种金属与不对称双席夫碱L2 配位后的配位能力顺序同样也是Cu >Ni >Co. 然而,比较同种金属与两类配体配位各配位键的键长发现,三种金属与L2配位后各配位键的键长均小于与L1 配位后各配位键的键长. 说明不对称席夫碱L2 与金属的配位能力要强于L1. L2 与L1 相比在于在共轭环的左侧引入了甲氧基,甲氧基的引入使配位键键长缩短,这在一定程度上会影响分子偶极矩和电荷跃迁矩,而进一步影响非线性光学性质.
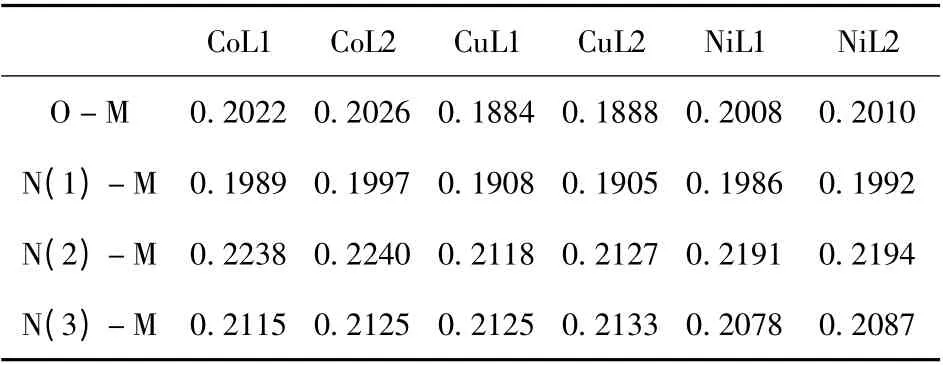
表2 六种配合物的主要配位键键长(nm)Table 2 The main ligands bond length (in nm)of six complexes
3.2 非线性光学性质
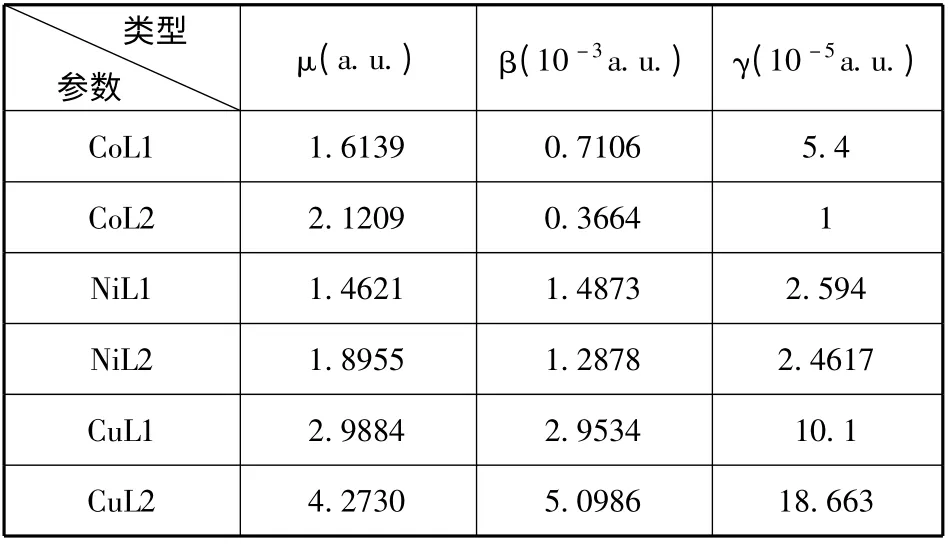
表3 配合物的偶极矩μ,一阶超极化率β,二阶超极化率γTable 3 Dipole μ,first hyperpolarizabilities β and second -order hyperpolarizabilities γof the complexes
由表3 数据比较同种金属与两种配体配位络合后的偶极矩可知三种金属与L1 配位后配合物的偶极矩均小于与配体L2 配位后的偶极矩,显然L1 配体中,甲氧基的引入导致了不同金属与其配位后配合物的分子偶极矩的减小. 比较表中一阶超极化率β,二阶超极化率γ 数据可知,Co、Ni两种金属与不对称席夫碱L2 配位后的β、γ 值均小于与L1 配位的相关值,说明这两种金属与L1配位后有助于提高其非线性光学性质,相反金属Cu 与配体L2 配位后的β、γ 值均大于与L1 配位的相关值,这些配合物中Cu 配合物的非线性光学性质最好,而Co 最差,对于Ni 和Co 配合物,甲氧基的引入使非线性光学性质提高,而Cu 配合物则恰好相反引入甲氧基一阶和二阶超极化率都下降导致其非线性光学性质减弱,这可能与金属的电子跃迁类型有关系. 甲氧基对苯环上的电子跃迁有影响,进而影响非线性光学性质. 因此我们在下文中分析了其电荷跃迁性质.
3.3 电子光谱
为进一步研究金属与配体配位络合后配合物的光学性质,我们采用TDDFT 方法计算研究了分子的电子光谱和激发态性质. 通过计算模拟得到的六种配位化合物的紫外吸收光谱图如图3 所示,计算模拟得到的Ni 配合物在500nm 左右,Co 配合物在800nm 左右有吸收峰,该峰是跃迁至LUMO 轨道最低能量跃迁. 具体光谱数据如表4. 由4 表可知,对于Cu 配合物,HOMO 和LUMO 参与了大多数的跃迁,意味着Cu 配合物分子具有更好的电子流动性.
最低能量跃迁对非线性光学性质有很大的影响,根据表4 金属配合物的激发态性质我们得到图5 配合物最低能量跃迁的前线分子轨道图. 由图5可以看出,配体L1 引入了甲氧基,可以改变跃迁贡献.CoL2 配合物的跃迁是由配体到配体的π→π* 跃迁,属于LC,而引入甲氧基后的CoL1 配合物,增加了βH-1 到βL +1 的跃迁,由中心金属电荷向非苯环席夫碱成键轨道贡献,属于n→π 的MLCT 跃迁,同时βH 到βL 的跃迁增加了金属原子的n→n* 跃迁.NiL2 配合物主要是苯环上的π→π* 跃迁,和金属到另一个席夫碱的n→π 跃迁,引入甲氧基后,这两种跃迁变化不大,而βH -1到βL+1 的跃迁增加了金属电子到席夫碱的n→π跃迁.CuL2 配合物主要是苯环和金属电子向另一边的席夫碱跃迁,而引入甲氧基后虽然增强了H -1到L 的跃迁,但是H-1 到L+1 的跃迁消失.
对于Co 和Ni 配合物,引入甲氧基增加了的跃迁种类,而Cu 配合物却恰好相反. 电荷跃迁的多样化,有利于增大非线性光学性质,因此可以解释表中同种金属配合物之间,甲氧基引入对配合物光学性质的影响.
4 结 论

图4 各配合物紫外可见光谱Fig. 4 UV-visible spectra of each complex
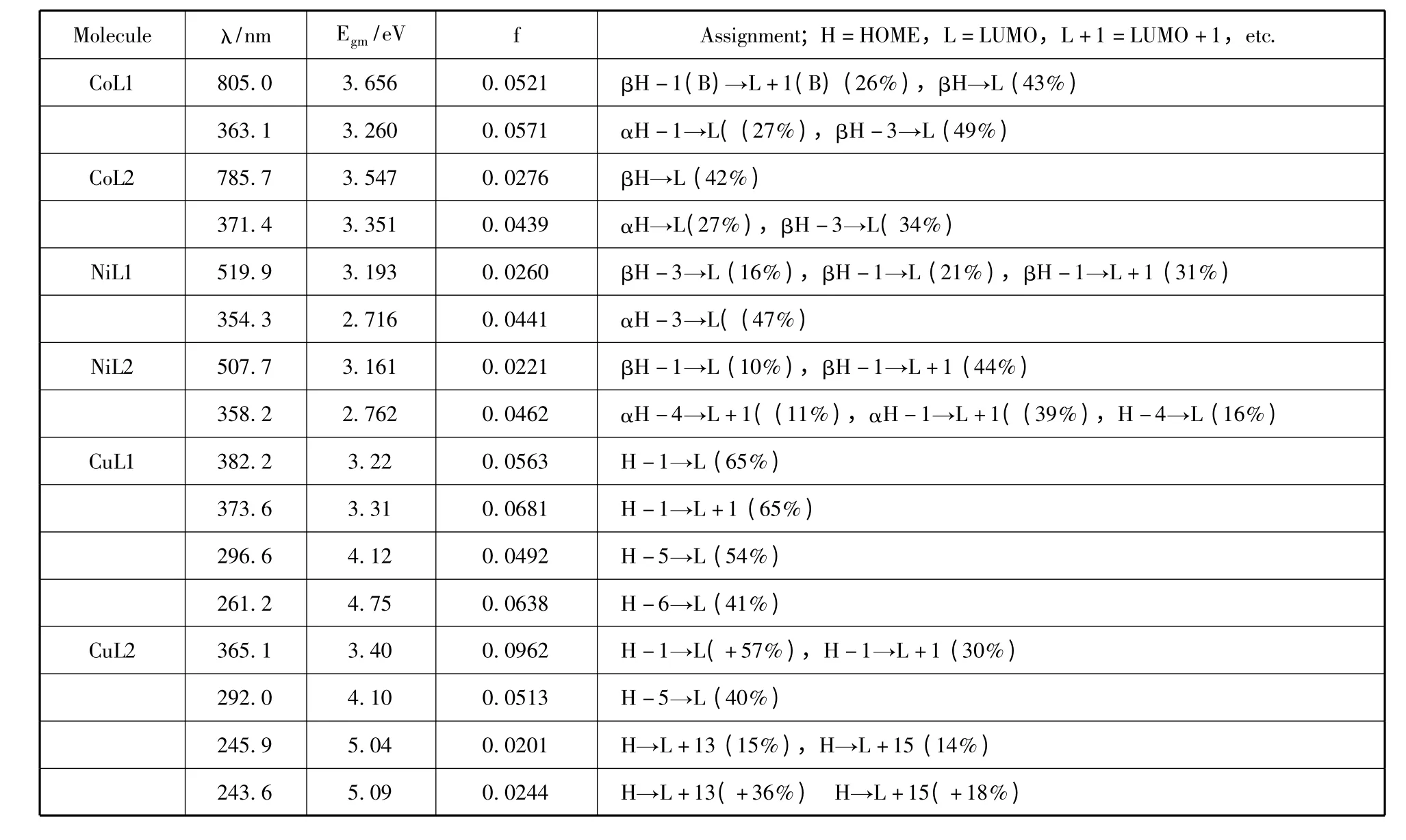
表4 配合物分子的吸收波长(λ)、激发能(Egm)以及相关的电子跃迁Table 4 Absorption wavelength (λ),excitation energy (Egm),and the corresponding electronic transition strengths of molecules
本文通过理论计算优化得到目标分子的稳定结构. 在此基础上计算了分子的非线性光学性质.在Co、Ni 和Cu 的六种金属配合物中,两种Cu配合物表现出较高的非线性光学性质,Ni 配合物次之,而Co 的非线性光学性质最差. 这个差异来自于金属电子参与电荷跃迁的贡献. Cu 参与MLCT 跃迁的电子较多,而Ni 和Co 参与MLCT跃迁的电子较少. Co 和Ni 配合物引入甲氧基后,跃迁的种类增多,因此跃迁电荷密度相对较大,而Cu 配合物引入甲氧基后跃迁种类减少同时跃迁电荷密度相对减小. 因此,对于Co 和Ni 配合物,在苯环上引入甲氧基取代基可以增强一阶和二阶超极化率,而对于Cu 配合物则恰好相反. 通常供电子基团会加分子的非线性光学性质,而在此类配合物中存在特殊情况,在进行非线性光学材料分子设计时要作特殊考虑.

图5 配合物最低能量跃迁轨道图Fig. 5 Lowest energy transition orbitals of the complexes
[1] Da Silva C M,Da Silva D L,Modolo L V,et al. Schiff bases:a short review of their antimicrobial activities[J]. Journal of Advanced Research,2011,2(1):1.
[2] Bells S D,Fragala I,Ledoux I,et al. Synthesis,characterization,optical spectroscopic,electronic structure,and second -order nonlinear optical (NLO)properties of a novel class of donor - acceptor bis(salicylaldiminato)nickel(II)schiff base NLO chromophores[J].J.Am.Chem.Soc.,1997,119:9550.
[3] Sheeren G,Persoons A P,Rondou M,et al. Synthesis of frequency doubling nonlinear optical polymers,functionalized with aminonitro-stilbene dyes. Second harmonic generation in corona poled thin films[J]. Eur.Polym.,1993,29(7):975.
[4] Emara A A A,Ali A M,Ei-Asmy A F,et al. Investigation of the oxygen affinity of manganese (Ⅱ),cobalt(Ⅱ)and nickel(Ⅱ)complexes with some tetradentate Schiff bases [J]. Journal of Saudi Chemical Society,2013,in press.
[5] Zhu X D,Luo Z F,Wu Z S,et al. 2,4 -Dihydroxybenzaldehyde thiosemicarbazone and their complexes of Cu(Ⅱ),Zn(Ⅱ),Ni(Ⅱ),and Fe(Ⅱ)[J].Chem. J. Chinese U.,1991,12(8):1066(in Chinese)[祝心德,乐芝凤,吴自慎,等. 2,4 -二羟基笨甲醛氨基硫脲合铜(Ⅱ),镍(Ⅱ),锌(Ⅱ),铁(Ⅱ)的合成和表征及杀菌活性[J]. 高等学校化学学报,1991,12(8):1066]
[6] Isse A A,Gennaro A,Vianello E. Electrochemical reduction of Schiff bases ligand Hsalen and Hsalophen[J]. Electrochemical Acta,1997,42 (13 - 14):2065.
[7] Sessler J L,Katayev E,Pantos G D,et al. Synthesis and study of a new diamidodipyrromethane macrocycle.An anion receptor with a high sulfate - to - nitrate binding selsctivity [J]. J.Chem.Soc.,Chem. Commun.,2004,11:1276.
[8] Gallant A J,Maclachlan M J,et al. Tautomerization in naphthalene diimines:a keto -enamine Schiff base macrocycle[J]. Org. Lett.,2005,7(22):4827.
[9] Gungor O,Gurkan P. Synthesis and spectroscopic properties of novel asymmetric Schiff bases [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2010,77(1):304.
[10] Menati S,Azadbakht A,et al. Synthesis,characterization and electrochemical study of synthesis of a new Schiff base (H2cdditbutsalen)ligand and their two asymmetric Schiff base complexes of Ni(Ⅱ)and Cu(Ⅱ)with NNOS coordination spheres [J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,97:1033.
[11] Yang X P,Jones R A,Wong W K,et al. Design and synthesis of a near infrared luminescent hexanuclear Zn-Nd prism[J]. Chemical Communications,2006,17:1836.
[12] Lu X Q,Bi W Y,Chai W L,et al. Tetranuclesr NIR luminescent Schiff - base Zn - Nd comolexes [J].New journal of Chemistry,2008,32(1):127.
[13] Ahmed A A,Benguzzi S A,Ahshad O M. Synthesis and characterization of some vanadyl schiff bases complexes[J]. Rasyan J. Chemistry,2009,2(4):781.
[14] Yu H L,Zhang M Y,Hong B,et al,Nonlinear optical properties of green fluorescent protein chromophore coupled diradicals [J]. Acta Phys. - Chim. Sin.,2009,29(12):2543.
[15] Coe B J,Fielden J,Foxoon S P,et al. Diquat derivatives:highly active,two -dimensional nonlinear optical chromophores with potential redox switchability[J]. J.Am. Chem. Soc.,2010,132:10498.
[16] Leila B L,Coe B J,Clays K,et al. Redox-switching of nonlinear optical behavior in langmuir blodgett thin films containing a ruthenium (II)ammine complex[J]. J.Am. Chem. Soc.,2008,130:3286.
[17] Hrobarik P,Zahradnik P A. Design of benzothiazolederived push -pull dyes with high molecular quadratic hyperpolarizabilitiesy[J]. Phys. Chem. Chem. Phys.,2004,6:495.
[18] Sheikhshoaie I,Fabian W M F. Quantum chemical study on the electronic structure and second -order nonlinear optical properties of salen -type Schiff bases[J]. Dyes and Pigments,2006,70:91.
[19] Lacroix P G. Second-order optical nonlinear in coordination chemistry:the case of bis(salicylaldimniato)metal Schiff bases complexes [J]. Eur. J. Inorg.Chem.,2001,2:339.
[20] Michel B,Melanie B,Mariol,et al. Ground and excited state properties of carbozole-based dyads:correlation with their respective absorption and fluorescence spectra[J]. J. Mol. Struct.:Thero. Chem.,2004,679(1):9.
[21] Zhang X H,Ren L,Gao Y L,et al. Synthesis and characterization of asymmetric bis - Schiff bases and their complexes [J]. Funct. Mater.,2013,0225(06):1001.
[22] Chen Z R,Nie H,Li Q,et al. Electronic spectrum and the secord - order nonlinear optical properties of pyrazoline-oxadiazole organic molecules[J]. Acta.Chim. Sin.,2011,69(24):2908(in Chinese)[陈自然,聂汉,李权,等. 吡唑啉-噁二唑类有机分子的电子光谱和二阶非线型光学性质[J]. 化学学报,2011,69(24):2908]
[23] Frisch M J,Trucks G W,Schlegel H B,et al. Gaussian 09,Revision A.02. Wallingford CT:Gaussian,Inc. 2009.
[24] Zeng W,Li Q,Zhao K Q,et al. Theretical studies on electronic absorption apsctra and third - order nonlinear optical property of tetraphenylporphyrine[J]. J.At. Mol. Phys.,2010,27(1):45 (in Chinese)[曾薇,李权,赵可清,等. 四本基卟啉类化合物电子光谱和三阶非线性光学性质的理论研究[J]. 原子与分子物理学报,2010,27(1):45]
