农杆菌介导的AtNDPK2基因转化亚麻的研究*
2015-03-18郭永霞王丽艳荆瑞勇殷奎德
郭永霞,王丽艳,孙 强,荆瑞勇,殷奎德
(黑龙江八一农垦大学,黑龙江 大庆163319)
亚麻(Linum usitatissimumL.)为双子叶植物,是亚麻科(Linaceae)亚麻属(Linum)的一年生草本植物,是我国重要的经济作物,油用亚麻是一种重要的油料作物,纤用亚麻是重要天然纤维的来源。我国的亚麻产量和质量水平与发达国家相比有很大的差距,其原因是多方面的,而主要原因之一还是亚麻品种相对比较落后。干旱、盐碱、低温等是限制作物生产的主要外界环境条件。目前随着经济发展,人口急剧增加,以及全球气候的变化,这些环境问题在持续加重。其中干旱对作物产量的影响,在各种自然逆境中占据首位,其危害仅次于生物胁迫病虫害造成的损失,相当于其他自然灾害之和。NDPK2基因编码植物核苷二磷酸激酶2(NDPK2),Moon H等人发现NDPK2可参与促分裂原蛋白激酶(MAPK)级联反应,结合MAPK6和MAPK3[1],进而上调POD、硫氧还蛋白、CAT、过氧化物还原酶和硫氧还蛋白还原酶等多种抗氧化酶基因的表达,从而调节细胞的氧化还原状态[2]。拟南芥核苷二磷酸激酶2基因(At-NDPK2)通过对马铃薯[3]、大麦[4]、苜蓿[5]的遗传转化研究也表明:AtNDPK2基因的过量表达可增强作物对干旱、盐渍或极端温度的忍耐性。迄今为止,未见有关AtNDPK2基因在亚麻中遗传转化的报道。本研究旨在以双亚7号下胚轴为外植体,通过对遗传转化条件的优化来建立稳定的遗传转化体系。具体是采用农杆菌介导的方法,将胁迫诱导型启动子SWPA2与AtNDPK2基因构建共表达载体导入双亚7号,以期获得耐性更强的转基因亚麻,为亚麻抗逆品种的培育奠定基础,同时也为亚麻基因工程操作技术提供参考。
1 材料与方法
1.1 试验材料
供试亚麻品种双亚7号由黑龙江省科学院亚麻研究所夏尊民研究员惠赠。培养5 d的亚麻下胚轴外植体做为转化体系优化和基因转化的材料。
根癌农杆菌(Agrobacferium tumefaciens)菌株EHA105和质粒pCAMBIA2300由韩国生命工学研究院环境生命工学研究中心的郭尚珠教授惠赠。
含有目的基因AtNDPK2的重组质粒载体也由郭尚珠教授惠赠,包含胁迫诱导型启动子SWPA2,并携带目的基因AtNDPK2,npt-Ⅱ为筛选标记基因。
1.2 试验方法
1.2.1 选择培养基中抗生素的种类和筛选浓度的确定 选取双亚7号5 d的无菌苗下胚轴,分别接种到含不同浓度Kan和G418的下胚轴分化增殖培养基上,15 d继代一次,30 d后统计下胚轴的分化增殖情况。Kan和G418浓度均设置为0,50,100,150,200 mg·L-1,每个处理接种10个下胚轴,5次重复,总计接种50个下胚轴,取5次重复的平均值。
1.2.2 最佳预培养时间的确定 选取双亚7号培养5 d的无菌苗下胚轴,转化前在分化增殖培养基上设置0、1、2、3、4、5 d时间进行预培养,经相同的农杆菌处理浓度、相同共培养时间和相同筛选条件,每个处理接种10个下胚轴,5次重复,总计接种50个下胚轴,取5次重复的平均值。培养30 d后,通过统计分析,比较不同处理的抗性再生率,以确定最适的预培养时间。
1.2.3 最佳共培养时间的确定 以双亚7号为材料,切取下胚轴并侵染后,置于共培养基上,分别共培养0,1,2,3,4,5 d,然后转入含有一定浓度筛选抗生素的培养基上,每个处理接种10个下胚轴,5次重复,总计接种50个下胚轴,取5次重复的平均值。培养30 d后统计抗性芽诱导率。
1.2.4 农杆菌介导AtNDPK2基因的转化及植株再生 将双亚7号和晋亚7号培养5 d苗龄的无菌苗下胚轴在切成0.5 cm左右,摇动10-15 min。然后用灭过菌的滤纸吸干下胚轴表面的农杆菌,置于不含抗生素的共培养基上共培养3 d,共培养结束后将下胚轴转入含50 mg·L-1G418和250 mg·L-1Cef的下胚轴分化增殖的筛选培养基中,在(25±2)℃,14 h/10 h光周期条件下培养45 d,每15 d继代一次。当分化出抗性小芽后,将抗性小芽转接到加有筛选抗生素G418的加有Cef的分化增殖培养基中进行分化增殖培养。培养一定量的抗性小芽后,将抗性小芽转入芽伸长培养基中继续培养。待小苗长至3-4 cm左右时,从基部切成单株,转接到生根培养基上进行生根培养。生根培养基中同样加有G418。
1.2.5 再生植株的PCR检测 用目的基因特异性引物进行目的基因的PCR扩增,反应产物在含EB的1.2%的琼脂糖凝胶上电泳25-30 min,用凝胶成像系统拍照。根据AtNDPK2基因序列设计特异性引物,引物1:5'-CACCATGGTGGGAGCGACT-3';引物2:5'-TCTGTCTAGACAAGGATCA-3',扩增的目的片段大小为540 bp,扩增时以未转化植株叶片DNA作为阴性对照,质粒DNA作为阳性对照。
2 结果与分析
2.1 选择培养基中抗生素的种类和筛选浓度的确定
选取双亚7号培养5 d的无菌苗下胚轴,分别接种到含不同浓度Kan和G418的下胚轴分化增殖培养基上,15 d继代一次,30 d后统计下胚轴的分化增殖情况,结果如图1所示。

图1 选择培养基中抗生素的种类和浓度对增殖系数的影响Fig.1 Effect of type and concentration of antibiotic in selective media on proliferation coefficient
由图中可以看出,两种抗生素对亚麻下胚轴分化增殖的影响差异很大,其中G418浓度为50 mg·L-1时,培养30 d后,下胚轴已经枯死;而对Kan来说,随着浓度的增加,增殖系数略有下降,但从方差分析来看,从0、50、100、150 mg·L-1之间,增殖系数没有显著性差异,0、50、100 mg·L-1与200 mg·L-1之间有显著性差异,150与200 mg·L-1之间无显著性差异。当Kan浓度增加到200 mg·L-1时,增殖系数仍为6.35,因此Kan不适合做为亚麻筛选的抗生素,选择G418做为筛选抗生素,筛选浓度为50 mg·L-1。
2.2 不同预培养时间对亚麻遗传转化的影响
转化前的预培养对于植物遗传转化具有重要意义,本试验对亚麻下胚轴分别进行了0、1、2、3、4、5 d的预培养,45 d后统计转化率(转化率=产生抗性芽的个数/接种的下胚轴总数)结果如图2。
从图中可以看出,预培养时间对转化率有一定的影响,呈现先升高后降低的趋势,其中培养2 d时下胚轴转化率最高为7%,其次是培养3d时的转化效率为6%,但从方差分析可以看出,培养2 d和培养3 d转化率没有显著性差异,但与其它的培养时间0,1,4,5 d均存在显著性差异。因此本试验选择预培养2 d进行转化试验。
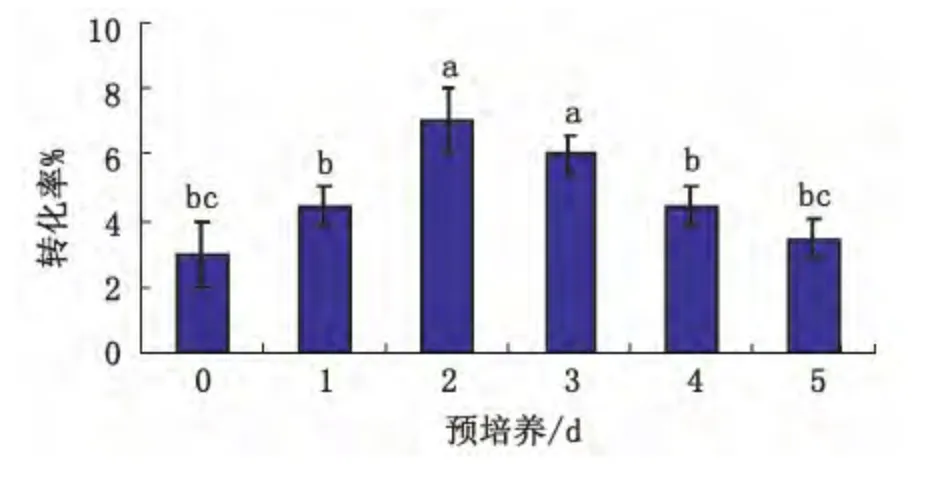
图2 不同的预培养时间对亚麻下胚轴转化率的影响Fig.2 Effect of different pretreatment time on conversion percent of flax hypocotyl
2.3 共培养时间对转化率的影响
农杆菌与外植体共培养在整个转化过程中是非常重要的环节,因为农杆菌的附着、T-DNA的转移和整合都在这个时期内完成,因此确定共培养条件是转化成功的关键。最佳共培养时间的确定,一方面使农杆菌附着外植体表面后在创伤部位生存一定时间后能够诱发肿瘤,因此共培养时间不能太短,但也不宜太长,否则,可能会由于农杆菌的过度生长而使植物细胞受到毒害而死亡,不死亡也会在后续培养中难以抑制。因此确定一个适宜的共培养时间是一个好的转化体系所必须的。试验结果图3所示。
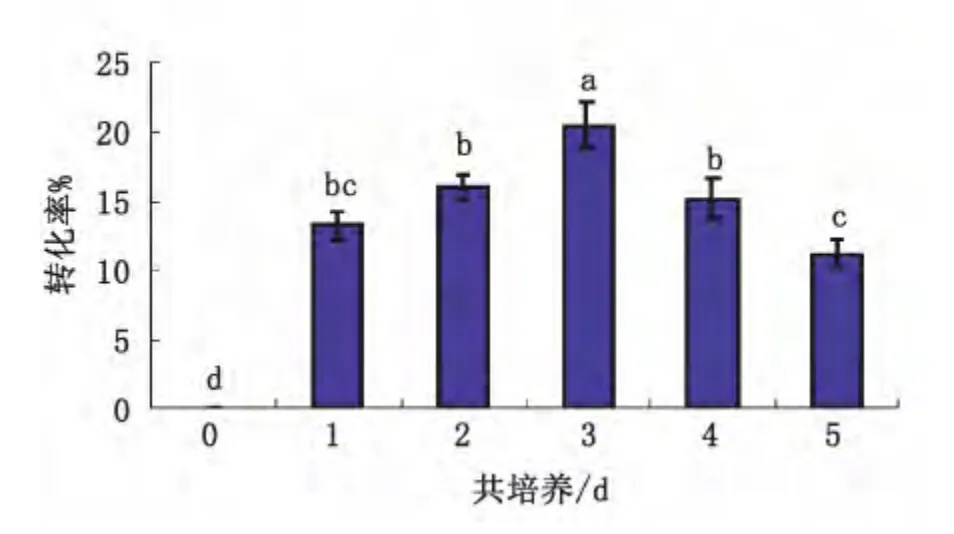
图3 共培养时间对亚麻下胚轴转化率的影响Fig.3 Effect of co-culture time on conversion percent of flax hypocotyl
从图中可以看出,外植体与农杆菌的共培养时间对转化率有较大的影响,随着共培养时间的增加转化率呈现先增加后减小的趋势,当共培养3 d时,转化率最高达20.45%,不进行共培养时,转化的率为0,原因是因为农杆菌附着在外植体表面并不能立刻转化,只有在创伤部位生存8-16 h之后的菌株才能诱发肿瘤。超过3 d后转化率下降,是因为共培养后在筛选培养基中有的外植体死亡,有的长出农杆菌,因此导致总的转化率降低。从方差分析可以看出,共培养3 d与其它共培养时间的转化率之间存在显著性差异,因此选择3d做为共培养的最佳时间。
2.4 农杆菌介导AtNDPK2基因的转化及植株再生
将双亚7号培养5 d苗龄的亚麻,下胚轴切成0.5 cm左右,放在预培养培养基中培养2 d后,取出放于OD0.6-0.8的农杆菌菌液中摇动10-15 min。然后用灭过菌的滤纸吸干下胚轴表面的农杆菌,置于不含抗生素的共培养基上共培养3 d,共培养结束后将下胚轴转入含50 mg·L-1G418和300 mg·L-1Cef的下胚轴分化增殖的筛选培养基中。当培养30 d左右,下胚轴大部分形成的愈伤组织及分化的小芽死亡,只有少数的小芽能够继续存活(图4A),存活率能达到23.5%。将抗性小芽转接到芽伸长培养基中培养,抗性小芽长高(图4B),将其分成单株接种到加有50 mg·L-1的G418生根培养基中,10 d左右能长出大约15条/株的根,形成抗性植株(图4C)。

图4 G418抗性植株的生长过程Fig.4 Growth process of Resistance plant G418
2.5 亚麻抗性植株的PCR检测
对获得的抗性植株,经过继代增殖培养及伸长生长培养后,对获得的6个株系的组培苗进行了转基因检测。使用无菌苗的叶片提取基因组DNA,用AtNDPK2的特异性引物进行PCR检测,来扩增目的基因特异性片段。结果有4个株系扩增出了目的条带,阳性率为66.67%。检测的图片见图5。

图5 亚麻转AtNDPK2基因抗性植株PCR电泳图Fig.5 PCR profile of transgenetic resistance plant withAtNDPK2
从图2可知,阴性对照无扩增条带,lane 1~6是抗性植株的扩增情况,其中1,4,5,6与阳性质粒DNA扩增出的带与AtNDPK2基因大小相符,实验结果表明,1,4,5,6株系AtNDPK2基因已转入亚麻基因组中。而2,3株系未扩增出目的条带,AtNDPK2基因未转化成功。
3 讨论
本研究中植物表达载体上携带有目前植物基因工程中使用最广泛的筛选基因nptⅡ基因,nptⅡ基因编码新霉素磷酸转移酶,若该基因整合进亚麻基因组中,它能使Kan(卡那霉素)、geneticin(G418)、Neo(新霉素)等氨基糖苷类抗生素磷酸化,使转化细胞以及再生植株具有抗这三种抗生素的能力[6]。Jin-Zhuo Dong等对亚麻的两种筛选抗生素进行了比较研究,结果发现,亚麻下胚轴对Kan和G418显示出两种不同的反应,Kan是一个比G418温和的筛选剂[7]。这一结果在桃的遗传转化中也有类似的报告[8]。但国内研究者的报道与以上结果有所不同,李学宝等人在对亚麻下胚轴进行转化研究时发现在含Kan50 mg·L-1的选择培养基上筛选获得Kan抗性苗,并检测到GUS基因活性表达[9]。王玉富等在利用农杆菌介导进行亚麻转基因研究时,在筛选培养基中加入了50 mg·L-1的Kan和1 000 mg·L-1的头孢霉素[10]。本试验中对两种筛选抗生素Kan和G418也进行了比较研究,当Kan浓度增加到200 mg·L-1时,亚麻的增殖系数仍为6.35,因此Kan不适合做为亚麻筛选的抗生素。G418浓度为50 mg·L-1时,培养30d后,下胚轴已经枯死,因此选择G418做为筛选抗生素,筛选浓度为50 mg·L-1,此结果与前人报道在浓度上有所差异,这应该与不同的亚麻基因型、外植体,甚至不同的试剂有关。
一般认为预培养对外植体的转化是有利的,它可以促进外植体细胞分裂,分裂状态的细胞会更容易整合外源DNA,从而提高外源基因的转化率[11]。姬妍茹等的研究发现,是否进行预培养直接影响着受体的一周成活率,外植体子叶和下胚轴的GUS瞬时表达率在预培养2 d后开始出现下降趋势,虽然不进行预培养有100%的GUS瞬时表达,但外植体生长状态不佳,成活率低,难于进行再分化[12]。Bretagne-Sagnard等人在GUS染色试验的结果中发现,预培养和剥皮同样能够使瞬时转化率提高[13]。Dong等人在试验研究中发现未经过预培养的下胚轴切口两端有较强的染色效果,预培养时间超过6天的染色强度反而降低[14]。本研究结果发现预培养对转化率是有影响的,预培养2-3d为最佳时间,当低于或高于这一时间时,转化率都会有所下降,这与前人的研究结果稍有差异。
[1] MOON H,LEE B,CHOI G,et al.NDP kinase 2 interacts with two oxidative stress-activated MAPKs to regulate cellular redox state and enhances multiple stress tolerance in transgenic plants[J].Proceedings of the National Academy of Sciences,2003,100(1):358-363.
[2] YANG K A,MOON H,KIM G,et al.NDP kinase 2 regulates expression of antioxidant genes in arabidopsis[J].Proceedings of the Japan Academy,Series B,2003,79(3):86-91.
[3] TANG L,KIM M D,YANG K S,et al.Enhanced tolerance of transgenic potato plants overexpressing nucleoside diphosphate kinase 2 against multiple environmental stresses[J].Transgenic Research,2008,17(4):705-715.
[4] UM M O,PARK T I,KIM Y J,et al.Particle bombardmentmediated transformation of barley with an Arabidopsis NDPK2 cDNA[J].Plant Biotechnology Reports,2007,1(2):71-77.
[5] 王文斌.紫花苜蓿耐逆性及AtNDPK2、codA基因的遗传转化研究[D].咸阳:西北农林科技大学,2009.WANG Wenbin.The studies on alfalfa abiotic stress tolerance and genetic transformation ofAtNDPK2 and codA genes[D].Xianyang:Northwest A&F University,2009.
[6] 张松,温孚江,朱常香,等.抗生素对大白菜组织培养形态发生的影响[J].山东农业大学学报,2000,31(4):358-388.ZHANG Song,WEN Fujing,ZHU Changxiang,et al.Effects of antibiotics on morphogenesis of chinnese cabbage(Brassica Campestris Ssp.Pekinensis(Lour)Olsson)in tissue culture[J].Journal of Shandong Agricultural University(Natural Science),2000,31(4):385-388.
[7] JIN-ZHUO DONG,ALAN MCHUGHEN.An improved procedure for production of transgenic flax plants usingAgrobacterium Tumefaciens[J].Plant Science,1993,88:61-71.
[8] R SCORZA,P H MORGENS,J M CORDTS,et al.Agrobacterium-mediated transformation of peach (Prunus persicaL.Batsch)leaf segments,immature embryos and long-term embryogenic callusin vitroCell[J],Dev Biol,1990,(26):829-834.
[9] 李学宝,陈光荣,金波.亚麻下胚轴离体培养和转化的研究[J].武汉植物学研究,1995,13(4):344-348.LI Baoxue,CHEN Guangrong,JIN Bo.Plant Regeneration and Transformation of Linum Usit Atissimum Hypocotylin vitro[J].Journal of Wuhan Botanical Research,1995,13(4):344-348.
[10] 王玉富,周思君,刘燕,等.利用农杆菌介导法进行亚麻转基因的培养基研究[J].中国麻作,2000,22(1):14-16.WANG Yufu,ZHOU Sijun,LIU Yan,et al.Study on flax genetic transformation byAgrobacteriumTumefaciens[J].China’s Fiber Crops,2000,22(1):14-16.
[11] 张勇,周小云,何江,等.影响根癌农杆菌介导甜瓜转化NP-1基因的外部因子研究[J].生物技术,2004,14(4):9-11.ZHANG Yong,ZHOU Xiaoyun,HE Jiang,et al.Study on factors affecting Agrobectrium-mediated cantaloup tranformation of NP-1gene[J].Biotechnology,2004,14(4):9-11.
[12] 姬妍茹,赵军,刘伟伟,等.应用直接分化再生系统进行亚麻转基因技术的研究[J].生物技术通报,2008,(1):128-132.JI Yanru,ZHAO Jun,LIU Weiwei,et al.Study on flax transform technology by system of shoot differentiate directly from explant[J].Biotechnology Bulletin,2008,(1):128-132.
[13] BRETAGNE-SAGNARD B,CHUPEAU Y.Selection of transgenic flax plants is facilitated by spectinomycin[J].Transgenic Research,1996,5:131-137.
[14] DONG JINZHUO,MCHUGHEN A.Patterns of transformation intensity on flax hypocotyls inoculated withAgrobacterium Tumefaciens[J].Plant Cell Reports,1991,10:555-560.
