二乙氨基硫代甲酸铜(Cu(DDC)2)疏水蛋白纳米粒的制备及评价
2015-03-15刘子童方桂花张纯刚
刘子童,徐 晖,胡 希,方桂花,张纯刚,唐 星
(沈阳药科大学 药学院,辽宁 沈阳 110016)
二乙氨基硫代甲酸铜(Cu(DDC)2)疏水蛋白纳米粒的制备及评价
刘子童,徐 晖,胡 希,方桂花,张纯刚,唐 星*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的合成二乙氨基硫代甲酸铜(Cu(DDC)2)并制备其疏水蛋白纳米粒,提升其血浆稳定性。方法采用透析法制备,通过考察疏水蛋白用量、溶液pH值、冻干保护剂的种类和用量等因素,以粒径、包封率等为指标,选择最优处方。结果疏水蛋白纳米粒的平均粒径为140.81±45.6,24 h的体外累积释放量为94.50%,24 h全血浆中降解后剩余量是Cu(DDC)2的2.2倍,长期3个月稳定性良好。结论疏水蛋白包裹的Cu(DDC)2纳米粒,外观、粒径、包封率、体外释放、血浆稳定性等制剂学各项指标评价良好,具有良好的抗肿瘤应用前景。
药剂学;二乙氨基硫代甲酸铜(Cu(DDC)2);疏水蛋白(HPB);纳米粒;冻干保护剂;血浆稳定性
自1948年以来,双硫仑(disulfiram,DSF) 作为戒酒药被广泛应用于欧洲[1],近年研究人员发现DSF具有抗肿瘤活性,并且这种作用与铜离子密切相关,但是单独使用铜离子在临床上并未起到任何作用,只有DSF与铜合用时抗肿瘤作用显著[2]。研究发现,DSF独特的二硫键结构能够与铜离子螯合形成复合物,这种复合物即二乙氨基硫代甲酸铜(Cu(DDC)2),结构式见图1。Cu(DDC)2不仅具有非常强的活性氧(ROS)诱导作用,而且能够强烈的抑制NFκB的表达[3]。Cu (DDC)2的抗肿瘤作用产生可能有以下4种机制:1)同时激活ROS-JNK/p38 通路和抑制NFκB通路[4]; 2)与抑制泛素-蛋白酶体系统有关[5];3)抑制拓扑异构酶Ⅰ和Ⅱ的活性[6];4)抑制金属蛋白酶(MMPs)MMP-2和MMP-9的作用[7]。Cu(DDC)2确切抗肿瘤机制还需进一步研究。

Fig.1 The sturcture of Cu(DDC)2图1 Cu(DDC)2的结构
Cu (DDC)2为中性,在水中溶解度极低(小于0.1 μg·mL-1),在酸中的稳定性强于DSF,对于这种新的抗肿瘤化合物的制剂研究,文献中很少报导。本研究经过预试验,发现Cu (DDC)2适合被疏水蛋白包裹形成纳米粒注射给药。
疏水蛋白(hydrophobin)是高等丝状真菌在特定时期产生的一类具有特殊理化性质的小分子量蛋白质,大都含有100个氨基酸,分子量大小为10 k Da左右[8],其结构上比较特殊,既含有亲水结构,也含有疏水结构,在整体结构上表现为双亲性,双亲性使得疏水蛋白像表面活性剂一样,当它们遇到亲水一疏水界面时,其结构发生变化,就会自我组装成一层两亲性薄膜[9]。并且研究表明疏水蛋白既无细胞毒性,也无强免疫原性,Reger[8]和Sarparanta[10]等应用其制备了乳剂和多孔硅纳米粒。
本文的主要目的是将Cu (DDC)2制成静脉注射疏水蛋白纳米粒载药系统,以便解决Cu (DDC)2血浆稳定性差等问题。本文作者对制剂进行了一系列表征和体外相关研究,希望能为今后Cu (DDC)2进一步研究提供剂型、制备工艺等方面的实验依据。
1 仪器与材料
日立D-7000高效液相色谱仪(Hitachi公司,日本);DiamonsilTMC18色谱柱(200 mm×4.6 mm, 5 µm,迪马公司);DF-101S集热式恒温磁力搅拌器(巩义市英峪予华仪器厂);透析袋(截留分子量3500 Da,上海绿鸟科技发展有限公司);Hitachi H800透射电镜(日立公司,日本);Ultra-cell超声波细胞粉碎机(Sonics Materials Inc., 美国);NicompTM380 动态光散射粒度/zeta-电位测定仪(Santa Barbara,美国)。
双硫仑(济南锐晶药化有限公司);氯化铜(分析纯,山东禹王实业有限公司);H Star Proteins B(HPB,德国 BASF公司赠送);海藻糖(南宁市中诺生物工程有限责任公司);麦芽糖、甘露醇、葡萄糖、乳糖、蔗糖(天津博迪化工有限公司);甲醇、乙腈(色谱纯,天津康科德化学试剂厂);其余试剂均为分析纯。
2 方法与结果
2.1 Cu(DDC)2的合成
有关Cu(DDC)2合成研究的报道并不多,本研究采用CuCl2与DSF反应,物质的量比为1:1[11],在自然光的条件下反应,反应介质为纯化水,反应过程如图2所示。将双硫仑黄色固体粉末1.74 g (5.868 mmol) 加入到500 mL CuCl2·2H2O (1 g, 5.868 mmol) 蓝色水溶液中(物质的量比为1:1),在磁力搅拌条件下持续搅拌24 h。反应过程中内容物颜色逐渐由黄绿色变为深棕色,最后成为黑色,显示化合物Cu(DDC)2开始形成。

Fig.2 The reaction of DSF and CuCl2in pure water图2 DSF和CuCl2在水溶液中的反应
反应完成后,对产物进行纯化处理。先将得到的黑棕色沉淀物用布氏漏斗过滤,再用乙醇反复洗涤3遍以除去未反应完全的DSF,得到的产物再用二氯甲烷-水(体积比1:1)在分液漏斗中萃取(200 mL ×3),以除去水溶性杂质,最后得到的产物在真空干燥箱中干燥12 h (40℃),即得纯度大于95%的Cu(DDC)2,平均每次反应收率达到90%以上。产物经鉴别,均与文献报导一致。
2.2 Cu(DDC)2疏水蛋白纳米粒(Cu(DDC)2-HPB-NPs)的制备
在未明确疏水蛋白的用量之前,考察时预试验用量为20 mg·L-1,试验中主要比较了超声法和透析法两种制备工艺。
超声法: HPB 的PBS溶液,加入Cu(DDC)2的DCM溶液中,冰浴搅拌超声后,旋蒸除去DCM,完成后过0.45 μm 的滤膜,冻干即得。
透析法:HPB 的PBS溶液,加入Cu(DDC)2的 N,N-二甲基甲酰氨(DMF)溶液,室温搅拌后,再放入60℃水浴搅拌,冰浴冷却[11],装入透析袋中,透析24 h。透析完成后过0.45 µm 的滤膜,冻干即得。
实验结果表明,超声法虽然能降低粒径,但是不利于HPB结构的稳定;透析法较温和,虽然透析过程时间较长,但形成的纳米粒粒径均一,且一次制备的制剂量较大。因此本文采用透析法制备Cu(DDC)2-HPB-NPs。实验中首先考察了制备中的工艺参数对纳米粒质量的影响,确定制备工艺后,进行详细的单因素处方筛选。最后在单因素考察基础上,以粒径大小、包封率和短期稳定性作为Cu(DDC)2-HPB-NPs的质量评价指标。
2.2.1 有机相的选择
按照有机相既能溶解 Cu(DDC)2又能与水很好互溶的要求,作者选择了几种水溶性的有机溶剂(分别为四氢呋喃、DMF、乙醇、乙腈)进行实验,结果显示四氢呋喃和药物发生反应,乙醇和乙腈对药物溶解性太差,DMF 对药物溶解能力最强,因此选用DMF作为有机相。
2.2.2 HPB溶液与Cu(DDC)2溶液的体积比
实验中考察了有机相与水相体积比不同对包封率(EE%)、zeta电位和平均粒径(MD)的影响。考察的体积比分别为:10:0.1、10:0.5、10:1、10:2和10:5。制备过程为:配制20mg·L-1HPB 的PBS溶液作为水相, 0.678 mg·mL-1Cu(DDC)2的DMF溶液作为有机相,用注射器吸取有机相滴加到水相中,以转速100 r·min-1在室温搅拌10 min,60℃水浴搅拌10 min,透析除去DMF,过滤即得。结果见表1,比例过大或过小各项指标均不符合要求,当体积比为10:1时,各项指标均符合。
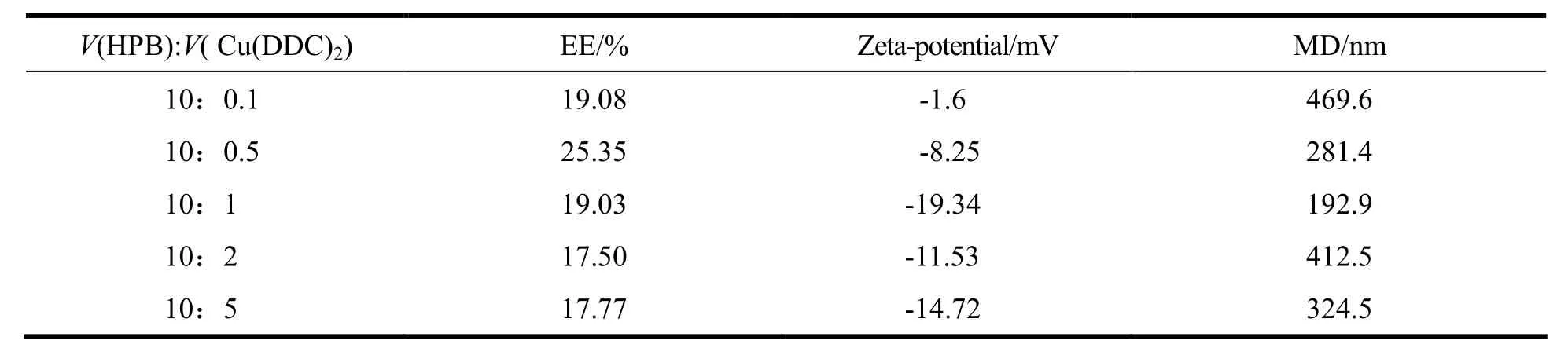
Table 1 Influence of volume ratio of HPB and Cu(DDC)2on EE%, zeta-potential and MD of nanoparticles表 1 HPB和Cu(DDC)2溶液体积比不同对纳米粒包封率、zeta电位和粒径的影响
2.2.3 滴加速度的选择
其他条件不变如2.2.2项所示,用注射器吸取有机相, 滴加时间分别为3 s、5 min、9 min,测定纳米粒的平均粒径分别为170.4、191.7、274.9 nm。由结果可见,滴加速度越快粒径越小,因此滴加速度以最快速度3 s滴加完全。
2.2.4 搅拌速度的选择
其他条件不变如2.2.2项所示,在水浴搅拌速度分别为100 r·min-1和400 r·min-1,粒径分别为137.4 nm和125.5 nm条件下进行考察。结果显示,搅拌速度对粒径没有太大影响,选择转速100 r·min-1即可。
2.2.5 溶液pH值的选择
处方前研究表明,Cu(DDC)2在水中溶解度极低,不受溶液pH值的影响,但是HPB水溶液在pH小于6时,溶解性差且极不稳定,会产生絮凝。所以在处方筛选中还需考虑制剂pH的控制。实验中用缓冲盐配制pH 分别为6.0、7.0、7.5、8.0及9.0的溶液,测定制剂的包封率、zeta电位和粒径,结果见表2。在pH值为7.5时,粒径小于220 nm,包封率较高,随着pH值升高,包封率下降,粒径变化不明显;pH值为6.0时,溶液产生絮状沉淀,无法分析。因此选择pH 7.5配制HPB的缓冲液。

Table 2 Influence of pH of HPB solution on EE%, zeta-potential and MD of nanoparticles表 2 不同pH值的HPB溶液对纳米粒的包封率、zeta电位和粒径的影响
2.2.6 HPB溶液浓度的影响
其他条件不变,分别用PBS配制浓度为2、10、20 mg·L-1的HPB溶液[12]进行实验,结果见表3。由表3可见,HPB浓度越大粒径越小,包封率越大。HPB溶液浓度为10 mg·L-1时各项标准符合要求,当HPB浓度继续增大时,不仅其在水中溶解缓慢而且对制剂没有任何改善,因此选择HPB溶液浓度为20 mg·L-1。

Table 3 Influence of HPB concentration on EE%, zeta-potential and MD of nanoparticles表3 不同浓度HPB溶液对纳米粒的包封率、zeta电位和粒径的影响
2.2.7 投药量的考察
纳米粒包封率和稳定性与投药量有着直接的关系。由于 Cu(DDC)2在水中难溶的性质,使其在外水相中很容易超过饱和溶解度,如果投药量过多,超出了疏水蛋白的承载能力,则会析出黑色药物影响稳定性。实验中分别配制100、500、800、1000、2000 µg·mL-1的Cu(DDC)2DMF溶液,试验结果见表4。由表4可见,投药量越大,包封率越低,但粒径都较均一,当投药量大于0.8 mg·mL-1时,纳米粒室温放置数天易析出结晶,因此固定投药量为0.8 mg·mL-1。

Table 4 Influence of Cu(DDC)2concentration on EE%, zeta-potential and MD of nanoparticles表 4 不同浓度Cu(DDC)2溶液对纳米粒的包封率、zeta电位和粒径的影响
2.2.8 冻干保护剂的筛选
冻结不同的制剂需要不同的保护剂,且浓度也不相同,但至今尚无普遍规律。糖类、多元醇是冻干品良好的支持剂,既能阻止微粒的融合,又能减少包封药物的泄漏。冻干时糖类物质可形成坚固的网状结构,并提供一个相对高的玻璃化转变温度。试验中以甘露醇、葡萄糖、蔗糖、海藻糖、乳糖和麦芽糖作保护剂,考察比较了冻干后制剂的外观和再分散后的粒径保护效果,确定了冻干保护剂的最佳处方和浓度。
实验操作:分别称取上述冻干保护剂粉末适量, 乳糖浓度为0.5 g·L-1和0.25 g·L-1,其余浓度均为0.5 g·L-1和1 g·L-1。取Cu(DDC)2-HPB-NPs混悬液置多个10 mL西林瓶中各1 mL,其中一份加纯净水1 mL,其余分别加入保护剂溶液1 mL, 将样品溶液放入冻干机中冷冻干燥,取出室温观察样品外观及复溶情况。以样品的外观、复溶情况以及复溶前后粒径大小变化为指标,评价冻干保护剂的作用,结果如表5。

Table 5 Effect of cryoprotectants on the appearance of samples after freeze-drying表 5 不同冻干保护剂对样品冻干的影响
结果表明,使用单一冻干保护剂的各制剂中,只有含乳糖、海藻糖的样品外观成饼状,质地柔软,表面实验平整,冻融后未见明显粒子聚集现象。未加冻干保护剂、加入葡萄糖、蔗糖和麦芽糖4种方式的制剂粉末外观均坍塌萎缩在瓶底,冻干保护剂没有发挥支撑保护的作用。加入甘露醇制剂外观良好,但复溶后粒径增大2倍。加入两种冻干保护剂的样品中,含有乳糖和海藻糖的样品,外观良好,复溶后粒径变化也都不大,不含有这两种保护剂的样品,均不符合要求。因此可以得出乳糖和海藻糖这2种糖类适合作为Cu(DDC)2-HPB-NPs的冻干保护剂。
接下来进一步对其浓度进行了筛选。
实验操作:分别称取乳糖和海藻糖粉末适量, 乳糖浓度为0.1、0.25、0.5 g·L-1,海藻糖浓度为0.2、0.5、1.0 g·L-1。其他操作同上,结果如表6。
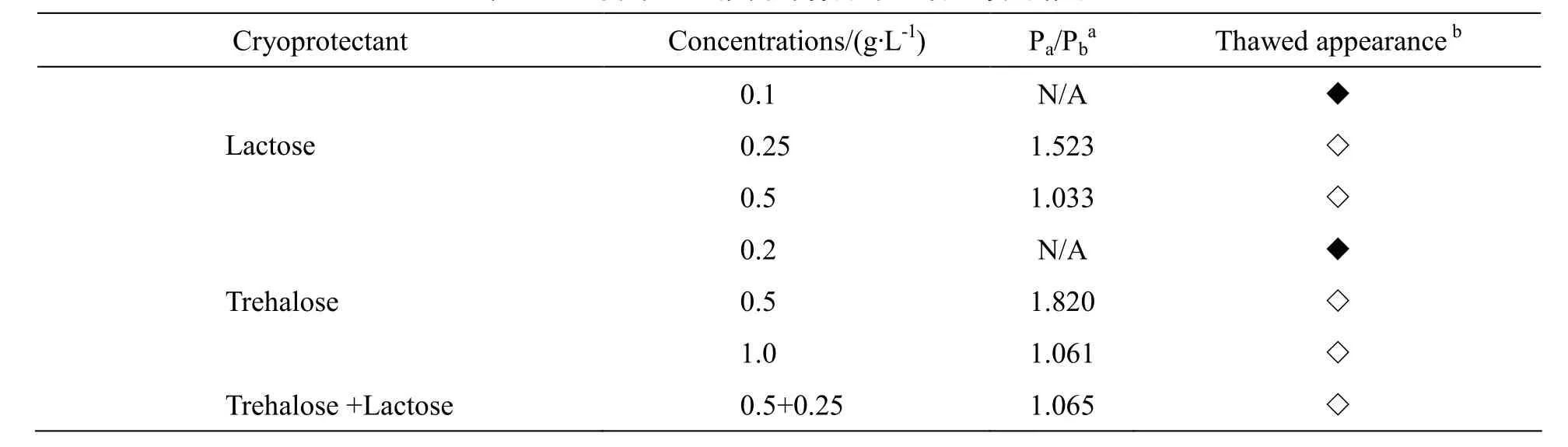
Table 6 Effect of different cryoprotectants in freeze-drying on the properties of nanoparticles表6 不同冻干保护剂对样品冻干后性质的影响
以0.1 g·L-1和0.25 g·L-1的乳糖、0.2 g·L-1和0.5 g·L-1的海藻糖作为冻干保护剂,浓度太低,没有达到支撑的效果,外观没有成饼状且复溶后粒径明显增大,二者以0.5 g·L-1和0.25 g·L-1浓度合用或单独以较高浓度0.5 g·L-1和1 g·L-1使用,保护效果较好,复溶时轻轻振摇即可迅速全部溶解,结果没有显著差异,因此选用浓度相对较低的0.5 g·L-1乳糖作为冻干保护剂。
2.2.9 冻干保护剂的加入方式
冻干保护剂的加入有内加和外加两种方式。内加是在制剂的制备过程中将保护剂溶解在水相中;外加是指将保护剂加至已制备好的制剂中,外加时可以将保护剂以固体或浓溶液两种形式加入。试验中作者发现内加法会影响制剂的粒度分布,所以操作中采用外加保护剂浓溶液的方式。
处方工艺为:在2 mg·L-1的HPB pH7.5的PBS溶液10 mL中,加入800 μg·mL-1Cu(DDC)2的 DMF溶液1 mL,3 s滴加完全,室温搅拌10 min,60℃水浴搅拌10 min后冰浴冷却,装入透析袋中,透析24 h。透析完成后过0.45 μm 的滤膜,后加入0.5 g·L-1乳糖作冻干保护剂,冻干即得。
2.3 Cu(DDC)2-HPB-NPs制剂学性质评价
2.3.1 外观
Cu(DDC)2-HPB-NPs呈带有乳光的澄明液体,肉眼及显微镜下均未见不溶性成分。冻干后为疏松状固体。外观如图3所示。

Fig.3 The appearance of Cu(DDC)2-HPB-NPs图3 Cu(DDC)2-HPB-NPs的外观
2.3.2 形态观察
采用透射电镜观察了Cu(DDC)2-HPB-NPs的粒子形态。实验方法如下:取Cu(DDC)2-HPB-NPs混悬液适量,加蒸馏水稀释10倍,取适量滴至覆有支持膜的铜筛网上,自然干燥后,用透射电镜观察其形态,如图4所示。可见纳米粒子呈圆状,粒径分布比较均匀。

Fig. 4 TEM image of the Cu(DDC)2-HPB-NPs图 4 Cu(DDC)2-HPB-NPs的透射电镜图
2.3.3 粒径测定
采用NicompTMPSS 380动态光散射粒度测定仪测定了Cu(DDC)2-HPB-NPs的粒径分布,制剂的粒度分布为140.81±45.6 nm。
2.3.4 zeta电位测定
zeta电位是微粒表面荷电大小与荷电性质的标志,是影响微粒分散制剂体内分布与体内药物动力学行为的重要参数。试验中采用了NicompTM380/ZLS 动电电位粒度分析仪测定Cu(DDC)2-HPB-NPs粒子的Zeta电位。制剂的zeta电位为 -15.02 mV。
2.3.5 含量测定方法的建立
2.3.5.1 色谱条件
固定相:Diamonsil C18色谱柱(200 mm×4.6 mm,5 μm);流动相:乙腈-0.05mol 磷酸盐缓冲液(体积比80:20;用磷酸调节水相pH7.4);检测波长:435 nm;流速:1 mL·min-1;柱温:25℃;进样量:20 μL;理论塔板数以Cu(DDC)2峰计算应不低于4000。
2.3.5.2 溶液的配制
对照品溶液:精密称取干燥后的Cu(DDC)21 mg,置于10 mL量瓶中,加少量DCM超声溶解并用甲醇稀释至刻度,摇匀,即得对照品储备液;精密量取1 mL对照品储备液,置100 mL量瓶中,加流动相定容,摇匀,即得理论上10 µg·mL-1的Cu(DDC)2对照品溶液。
供试品溶液: 精密称定Cu(DDC)2粉末约10 mg至100 mL量瓶中,加少量DCM超声溶解并用甲醇稀释至刻度,摇匀,即得。
2.3.5.3 专属性试验
精密量取空白HPB-NPs 0.5 mL置10 mL离心管中,加入约3 mL乙腈,涡旋振摇,析出沉淀,乙腈定容,离心,取上清液,经0.45 µm滤膜过滤,进样分析,记录色谱图;精密量取Cu(DDC)2-HPB-NPs同法操作,记录色谱图;配制Cu(DDC)2标准溶液,同法操作,记录色谱图。结果表明HPB-NPs中的成分不干扰Cu(DDC)2的测定,方法专属性良好。
2.3.5.4 线性相关性试验
分别精密量取2.3.5.2项下对照品储备液稀释至1、2、5、10、25、50、100 µg·mL-1。分别进样20 µL,记录色谱图,量取峰面积,以峰面积(A)为纵坐标,以浓度(c)为横坐标,绘制标准曲线。结果表明在1~100 µg·mL-1范围内Cu(DDC)2的峰面积(A)与浓度(c)有良好的线性关系,标准曲线为A=5325.3c+3192.6,r=0.9964。
2.3.5.5 精密度试验
取供试品溶液,连续进样6次,计算得Cu(DDC)2峰面积的相对标准偏差(RSD)为0.3%。取Cu(DDC)26份,依2.3.5.2项下方法制备供试品溶液,分别进样分析。计算得浓度的RSD为1.22%。结果表明仪器和方法的精密度良好。
2.3.5.6 回收率试验
取已知浓度的Cu(DDC)2甲醇溶液,分别精密称量取1.0 mL置10 mL容量瓶中,共9份,每3个为一组分别加入本底浓度80%、100%和120%的对照品溶液,依2.3.5.4项下操作并测定,计算回收率,结果见表7。

Table 7 Recoveries of Cu(DDC)2表7 Cu(DDC)2的回收率
2.3.5.7 含量测定方法
精密量取Cu(DDC)2-HPB-NPs 0.5 mL,置10 mL离心管中,加入适量(3 mL左右)乙腈,涡旋振摇,析出沉淀,加入乙腈定容,离心,取上清液0.45 µm滤膜过滤,进样分析,按外标法计算药物浓度,制剂中Cu(DDC)2浓度为0.3 mg·mL-1。
2.3.6 包封率的测定
取2 mL 纳米粒溶液于离心管中,以6000 r·mim-1离心10 min,除去下层未包封的药物沉淀,游离于溶液中的药物分子忽略不计。取上层溶液0.5 mL,加入4 mL乙腈,涡旋10 min,6000 r·mim-1离心10 min,取上清液测定含量Cd(药物总量Ct为加入的理论量)。按公式[包封率% (EE%)=Cd/Ct×100%]计算包封率。结果显示Cu(DDC)2-HPB-NPs冻干前和复溶后的平均包封率为30%。
2.3.7 体外释药特性研究
2.3.7.1 体外释药测定方法
本实验中采用动态透析法测定Cu(DDC)2-HPB-NPs的体外释药。透析袋是一种具有分子截留作用的半透膜,试验中所用的透析袋截留分子量为 3500,分子量小于3500的游离药物可以自由扩散透过透析袋进入释放介质,而包裹在制剂中的药物被截留在透析袋内缓慢释放。参照溶解度数据,用PBS 8.0缓冲液作释放介质即可达到漏槽条件。
2.3.7.2 测定实验和结果
精密量取Cu(DDC)2-HPB-NPs 2 mL置透析袋中,两端用透析夹夹紧,置于500 mL锥形瓶中,加入250 mL释放介质,同法制得样品3份。将锥形瓶放入37℃的水浴振荡器中,每分钟振荡100次,于0 min、15 min、30 min、45 min、1 h、2 h、4 h、8 h、12 h、24 h 时间点从透析袋中取200 μL 样品,以8000 r·mim-1离心5 min后,用0.45 μm滤膜过滤,最后以HPLC法测定样品含量。释放结果见图5。
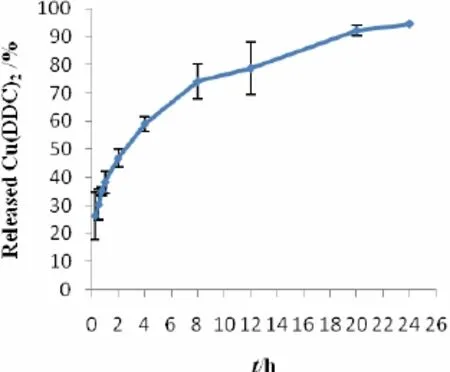
Fig.5 Cumulative release of Cu(DDC)2-HPB-NPs in PBS 8.0图 5 Cu(DDC)2-HPB-NPs在PBS 8.0介质中的累积释放曲线
由图可以看出最初几小时药物有突释现象,Cu(DDC)28 h的累积释放量为74.08%,24 h的释放量为94.50%,表明Cu(DDC)2-HPB-NPs可实现药物的体外延缓释放,但是突释现象应进一步改善和控制。释放曲线经过拟合符合Higuchi 方程,拟合结果为:y=0.15831t1/2+0.22429, r2=0.97425。
2.3.8 血浆稳定性
Cu(DDC)2的血浆稳定性:取浓度为 5 mg·mL-1的Cu(DDC)2DMF储备液 15 µL,分别加入于 37 ℃预热的 0.5、2.5、5 mL 新鲜大鼠空白血浆,向每管加入适量生理盐水使最终体积为 5 mL,摇匀后放置于 37 ℃水浴,分别于 0、0.5、1、2、4、6、8,、10、12、24 h 时间点取样 100 µL,加 900 µL 乙腈沉淀蛋白,涡旋 10 min,以 13000 r·min-1冷冻离心 10 min,取上清液用HPLC法进样分析,测定峰面积,以外标法计算药物含量。试验结果见图6。
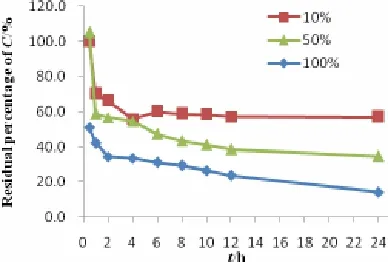
Fig.6 Stability of Cu(DDC)2during incubation with different concentrations of rat plasma图 6 Cu(DDC)2在不同浓度大鼠血浆中孵育的稳定性
实验结果表明Cu(DDC)2在血浆中不稳定,血浆浓度越高降解越快,24 h内10%、50%、100% 血浆中剩余的Cu(DDC)2百分数分别为:56.83%、34.54%、14.15%。将降解曲线分别用零级、一级、Higuchi 方程及Ritger-Papers 方程进行拟合,Higuchi方程拟合相对较好,说明Cu(DDC)2在不同浓度的血浆中降解动力学符合Higuchi方程,结果如表8。
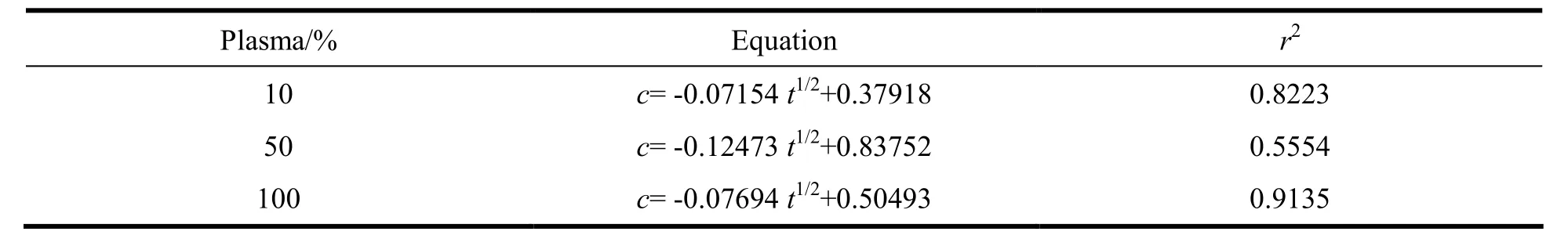
Table 8 Degradation patterns of Cu(DDC)2in rat plasma表 8 Cu(DDC)2大鼠血浆降解动力学模拟方程
Cu(DDC)2-HPB-NPs的血浆稳定性:取0.5 mg·mL-1的Cu(DDC)2-HPB-NPs 0.15 mL,分别加入于37 ℃预热的0.5、2.5、5 mL新鲜大鼠空白血浆中,向每管加入适量生理盐水使最终体积为5 mL,处理和测定方法同上,试验结果见图7。
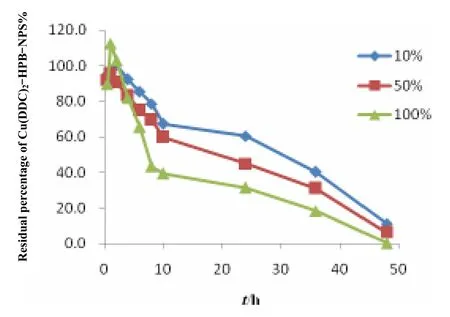
Fig. 7 Stability of Cu(DDC)2-HPB-NPs during incubation with different concentrations of rat plasma图 7 Cu(DDC)2-HPB-NPs在不同浓度大鼠血浆中孵育的稳定性
由图7可见,试验结果与Cu(DDC)2的血浆降解稳定性结果相同。在10%、50%、100%的血浆溶液中24 h后,Cu(DDC)2-HPB-NPs中Cu(DDC)2的剩余量为60.32%、44.87%、31.45%。降解曲线用Higuchi方程拟合结果见表 9。

Table 9 Degradation patterns of Cu(DDC)2-HPB-NPs in rat plasma表 9 Cu(DDC)2-HPB-NPs大鼠血浆降解动力学模拟方程
2.3.9 长期稳定性
将冻干样品在冰箱冷藏(4℃)干燥保存,考察制剂的长期稳定性。如表10所示,储藏温度对制剂的稳定性影响较大。冻干后的Cu(DDC)2-HPB-NPs样品在冰箱冷藏干燥条件下保存3个月时,制剂的外观、粒径和包封率等性质均没有改变,室温放置的样品仅能存放1个月,1个月后的制剂外观就有所塌陷,样品不能完全水化。

Table 10 Stability of lyophilized Cu(DDC)2-HPB-NPs at 4℃表 10 冻干Cu(DDC)2-HPB-NPs在4℃保存的稳定性
3 讨论
3.1 Cu(DDC)2的合成
DSF与CuCl2以物质的量比1:1反应,生成产物产率最高(大于90%),当比例改变时,反应物过剩,会干扰产物的纯化。CuCl2可以用任何二价铜离子代替,如CuSO4,产物溶液的pH 值也会随之改变。光照和室温对反应影响不大,可以忽略不计。但是反应必须在纯水溶液中进行,在缓冲盐中反应生成率会大大降低(低于40%)。在有机溶剂中反应则会生成双二乙基烯氨四硫代环己烷二价阳离子(bis(dialkyliminium)-tetrathiolane dication, Bitt-42+)和Cu+[8],反应过程如图8所示。因此反应过程中应避免缓冲盐和有机溶剂,以免阻碍反应进行。

Fig.8 The reaction of DSF and CuCl2in organic solvent图 8 DSF和CuCl2在有机溶剂中的反应
3.2 处方和制备工艺的考察
Cu(DDC)2的油水分配系数C㏒P=1.51,水溶性极差,脂溶性也不好,利用SDS、PEG、吐温等表面活性剂使其形成混悬液,增溶作用很不显著。但是与疏水蛋白溶液混合后,疏水蛋白能利用其自身结构的变化,将疏水端包裹 Cu(DDC)2,再将亲水端朝外,形成了稳定均匀的纳米粒,使Cu(DDC)2实现了体内给药。本Cu(DDC)2-HPB-NPs处方简单,只加入了低比例的疏水蛋白、调节pH值的缓冲盐和冻干保护剂,没有额外增加表面活性剂等物质,安全性良好。
3.2 血浆稳定性的提高
Cu(DDC)2在体内很快被代谢为甲基-DDC和二乙氨,并被继续代谢,最终排出体外,其在体内稳定性差一直是限制其作用发挥的主要因素。大鼠血浆降解实验中,在10%, 50%和100%的血浆中孵化24 h,制剂Cu(DDC)2-HPB-NPs血浆中残余量分别是Cu(DDC)2化合物的1.06、1.29和2.22倍,这说明HPB外壳能够保护Cu(DDC)2,使其降解反应减缓。
4 结论
合成了 Cu(DDC)2并制备其疏水蛋白纳米粒,24 h体外释放良好。比较了 Cu(DDC)2和Cu(DDC)2-HPB-NPs的体外血浆稳定性,疏水蛋白纳米粒有效地减少了降解,延长了药物在血浆中的作用时间。
[1] 史向国, 钟大放, 郭继芬,等. 双硫仑的化学稳定性及降解产物[J]. 沈阳药科大学学报, 2000, 117(15): 343-346.
[2] JOHANSSON B. A review of the pharmacokinetics and pharmacodynamics of disulfiram and its metabolites[J]. ActaPsychia Scan, 1992, 86: 15-26.
[3] YIP NC, FOBBON IS, LIU P, et al. Disulfiram modulated ROS-MAPK and NFκB pathways and targeted breast cancer cells with cancer stem cell-like properties[J]. British Journal of Cancer, 2011, 104: 1564-1574.
[4] LIU P, BROWN S, Goktug T. Cytotoxic effect of disulfiram/copper on human glioblastoma cell lines and ALDH-positive cancer-stem-like cells[J]. British Journal of Cancer, 2012, 107 (9):1488-1497.
[5] KONA F R, BUAC D, BURGER A M. Disulfiram and disulfiram derivatives as novel potential anticancer drugs targeting the ubiquitin-proteasome system in both preclinical and clinical studies[J]. Current Cancer Drug Targets, 2011, 11: 338-346.
[6] YAKISICH S J, SIDEN A. Disulfiram is a potent in vitro inhibitor of DNA topoisomerases [J]. Biochem Biophys Res Commun, 2001, 289 (2): 586-90.
[7] CHO H, LEE J. Disulfiram suppresses invasive ability of osteosarcoma cells via the inhibition of MMP-2 and MMP-9 expression[J]. J Biochem Mol Biol, 2007,40 (6):1069-76.
[8] REGER M, HOFFMANN H. Hydrophobin coated boehmite nanoparticles stabilizing oil in water emulsions[J]. Journal of Colloid and Interface Science. 2012, 368 (1): 378-386.
[9] 丁靖志, 于雷, 王洪辉, 等. 真菌疏水蛋白的结构和功用[J]. 生物学杂志, 2004, 21(5): 8-11.
[10] SARPARANTA M, BIMBO M L, Intravenous delivery of hydrophobin-functionalized porous silicon nanoparticles: stability, plasma protein adsorption and biodistribution[J]. Molecular Pharmaceutics, 2012, 9 (3): 654-663.
[11] CEN Da-zhi, BRAYTON D. Disulfiram facilitates intracellular Cu uptake and induces apoptosis in human melanoma cells[J]. J Med Chem, 2004, 47:6914-6920.
[12] OPWIS K, GUTMANN S J. Surface modification of textile materials with hydrophobins[J]. Textile Research Journal, 2011, 81 (15): 1594-1602.
Preparation of bis(diethyldithiocarbamate) Cu(II) hydrophobin nanoparticles and its quality evaluation
LIU Zi-tong, XU Hui, HU Xi, FANG Gui-hua, ZHANG Chun-gang, TANG Xing*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo synthesize Bis(diethyldithiocarbamate) Cu(II) and prepare drug loaded nanoparticles with hydrophobin intended to improve the stability of Bis(diethyldithiocarbamate) Cu(II) in plasma.MethodsThe nanoparticles were prepared by dialysis method. The influences of hydrophobin concentration, pH of solution, various types and concentrations of cryoprotectants were investigated with respect to mean particle size distribution, encapsulation efficiency and zeta-potential. The optimal formulation was selected. Results The results of electron micrograph and the size distribution show that the nanoparticles were small and spherical, and the mean diameter of nanoparticles was 140.81±45.6 nm. Thein vitro release of Cu(DDC)2-HPB-NPs reached up to 94.50% in 24 h and the stability of Cu(DDC)2in rat plasma was enhanced to be of 2.2 times in 24 h by being encapsulated in particles of HPB-NPs. The long term storage stability was good in 3 month.ConclusionThe satisfactory appearance, particle size, entrapment efficiency and in vitro release of formulation Cu(DDC)2-loaded hydrophobin nanoparticles show its good application prospect in antitumor therapy.
pharmaceutics; bis(diethyldithiocarbamate) Cu(II)(Cu(DDC)2); hydrophobin(HPB); nanoparticles; cryoprotectants; plasma stability
:: R 94
:A
(本篇责任编辑:时硕坤)
(2015)01-0013-14
10.14146/j.cnki.cjp.2015.01.002
2014-04-24
刘子童(1987-), 女(汉族), 辽宁铁岭人, 硕士, Tel. 024-23986343, E-mail liu-zi-tong@163.com; ***
:唐星(1964-), 男(汉族), 陕西商县人, 教授, 博士, 主要从事口服微粒缓控释制剂和中药现代化研究, Tel. 024-23986343, E-mail tanglab@126.com.
