基于UPLC-MS/MS同时测定猪粪便中5种兽药残留量的研究
2015-03-10顾欣张鑫严凤吴剑平李丹妮
顾欣,张鑫,严凤,吴剑平,李丹妮
(上海市兽药饲料检测所,上海201103)
基于UPLC-MS/MS同时测定猪粪便中5种兽药残留量的研究
顾欣,张鑫,严凤,吴剑平,李丹妮
(上海市兽药饲料检测所,上海201103)
为了建立同时测定猪粪便中二甲氧苄啶、磺胺对甲氧嘧啶、恩诺沙星、金霉素、泰乐菌素5种兽药残留量的超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法,样品经McIlvaine-Na2EDTA缓冲溶液提取,C18粉吸附杂质,HLB固相萃取小柱净化,浓缩富集后用0.1%甲酸甲醇溶液复溶,过滤上机,基质液外标法定量。结果显示,5种兽药在10~500 μg/kg的质量浓度范围内线性良好,在添加浓度50~500 μg/kg,平均回收率为53%~85%,RSD为1.87%~18.81%。该方法具有较好的准确度与精密度,能快速、准确测定猪粪便中5种兽药残留,为养殖环节实时监测兽药使用情况提供了技术支持。
超高效液相色谱-串联质谱;兽药残留;猪粪便
目前,国内兽药残留量的监测方法多针对动物组织,并不适用于养殖环节的活体监测。由于抗生素药物进入动物消化道后,约60%~90%以原形或以代谢物形式经畜禽粪便排泄,为了研究和控制生猪养殖环节中的兽药残留,猪粪做为一种易获得的活体检材具有较高的研究价值,可以实时监测兽药使用情况。因此,有必要建立一种简便、准确的粪便中的兽药残留分析方法。
目前,文献报道的粪便中兽药残留的分析方法多局限于某一类兽药[4-5],而粪便中多类药物残留的研究较少,对养殖场粪便样品中的药物检测缺少相关依据。为了加强对养殖场用药情况的监管,本文建立了利用固相萃取及超高效液相色谱-串联质谱(UPLC-MS/MS)技术同时测定猪粪便中磺胺类、喹诺酮类、四环素类、大环内酯类四类常用兽药,包括二甲氧苄啶(Diaveridine)、磺胺对甲氧嘧啶(Sulfameter)、恩诺沙星(Enrofloxacin)、金霉素(Chlorotetracycline)、泰乐菌素(Tylosin)5种常用兽药残留的分析方法,该法可操作性强,准确度与精密度较高,为养殖环节实时监测兽药使用情况提供了检测方法。
1 材料与方法
1.1 仪器与试剂 超高效液相色谱-串联质谱仪(WatersXevoTMTQ MS,ESI+);电子天平;高速冷冻离心机;漩涡混匀器;超声波清洗器;Waters OasisHLB固相萃取柱(3 mL/40 mg);固相萃取装置;氮吹仪;0.22 μm针式滤器(水相)。二甲氧苄啶、磺胺对甲氧嘧啶、恩诺沙星、金霉素、泰乐菌素对照品(美国Sigma;纯度分别为99%、99%、99.8%、92%、98%),甲酸、甲醇、乙腈(色谱纯);氨水、醋酸、氢氧化钠、磷酸氢二钠、乙二胺四乙酸钠、柠檬酸(分析纯);高纯氮;高纯氩;亲水性C18粉;实验用水均为一级水。
1.2 溶液配置 标准储备液:分别精密称取5种兽药标准品,用适量甲醇溶解并定容至10 mL,配制成质量浓度各为1 mg/mL的标准储备液,置于4℃冷藏保存,有效期6个月;样品提取液:Na2EDTA-McIlvaine缓冲溶液,用NaOH溶液调节pH4.0,现配现用;定容液:0.1%甲酸甲醇水溶液(85/15,V/V),准确量取15mL甲醇,加入85mL0.1%甲酸水溶液,充分混合即得。
1.3 前处理方法 将采集的新鲜粪便样品,充分搅匀,放置在-18℃冰箱冷冻。称取未完全解冻的猪粪便样品1g(精确至0.01g)于50mL离心管中,准确加入C18粉0.5g及McIlvaine-EDTA缓冲液10mL,充分振荡10min,4℃下10000r/min离心10min,移出上清液。重复上述操作,合并两次上清液,备用。
HLB固相萃取小柱(3mL/40mg)用3mL甲醇,3mL水活化。取备用液4mL过柱,依次用 3mL5%甲醇溶液淋洗,3mL甲醇洗脱。收集洗脱液于40 ℃水浴下用氮气吹至近干,用1.0mL0.1%甲酸甲醇水溶液(85/15,V/V)溶解残渣,溶液过0.22μm滤膜后上机测定。
1.4 基质匹配标准品的配置 称取五份空白猪粪便样品各1g(精确至0.01g),按照1.3项下提取、净化、氮气吹干后,分别加入1μg/mL的5种兽药标准品混合工作液10、25、50、100、500μL,再用0.1%甲酸甲醇水溶液(85/15,V/V)定容至1mL,涡旋充分溶解残渣,配制成质量浓度范围为10、25、50、100、500μg/kg的基质匹配标准品,供液相色谱—串联质谱仪测定。
1.5 仪器条件
1.5.1 液相色谱条件 色谱柱:AgilentSBC181.8μm2.1mm×100mm;柱温:35 ℃;进样量:10μL;流动相:A为甲醇,B为0.1%甲酸溶液;流速:0.3mL/min,优化的色谱梯度洗脱程序见表1。

表1 梯度洗脱程序
1.5.2 质谱条件 离子源:电喷雾正离子源;电离模式:正离模式(ESI+);检测方式:多反应检测(MRM);电离电压:3.5 kV;锥孔温度:500 ℃;脱溶剂气流:800 L/Hr;反吹气(氮气):50 L/Hr;定性离子对、定量离子对及对应锥孔电压和碰撞能量见表2。

表2 5种兽药的定性、定量离子及锥孔电压、碰撞能量
2 结果
2.1 标准曲线 按照1.4操作步骤,配制成质量浓度为10、25、50、100、500 μg/kg的基质匹配标准品,供液相色谱-串联质谱仪测定。以质量浓度C为横坐标,以定量离子对相应的色谱峰面积A为纵坐标,绘制5种兽药的基质匹配标准曲线。结果表明:5种药物在10~500 μg/kg质量浓度范围线性良好,线性实验结果见表3。5种兽药基质匹配标准品的MRM色谱图见图1。
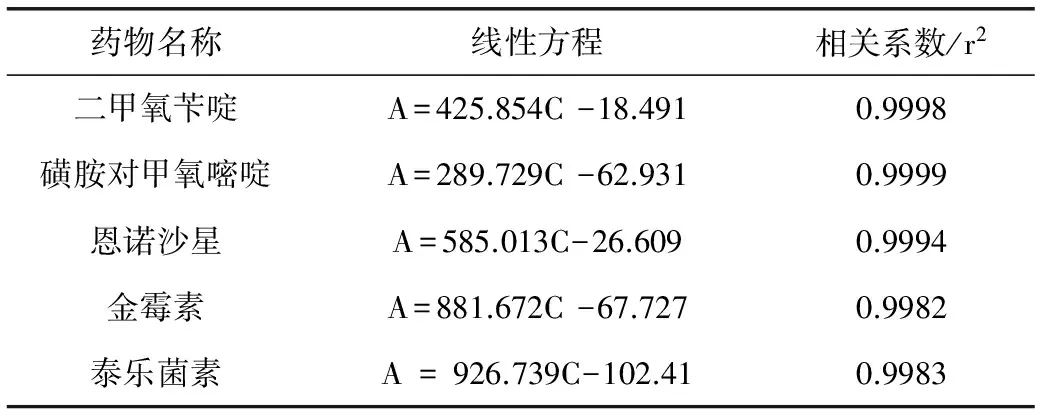
表3 5种兽药的基质添加标准曲线线性方程及相关系数
2.2 准确度与精密度 选取空白粪便样品,准确加入一定质量浓度的5种兽药混合标准品,进行添加回收实验以考察方法的准确度与精密度。在空白粪便中5种兽药各添加高、中、低三个含量水平。添加样品按确定的步骤(1.3)处理并测定,批内相同的质量浓度水平做6次平行实验,重复三个批次。测定结果见表4。
结果表明,猪粪中二甲氧苄啶、磺胺对甲氧嘧啶在三个含量水平下的回收率为72.16%~83.52%,恩诺沙星在三个含量水平下的回收率为66.80%~82.08%,金霉素、泰乐菌素在三个含量水平下的回收率为53.04%~84.08%。批内相对标准偏差(RSD,n=6)均在4.18%~18.81%之间,批间相对标准偏差(RSD,n=3)均在1.87%~17.27%之间。结果表明该方法具有较为良好的准确度和精密度。
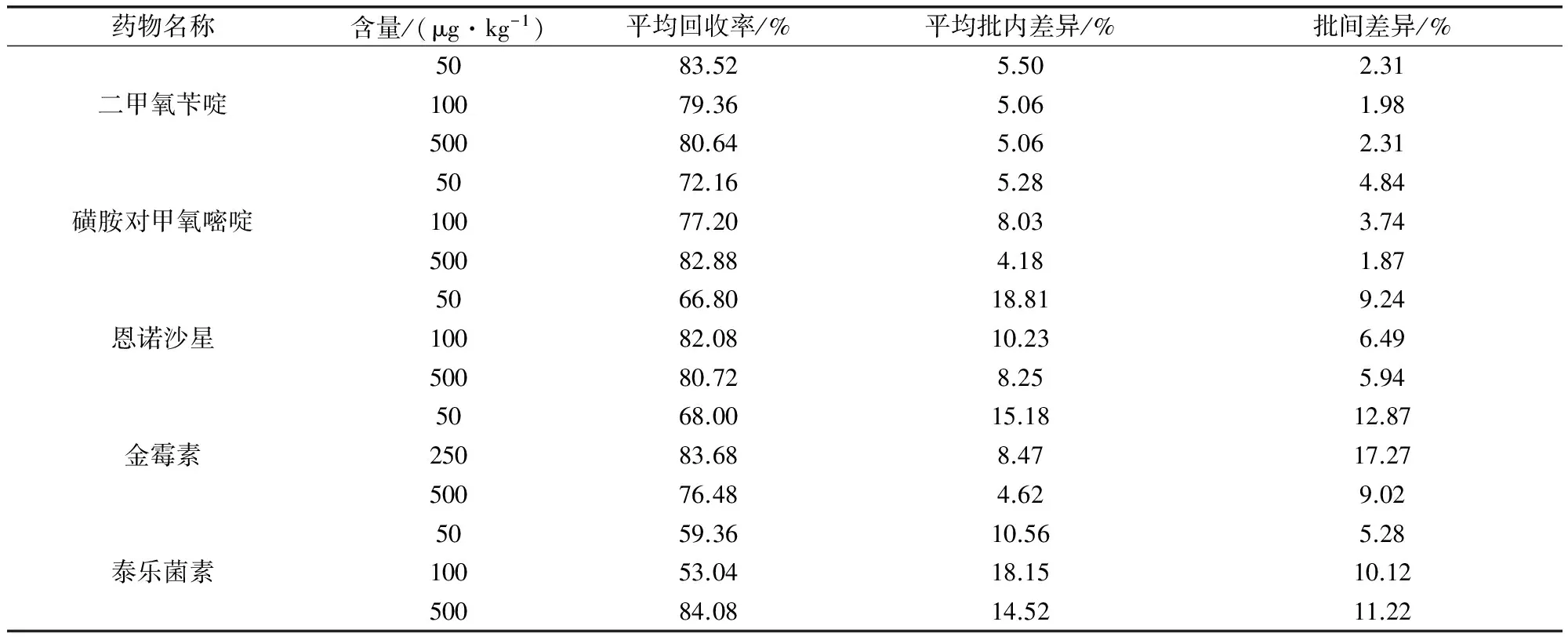
表4 猪粪便中5种兽药批内、批间回收率及相对标准偏差

图1 5种兽药基质匹配标准品的MRM色谱图
2.3 实际样品检测 随机抽取某养殖场的6个粪便样品,采用建立的检测方法进行测定,每份样品做2次平行测定,结果取平均值,检测结果汇总见表5。检测结果显示:金霉素、泰乐菌素、恩诺沙星在实际猪粪便样品中的检出率分别达到100%、33.3%、33.3%。
3 讨论与小结
3.1 提取方法的选择 据文献报道[1-3],磺胺类、氟喹诺酮类[4-5]药物可溶于极性有机溶剂、亲水性有机酸或有机碱、酸/碱水溶液,对提取液的要求不高,而大环内酯类、四环素类药物易与畜禽粪便中大量的金属离子发生螯合反应,并与粪便中的蛋白质发生键合[6],需采用McIlvaine-Na2EDTA缓冲溶液作为提取液,竞争结合金属离子,同时采用C18粉吸附沉淀粪便中的杂质,保证四类药物的游离性。结果证明,McIlvaine-Na2EDTA缓冲溶液提取液可以实现对5种抗生素的同时提取。在对实际样品的分析中发现,亲水性C18粉可以吸附提取液中悬浮的基质物质,使上清液更为清澈;疏水性C18粉起不到净化效果,且不利于下一步的固相萃取操作。同时,结果表明,过量的C18粉会对金霉素、泰乐菌素有一定的吸附作用,这与金霉素、泰乐菌素在C18色谱柱上的保留特性一致;而不加或较少的加入C18粉,会导致固相萃取柱堵塞。

表5实际样品中5种兽药的检测结果表
N.D. : not detected ;
3.2 基质效应的影响 采用液相色谱-串联质谱法分析目标化合物时,分析物的共流出组分会影响电喷雾接口处的离子化效率从而导致基质效应,并表现为增强或抑制作用。猪粪便质地较细,是一种成分复杂的生物样品基质,含有有机质15%,对5种兽药的测定存在明显的基质效应影响,本实验使用基质液配置标准品进行定量,以消除基质对结果的影响,但仍无法消除基质对恩诺沙星、金霉素、泰乐菌素的吸附作用,因此要消除基质效应,还应在前处理方法上进行改进。本文采取了三个措施尽可能多的去除掉基质,取得了较好的效果,一是将样品进行冷冻后分析,并在低温下离心样品提取液;二是将提取液调成酸性,并加入适量的C18粉;三是上样后先用5%甲醇溶液淋洗SPE柱再洗脱,洗脱液不选乙腈,而选择洗脱能力较弱的甲醇。
3.3 小结 本文建立了同时测定猪粪便中二甲氧苄啶、磺胺对甲氧嘧啶、恩诺沙星、金霉素、泰乐菌素5种兽药残留的超高效液相色谱-串联质谱(UPLC-MS/MS)分析方法。基于本方法对实际样品的检测结果表明,在饲喂过兽药的动物粪便样品中,兽药原型的含量已达到本方法可检测的线性范围,该方法具有快速、定性、定量、准确的优点,可用于猪粪便中5种兽药残留的定量测定。
[1] 张春燕. 不同环境基质中抗生素和藻毒素的UPLC/MS/MS分析方法建立与应用[D].河北师范大学,2013.
[2] 吴剑平,张鑫,李丹妮,等. 五种抗菌药物从猪、鸡饲料至有机肥中的药物残留迁移规律研究[J]. 中国兽药杂志,2015,05:43-48.
[3] 张丹俊,潘孝成,赵瑞宏,等. 畜禽粪便中抗菌药物残留检测方法研究进展[J]. 动物医学进展,2008,11:101-103.
[4] 李云辉,吴小莲,莫测辉,等. 畜禽粪便中喹诺酮类抗生素的高效液相色谱-荧光分析方法[J]. 江西农业学报,2011,08:147-150.
[5] 张敏,刘庆玉,敖永华. 高效液相色谱-荧光检测畜禽粪污中四种氟喹诺酮类抗生素残留[J]. 湖北农业科学,2012,03:602-604.
[6] 夏天骄,夏训峰,徐东耀,等. 基于固相萃取-高效液相色谱法的畜禽粪便中四环素类抗生素残留量检测[J]. 安全与环境学报,2013,02:121-125.
(编辑:陈希)
Simultaneous Determination of Five Veterinary Drug Residuesin Swine Manure by Ultra-performance Liquid Chromatography-tandem Mass Spectrometry
GU Xin, ZHANG Xin,YAN Feng,WU Jian-ping,LI Dan-ni
(ShanghaiVeterinaryDrugsandFeedstaffsControlinstitute,Shanghai201103,China)
A method for simultaneously detecting Diaveridine,Sulfameter, Enrofloxacin,Chlorotetracycline and Tylosin in swine manureby ultra-performance liquid chromatography-tandem mass spectrometry was developed. After having been extracted with McIlvaine-Na2EDTA buffer solution, the sample was purified and concentrated by C18 power and HLB solid phase extraction column. The residue was dissolved by 0.1% formic acid/methanol (85/15).The results showed that five veterinary drugs were determined with a fine linear relationship from 10 to 500μg/kg.There coveries of five veterinary drugs spiked with 50~500 g/kg in swine manure were from 53%~85%withRSDsranging from 1.87% to 18.81%. As a result, the method is seized of high accuracy as well as sensitivity for a rapid determination of fiveveterinary drugs in swine manure.
ultra-performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);veterinary drug residues; swine manure
上海市市级农口系统青年人才成长计划(沪农青字(2014)第2-5号);上海市科技兴农重点攻关项目(沪农科攻字(2014)第3-3号)
顾欣,硕士,研究员,从事兽药饲料及畜产品质量安全检测方面研究。E-mail: guxun@sh163.net
2015-08-03
A
1002-1280 (2015) 10-0032-04
S859.796
