高致病性猪繁殖与呼吸综合征GD强弱毒株感染对猪外周血淋巴细胞亚群的影响
2015-03-10张文利王海光孙丰廷刘灿英聪宁宜宝
张文利,王海光,孙丰廷,2,刘灿,英聪,2,宁宜宝*
(1.中国兽医药品监察所,北京100081;2. 华中农业大学,武汉 430070;3. 中国农业大学,北京 100193)
高致病性猪繁殖与呼吸综合征GD强弱毒株感染对猪外周血淋巴细胞亚群的影响
张文利1,王海光1,孙丰廷1,2,刘灿3,英聪1,2,宁宜宝1*
(1.中国兽医药品监察所,北京100081;2. 华中农业大学,武汉 430070;3. 中国农业大学,北京 100193)
为了从细胞水平探讨PRRSV GD 强毒株和PRRSV弱毒疫苗接种仔猪后对其外周血淋巴细胞亚群的影响,运用血常规技术和流式细胞技术分析了猪体外周血淋巴细胞亚群的动态变化。将30日龄20头SPF猪分成3组,分别感染HP-PRRSV GD第5代强毒株、GDr180弱毒疫苗株及留作对照。于感染后第0、3、7、10、14、21、28及35天采血进行外周血淋巴细胞亚群测定,分析淋巴细胞亚群的变化。结果表明:HP-PRRSV GD强毒株感染可导致白细胞、淋巴细胞数量、单核细胞、粒细胞、B细胞、Tc细胞、Th细胞、Tm细胞、和γδT细胞数量的下降;而弱毒疫苗GDr180株免疫则表现为白细胞、淋巴细胞、单核细胞、引起粒细胞、B细胞、Tc细胞、Th细胞和Tm细胞的上升,对γδT细胞的影响不大;阴性对照组在整个检测期间各种细胞基本上保持稳定状态。从实验结果可以看出:与HP-PRRSV GD强毒株破坏免疫细胞不同,PRRSV弱毒疫苗 GDr180株免疫接种能刺激猪免疫细胞增殖,给试验猪提供良好的免疫反应。
高致病性猪繁殖与呼吸综合征;疫苗株;野毒株;猪;外周血淋巴细胞亚群
高致病型猪繁殖与呼吸综合征(High Pathogenic Porcine Reproductive and Respiratory Syndrome,HP-PRRS)是由高致病性猪繁殖与呼吸综合征病毒(HP-PRRSV)引起的一种母猪繁殖障碍和各种日龄(尤其是仔猪)呼吸系统失调的高度接触性传染病,感染猪死亡率高[1-2]。在我国,虽然HP-PRRSV弱毒活疫苗已广泛应用于该病的防控,但是对HP-PRRSV弱毒疫苗的细胞免疫机理的研究鲜有报道,特别是对野毒株与疫苗株同时对比的研究报道更少。HP-PRRSV诱导的免疫系统应答和其他多数猪源病毒性病原不一样,宿主免疫系统一方面为PRRSV的复制提供场所,另一方面在感染后产生特异性的细胞免疫和体液免疫,为病毒清除发挥重要作用[3]。Pauly T等[4]的研究表明:细胞免疫在抗PRRSV免疫中发挥着重要的作用,试验猪在人工感染PRRSV后第3~28天CD4+T/CD8+T的比值较感染前显著下降,细胞因子的反应主要是IFN-γ的反应和少量的IL-2反应[5]。本实验研究分析了HP-PRRSV GD强毒株和用其人工减弱的GDr180疫苗株感染猪后外周血和淋巴结中淋巴细胞亚群的变化特征,比较了疫苗株和野毒株在动物体内对细胞免疫功能的影响,从而为HP-PRRSV疫苗的细胞免疫机理研究提供理论依据。
1 材料
1.1 实验动物和毒株 SPF猪: 20头30日龄PSF仔猪,购于北京市SPF猪育种管理中心。HP-PRRSV GD-F5强毒株:由本实验室分离、鉴定和保存。HP-PRRSV GDr180疫苗株,由本实验室弱化培育。
1.2 试剂 抗体:SPRD标记小鼠抗猪CD3ε、FITC标记小鼠抗猪CD4、PE标记小鼠抗猪CD8、PE标记小鼠抗猪SWC3a、FITC标记小鼠抗猪CD21等抗体购于北京博蕾德生物科技有限公司(购买于southern biotech,Birmingham,USA);猪繁殖与呼吸综合征ELISA抗体检测试剂盒:购于IDEXX试剂公司。胎牛血清:购于Life Technologies 生物公司。红细胞裂解液:购于德国RD试剂公司。1%多聚甲醛磷酸缓冲液:1 g多聚甲醛溶于100 mL 0.01 mol/L pH7.4 PBS中,与60 ℃加热助溶。
2 方法
2.1 动物实验 将30日龄20头SPF猪随机分成三组,强毒组和弱毒组每组7头,空白对照组每组6头,各个组之间饲养在不同的动物舍,分开隔离饲养。在30日龄时接种病毒。实验动物分组和感染情况见表1。试验期间,每天观察实验猪的临床症状,测量直肠温度,记录结果。

表1 实验动物分组和攻毒情况
2.2 猪外周血淋巴细胞亚群数量的测定 将DPI 0、3、7、10、14、21、28、35 d采集的抗凝血混匀后,用血细胞计数仪吸取100 uL计数,获得外周血白细胞和淋巴细胞总数的绝对值,用于外周血白细胞、淋巴细胞数量的测定和外周血淋巴细胞亚群的分析。
2.3 粒细胞及单核细胞数量的确定 取100 uL抗凝血于2 mL离心管中,加入2 uL PE标记小鼠抗猪SWC3a单克隆抗体,室温避光作用30 min,加入红细胞裂解液1mL,轻弹管壁并上下颠倒离心管两至三次,避光裂解3 min,300 g离心2 min,用含1%胎牛血清的PBS洗涤一次,加入1%的多聚甲醛固定,上机进行细胞检测。用专门的细胞分析软件Cell Quest Pro分析,鉴定方法如下:SWC3aSSChigh为粒细胞,SWC3aSSClow为单核细胞。粒细胞和单核细胞数量=血细胞计数仪测定的白细胞总数×流式细胞仪所分析细胞中阳性细胞的百分数。
2.4 B细胞数量的测定 取100 uL抗凝血于2 mL离心管中,加入2 uL FITC标记小鼠抗猪CD21单克隆抗体,室温避光作用30 min,加入红细胞裂解液1 mL,轻弹管壁并上下颠倒,离心三次,避光裂解3 min,300 g离心2 min,用含1%胎牛血清的PBS洗涤一次,加入1%的多聚甲醛,上机进行细胞检测。用专门的细胞分析软件分析,鉴定方法如下:CD21阳性细胞为B细胞。B细胞绝对数=血细胞计数仪测定的淋巴细胞总数×流式细胞仪所分析的B细胞占淋巴细胞的百分数。
2.5 三色流式细胞术测定猪外周血T淋巴细胞亚群数量 取100 uL抗凝血于2 mL离心管中,加入2 uL SPRD标记小鼠抗猪CD3单克隆抗体,加入2 uL FITC标记小鼠抗猪CD4单克隆抗体,加入2 uL PE标记小鼠抗猪CD8单克隆抗体进行染色,室温避光作用30 min,加入红细胞裂解液1 mL,轻弹管壁并上下颠倒离心管两至三次,避光裂解3 min,300 g离心2 min,用含1%胎牛血清的PBS洗涤一次,加入1%的多聚甲醛,上机进行细胞检测。用专门的细胞分析软件分析,鉴定方法如下:CD3+CD4-CD8+为辅助性T(Th)细胞,CD3+CD4+CD8-为杀伤性T(Tc)细胞,CD3+CD4+CD8+为活化/记忆T细胞,CD3+CD4-CD8 low/-为γδT细胞。
各亚群细胞的绝对数=细胞计数仪测定的淋巴细胞×流式细胞仪所分析的各亚群细胞占淋巴细胞的百分含量,T细胞绝对数=Th细胞+Tc细胞+活化/记忆细胞+γδT细胞。
3 结果
3.1 体温变化 除GD强毒感染的7头猪在感染后第4天体温均升至41 ℃,持续3~4 d以外,弱毒疫苗感染的7头猪和阴性对照6头猪均无体明显体温变化。
3.2 HP-PRRSV GD强弱毒感染后外周血白细胞数量的变化 在HP-PRRSV感染后不同的天数内采集实验猪的外周血(抗凝血),进行白细胞数量的测定,空白对照组在1.5×107/mL左右变化 ,结果见图1。
据阿里方面向《中国储运》记者透露的数据,口碑和饿了么一起在676个城市服务商家达到350万。在饿了么的平台上,有66.7万的月度活跃骑手为消费者服务,平均每个用户每年下单近20次;在口碑的平台上,1.67亿月度活跃用户充分享受着完善的到店服务。

图1 外周血白细胞数量的变化
弱毒组外周血白细胞数量在免疫第三天后迅速上升,然后一直平缓下降至第14天,随后开始上升。强毒组在攻毒后的白细胞数量一直低于空白对照组,在第14天显著降低,并一直处于较低的水平。空白对照组外周血白细胞数量在整个过程中相对稳定。结果表明,HP-PRRSV GD强毒株可以导致白细胞数量的减少,而GDr180代疫苗株可以刺激机体产生更多的白细胞。
3.3 HP-PRRSV GD强弱毒感染后外周血淋巴细胞的数量的变化 在HP-PRRSV感染后不同的天数内采集实验猪的外周血(抗凝血),进行淋巴细胞数量的测定,空白对照组在1.2×107/mL左右变化,结果如图2。

图2 外周血淋巴细胞数量的变化
强毒组在感染的前一个星期处于较高的水平,然后下降,并且一直低于空白对照组直至实验结束。而弱毒组从免疫后淋巴细胞的数量就开始下降直至第10天,然后快速上升至第21天,开始趋于平稳。空白对照组外周血淋巴细胞数量在整个过程中相对稳定。结果表明,HP-PRRSV弱毒株GDr180可以引起淋巴细胞的上升,而强毒株则引起淋巴细胞数量的下降。
3.4 HP-PRRSV GD强弱毒感染后外周血单核细胞数量的变化 在HP-PRRSV感染后不同天数内采集实验猪的外周血(抗凝血),进行单核细胞数量测定,空白对照组在1.5×106/mL左右变化,结果如图3。
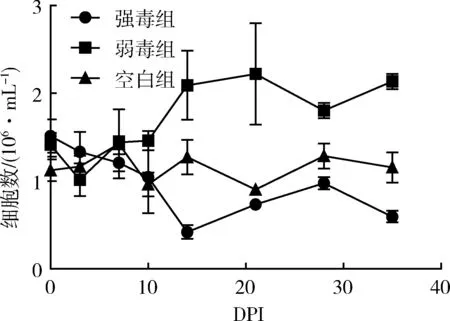
图3 外周血单核细胞数量的变化
强毒组在攻毒后一直处于较平稳的状态,在第10天时明显低于空白组,并且一直保持到整个实验结束;弱毒组在前10天一直和空白组保持相近的水平,然后一直上升。空白对照组外周血单核细胞数量在整个过程中相对稳定。结果表示,HP-PRRSV弱毒株GDr180可以引起单核细胞的上升,而强毒株可以引起单核细胞数量的下降。
3.5 HP-PRRSV GD强弱毒感染后外周血粒细胞数量的变化 在HP-PRRSV强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行粒细胞数量的测定,空白对照组在8×106/mL左右变化,结果如图4。
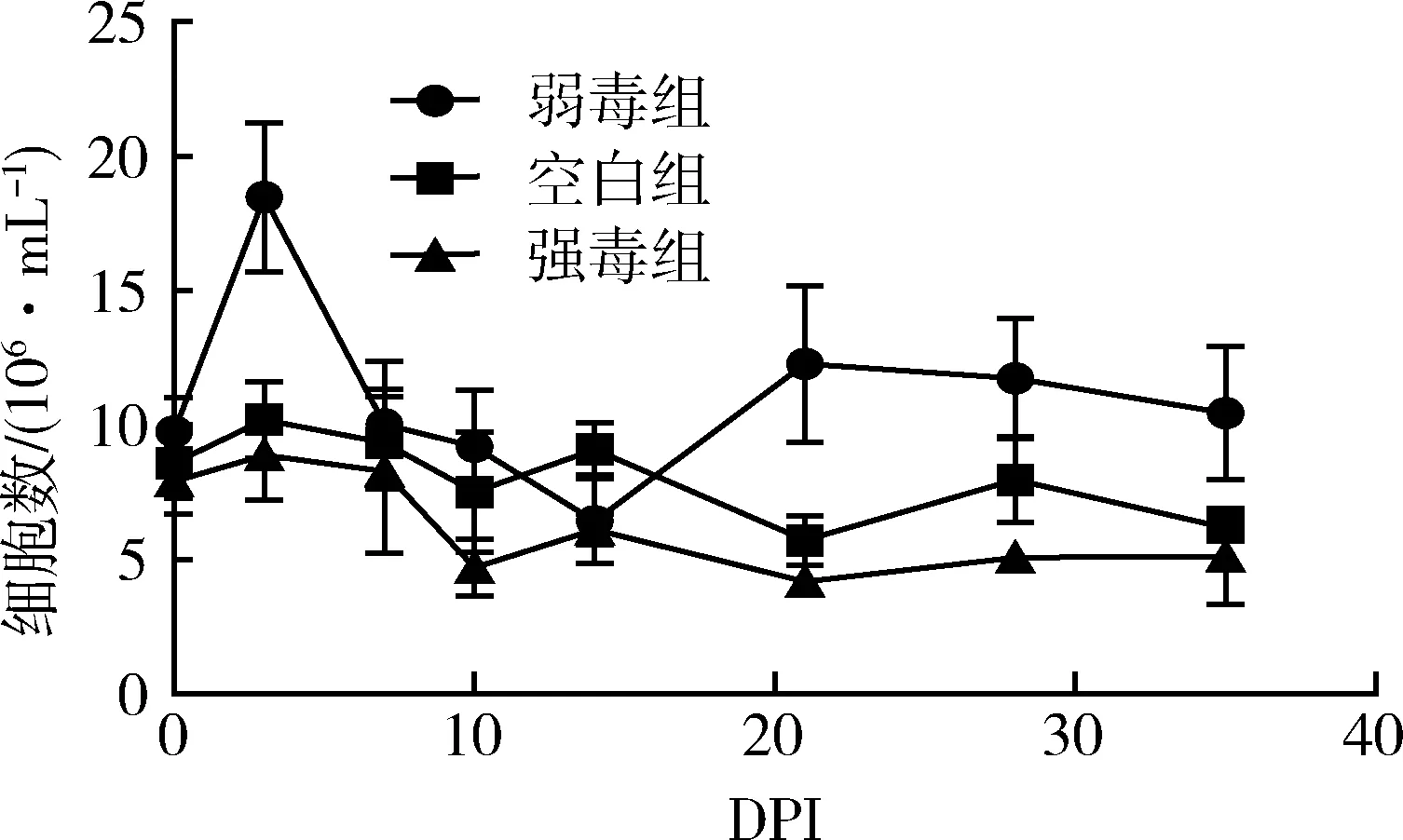
图4 外周血粒细胞数量的变化
弱毒组在免疫后粒细胞数量迅速上升,然后又迅速下降至空白组水平,接着继续上升,并且一直保持高于空白组的状态直至实验结束。强毒组感染后一直处于稍低于空白组的状态直至实验结束。空白对照组外周血粒细胞数量在整个过程中相对稳定。结果表明,HP-PRRSV弱毒株GDr180可以引起粒细胞的上升,而强毒株可以引起粒细胞数量的下降。
3.6 HP-PRRSV GD强弱毒感染后外周血B细胞的数量的变化 在HP-PRRSV强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行B细胞数量的测定,空白对照组在1.0×106/mL左右变化,结果如图5。

图5 外周血B细胞数量的变化
弱毒组在免疫后开始处于比较稳定的水平和空白组无明显差别,在14 d后迅速上升,并且一直处于较高的水平直至实验结束。强毒组在攻毒后的14 d一直处于低于比空白组的水平。空白对照组外周血B细胞数量在整个过程中相对稳定。实验结果表明,HP-PRRSV弱毒株GDr180可以引起B细胞的上升,而强毒株可以引起B细胞数量的下降。
3.7 HP-PRRSV GD强弱毒感染后外周血T细胞亚群数量的变化
3.7.1 外周血Tc细胞数量的变化 在HP-PRRSV GD强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行T细胞亚群数量的测定,结果如图6所示。
弱毒组在免疫后刚开始变化不大,在第10天开始上升直至第21天,随后变得平稳,并一直高于空白组的水平。强毒组在感染后一直保持与空白组相当的水平,在第10天时低于空白组,并且在实验结束时都低于空白组。空白对照组外周血Tc细胞数量在整个过程平稳上升。实验结果表明,HP-PRRSV弱毒株GDr180可以引起Tc细胞的上升,而强毒株可以引起Tc细胞数量的下降。

图6 外周血Tc细胞数量的变化
3.7.2 外周血Th细胞数量的变化 在HP-PRRSV GD强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行Th细胞数量的测定,结果如图7所示。
弱毒组在免疫后开始处于比较稳定的水平和空白组无明显差别,在14 d后迅速上升,并且一直处于较高的水平直至实验结束。强毒组在攻毒后的14 d一直处于低于比空白组的水平,而且随着时间的延长,更加明显低于空白组。空白对照组外周血Th细胞数量在整个过程中相对稳定。实验结果表明,HP-PRRSV弱毒株GDr180可以引起Th细胞的上升,而强毒株可以引起Th细胞数量的下降。
3.7.3 外周血Tm细胞数量的变化 在HP-PRRSV GD强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行Tm细胞数量的测定,结果如图8所示。

图8 外周血Tm细胞数量的变化
弱毒组在免疫后开始处于比较稳定的水平和空白组无明显差别,在14 d后迅速上升,并且一直处于较高的水平直至实验结束。强毒组在攻毒后的14 d一直处于低于比空白组的水平,而且随着时间的延长,更加明显低于空白组。空白对照组外周血Tm细胞数量在整个过程中相对稳定。实验结果表明,HP-PRRSV GDr180弱毒株可以引起Tm细胞的上升,而强毒株可以引起Tm细胞数量的下降。
3.7.4 外周血γδT细胞数量的变化 在HP-PRRSV强弱毒感染后不同的天数内采集实验猪的外周血(抗凝血),进行γδT细胞数量的测定,结果如图9所示。

图9 外周血γδT细胞数量的变化
弱毒组在免疫后开始处于比较稳定的水平和空白组无明显差别直至实验结束。强毒组在攻毒后一直处于低于空白组的水平,在第7天时处于最低点,而且随着时间的延长,更加明显低于空白组。空白对照组外周血γδT细胞数量在整个过程中相对稳定。实验结果表明,PRRSV弱毒株GDr180对γδT细胞的影响不大,而强毒株可以引起γδT细胞数量的下降。
4 讨论与小结
T淋巴细胞根据分化抗原和MHC抗原的不同和是否表达CD8和CD4,可划分为Tc细胞,Th细胞,Tm细胞和γδT细胞。细胞免疫在抵抗病毒感染中发挥着重要的作用,因为Tc细胞可特异性的杀伤靶细胞;Th细胞可促进T细胞的增殖活化,并且与B细胞作用可促进B细胞产生特异性的抗体;Tm细胞可产生免疫记忆,对于下次同种抗原的再次入侵发挥更强大的免疫效应;B细胞介导的体液免疫在抗病毒感染中也发挥着重要作用,因为B细胞的增殖活化可产生中和抗体,与病毒结合使其被清除;白细胞亚群包括白细胞、单核细胞和粒细胞。白细胞是机体防御系统的一个重要组成部分。它通过吞噬和产生抗体等方式来抵御和消灭入侵的病原微生物[6]。
实验中PRRSV GDF5强毒感染后,猪体内各种T、B淋巴细胞;白细胞、单核细胞和粒细胞等数量降低,并且绝对值都低于空白对照组,说明PRRSV强毒对猪体具有免疫抑制作用。HP-PRRSV GDr180弱毒株免疫后,猪体内的各种淋巴细胞和白细胞在刚开始和空白水平无明显差别,在免疫后大约2周后出现上升,说明HP-PRRSV GDr180疫苗株不会对仔猪的免疫系统造成抑制,反而会刺激猪体产生更强的免疫保护作用。
大量实验室研究和临床数据证明,HP-PRRS体液免疫在疾病预防控制中作用有限,由于PRRSV 的抗体依赖特性的存在,在低抗体水平情况下,抗体不但不能减轻PRRS的疾病程度,反而促进了PRRSV的增殖,加重蓝耳病的严重性。由此可见,单凭体液免疫不能有效防控猪蓝耳病,同时,大量的临床数据表明,HP-PRRS减毒活疫苗在蓝耳病防控中的作用显著优于灭活疫苗,究其原因,可能是细胞免疫发挥了重要作用。本研究结果表明:与HP-PRRS GD强毒株感染后各种免疫细胞显著下降不同,HP-PRRS GDr180弱毒疫苗免疫猪 的各种免疫细胞在疫苗免疫两周后均明显上升,其上升量甚至明显高于非免疫正常对照组。由此可见,弱毒活疫苗免疫猪的细胞免疫在疾病控制中发挥了重要作用。
[1] Tian K, Yu X, Zhao T,etal. Emergence of fatal PRRSV variants: unparalleled outbreaks of a typical PRRS in China and molecular dissection of the unique hallmark[J]. PLoS One, 2007, 2(6): e526.
[2] 宁宜宝, 郑 杰, 张纯萍. 我国南方猪高热病的研究(Ⅱ)——猪繁殖与呼吸综合征病毒的分离、鉴定和致病性测定[J]. 中国兽药杂志, 2007, 41(4): 14-18.
[3] Yoon K J, Zimmerman J J, Swenson S L,etal. Characterization of the humoral immune response to porcine reproductive and respiratory syndrome (PRRS) virus infection.[J]. J Vet Diagn Invest, 1995, 7(3): 305-312.
[4] Pauly T, Weiland E, Hirt W,etal. Differentiation between MHC-restricted and non-MHC-restricted porcine cytolytic T lymphocytes[J]. Immunology, 1996, 88(2): 238-246.
[5] Shimizu M, Yamada S, Kawashima K,etal. Changes of lymphocyte subpopulations in pigs infected with porcine reproductive and respiratory syndrome (PRRS) virus [J]. Vet Immunol Immunopathol, 1996, 50(1/2): 19-27.
[6] 宁宜宝. 兽用疫苗学[M]. 中国农业出版社, 2009.
(编辑:李文平)
·新闻资讯·
《中国兽药杂志》入编《中文核心期刊要目总览》
自《中文核心期刊要目总览》2014年版编委会2015年7月获悉:依据文献计量学的原理和方法,经研究人员对相关文献的检索、统计和分析,以及学科专家评审,《中国兽药杂志》入编《中文核心期刊要目总览》2014年版(即第七版)之畜牧、动物医学、狩猎、蚕、蜂类的核心期刊。
欢迎踊跃投稿!http://zgsyzz.ijournals.cn
Study on Changes of Lymphocyte Subpopulations in Peripheral Blood of the Pigs Inoculated with Highly Pathogenic PRRSV GD Wild and Vaccine Strain
In the study, we used an immunofluorescence assay to investigate changes in lymphocyte subpopulations in peripheral blood of the specific-pathogen-free (SPF) pigs inoculated with highly pathogenic porcine reproductive and respiratory syndrome virus (HP-PRRSV) GD wild and vaccine strains, which was in a cellular way to discuss the effect between the lymphocyte subpopulations in peripheral blood of the SPF pigs and HP-PRRSV GD wild and vaccine type. SPF pigs inoculated with PRRS wild virus showed remarkable decreases in total lymphocytes,white blood cells,monocytes,granulocytes,B cells,Tc cells,Th cells, Tm cells and γδT cells, while SPF pigs inoculated with PRRS vaccine virus increases in total lymphocytes,white blood cells,monocytes,granulocytes,B cells, Tc cells, Th cells,Tm cells after PID 3, and the numbers of all cells remain substantially stable in the negative control group. From these results we can conclude that HP-PRRSV GD wild type can destroy immune cells, while HP-PRRSV GD vaccine type can stimulate immune cell proliferation, which provides a good immune response to the pigs.
highly pathogenic porcine reproductive and respiratory syndrome; vaccine strain; virulent strain; pig; lymphocyte subpopulations in peripheral blood
张文利,硕士,从事分子病毒学研究。
宁宜宝。E-mail: ningyibao@ivdc.org.cn
2015-08-07
A
1002-1280 (2015) 09-0001-06
S858.28
(1.ChinaInstituteofVeterinaryDrugControl,Beijing100081,China; 2.HuazhongAgricultureUniversity,Wuhan430070,China; 3.ChinaAgricultureUniversity,Beijing100093,China)
ZHANG Wen-li1, WANG Hai-guang1, SUN Feng-ting1,2, LIU Can3, YING Cong1,2, NING Yi-bao1*
