吲哚-2,3-二酮对肿瘤坏死因子α所致大鼠主动脉平滑肌A7r5细胞增殖的影响Δ
2015-03-09刘占涛杨志宏赵永娟冀立霞郭锡春青岛大学医学院药学院山东青岛266021
刘占涛,杨志宏,赵永娟,冀立霞,郭锡春,岳 旺,尹 磊(青岛大学医学院药学院,山东青岛 266021)
动脉粥样硬化(Atherosclerosis)是最常见的心血管疾病之一,主要累及大中动脉,并可引起一系列继发性病变[1]。近年来,人们逐渐认识到动脉粥样硬化等心血管疾病与炎性反应有着十分密切的关系。血管内皮细胞受损时,释放大量的炎性因子如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等,引起平滑肌细胞增殖,最终形成动脉粥样硬化[2]。通过抑制血管平滑肌细胞移行及增殖的物质,可延缓或抑制动脉粥样硬化病变的形成[3]。
吲哚-2,3-二酮的化学结构明确,生物活性广泛。本课题组前期研究表明,其具有抗炎和抗动脉粥样硬化的作用[4-6]。本研究采用大鼠主动脉平滑肌细胞A7r5,观察吲哚-2,3-二酮对TNF-α所致A7r5 细胞增殖和细胞周期的影响,初步探讨吲哚-2,3-二酮对动脉粥样硬化炎性反应的作用机制,为其临床应用提供参考。
1 材料
1.1 仪器
BB5060UV 型CO2培养箱(德国赫利公司);SW-CJ-40 型超净工作台(上海苏净实业有限公司);CKX41 型倒置显微镜(日本Olympus公司);550型酶标仪(瑞典Rosys Anthos公司);流式细胞仪(美国BD公司)。
1.2 药品与试剂
吲哚-2,3-二酮(青岛大学药物研发基地提供,纯度:99.7%);高糖改良马丁琼脂(DMEM)培养基、胎牛血清、MTT(美国Sigma 公司);碘化丙啶(PI)染液(南京凯基生物科技发展有限公司);TNF-α(北京天来生物医学科技有限公司)。
1.3 细胞
大鼠主动脉平滑肌A7r5 细胞,购于中国科学院上海生命科学院细胞库。
2 方法
2.1 培养基和溶液的组成
10%DMEM 培养基:10%胎牛血清、100 μg/ml 链霉素、100 u/ml青霉素、DMEM培养基。20%DMEM培养基:20%胎牛血清、100 μg/ml 链霉素、100 u/ml 青霉素、DMEM 培养基。磷酸盐缓冲液(PBS):氯化钾0.10 g/L、磷酸氢二钠1.75 g/L、氯化钠8.00 g/L、磷酸二氢钾0.10 g/L,双蒸水配制。
2.2 细胞的培养
取A7r5 细胞用10% DMEM 培养基培养,在37 ℃下5%CO2的培养箱内传代培养,取指数生长期的细胞进行试验。
2.3 吲哚-2,3-二酮试验质量浓度的确定
收集指数生长期A7r5 细胞,确定细胞浓度为1×105ml-1,接种到96 孔板,每孔100 μl,24 h 细胞贴壁后分为(1)对照组:加入100 μl无血清培养基;(2)试验组:加入含不同质量浓度吲哚-2,3-二酮的无血清培养基100 μl,最终质量浓度分别为10-11、10-10、10-9、10-8、10-7、10-6、10-5mg/ml。24 h后弃上清液,每孔加入MTT溶液20 μl,37 ℃孵育4 h后弃孔内液体,每孔加入150 μl 二甲基亚砜(DMSO)溶液,振荡1 min,在570 nm 波长处检测光密度(OD),用OD值表示细胞存活情况。试验重复3次。以OD值确定吲哚-2,3-二酮的试验质量浓度。
2.4 TNF-α造模质量浓度的确定
收集指数生长期A7r5 细胞,确定细胞浓度为1×105ml-1,每孔100 μl,接种到96 孔板内,24 h 细胞贴壁后,将培养基更换为无血清培养基,24 h后使细胞同步化于G0/G1期。将细胞分为(1)空白组:加入20%DMEM 培养基;(2)TNF-α组:加入含不同质量浓度TNF-α的20%DMEM培养基,使其最终质量浓度分别为0.078、0.156、0.625、2.5、5、10、20、40、80 ng/ml。48 h后弃去上清液,每孔加入MTT溶液20 μl,孵育4 h后吸出MTT 溶液,每孔加入DMSO 150 μl,在气浴振荡仪中振荡10 min使结晶物完全溶解,在570 nm波长处检测OD值。试验重复3次。以OD值确定TNF-α的造模质量浓度。
2.5 吲哚-2,3-二酮对TNF-α所致A7r5细胞增殖的影响
收集指数生长期A7r5 细胞,确定细胞浓度为1×105ml-1,接种到96孔板内,每孔100 μl,24 h细胞贴壁后,将培养基更换为无血清培养基,24 h后使细胞同步化与G0/G1期。将细胞分为(1)空白对照组:加入20%DMEM培养基;(2)模型组:加入含5 ng/ml TNF-α的20% DMEM 培养基;(3)吲哚-2,3-二酮组:加入含5 ng/ml TNF-α和10-8、10-7、10-6、10-5mg/ml 吲哚-2,3-二酮的DMEM培养基。孵育48 h,弃去上清液,每孔加入20 μl MTT 溶液,孵育4 h 后吸出MTT 溶液,每孔加入DMSO 150 μl,在气浴振荡仪中振荡10 min 使结晶物完全溶解,在570 nm波长处检测OD值。试验重复3次。
2.6 吲哚-2,3-二酮对TNF-α所致A7r5细胞增殖周期的影响
收集指数生长期A7r5 细胞,分组和给药同“2.5”项,孵育48 h,用0.25%的胰蛋白酶溶液消化细胞并收集细胞,以预冷的PBS 溶液洗涤细胞2 次,将细胞重悬于70%的冰乙醇溶液中,-20 ℃固定1 h。再将各组细胞用PBS清洗1次,分别加入500 μl PBS 与5 μl RNA 酶于37 ℃孵育1 h,加入5 μl PI 染液,检测各组细胞的周期分布。试验重复3次。
2.7 统计学方法
采用SPSS 17.0 统计软件对数据进行分析。数值均以表示,组间比较采用方差分析。P<0.05 表示差异具有统计学意义。
3 结果
3.1 吲哚-2,3-二酮试验质量浓度的确定
结果显示,与对照组比较,10-11、10-10、10-9、10-8、10-7、10-6、10-5mg/ml 的吲哚-2,3-二酮对A7r5 细胞的存活无明显影响,差异无统计学意义(P>0.05)。综合考虑,选择吲哚-2,3-二酮的试验质量浓度为10-8、10-7、10-6、10-5mg/ml,结果见表1。
表1 不同质量浓度吲哚-2,3-二酮对A7r5 细胞存活的影响(,n=3)Tab 1 Effects of different concentrations of indol-2,3-dione on A7r5 cell survival(,n=3)
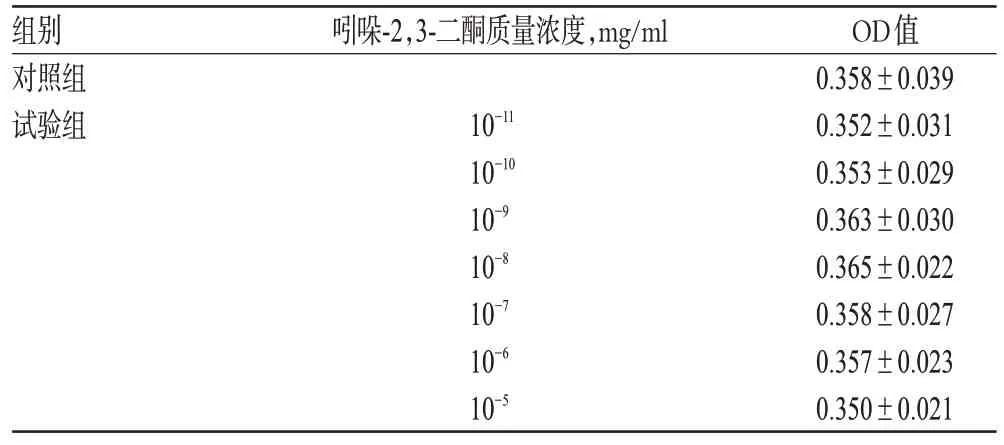
表1 不同质量浓度吲哚-2,3-二酮对A7r5 细胞存活的影响(,n=3)Tab 1 Effects of different concentrations of indol-2,3-dione on A7r5 cell survival(,n=3)
3.2 TNF-α造模质量浓度的确定
与空白组比较,0.078、0.156、0.625、2.5、5、10、20、40、80 ng/ml的TNF-α均能增加A7r5细胞的存活,差异具有统计意义(P<0.01)。其中5 ng/ml TNF-α与其余质量浓度比较,细胞存活增加更明显,差异具有统计学意义(P<0.01)。因此,确定5 ng/ml为TNF-α的造模质量浓度。不同质量浓度TNF-α对A7r5细胞存活的影响见表2。
表2 不同质量浓度TNF-α对A7r5 细胞存活的影响(,n=3)Tab 2 Effects of different concentrations of TNF-α on A7r5 cell survival(,n=3)
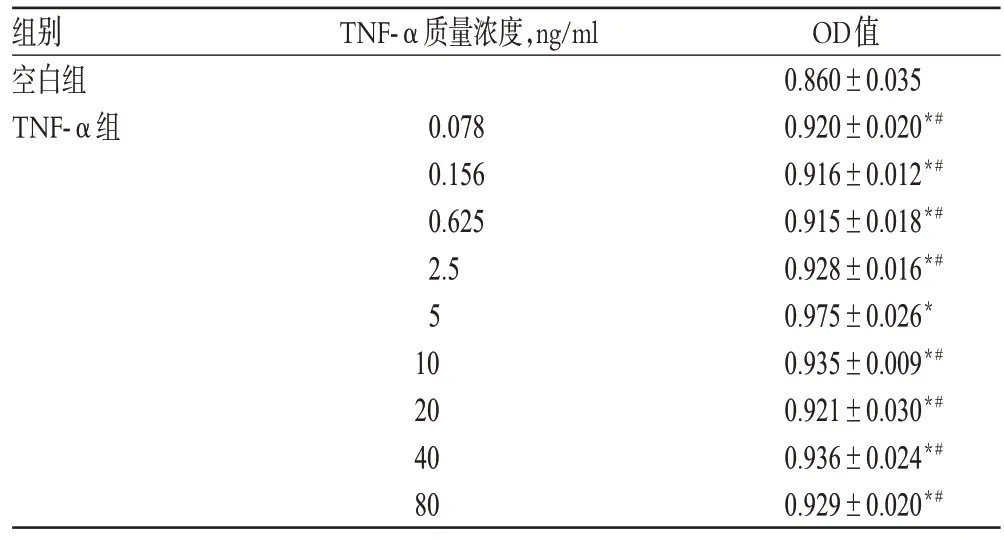
表2 不同质量浓度TNF-α对A7r5 细胞存活的影响(,n=3)Tab 2 Effects of different concentrations of TNF-α on A7r5 cell survival(,n=3)
注:与空白组比较,*P<0.01;与5 ng/ml比较,#P<0.01Note:vs.blank group,*P<0.01;vs.5 ng/ml,#P<0.01
3.3 A7r5细胞的增殖变化
与空白对照组比较,模型组A7r5细胞的OD值明显增加,差异具有统计学意义(P<0.05)。与模型组比较,10-7、10-6、10-5mg/ml吲哚-2,3-二酮组A7r5细胞的OD值明显减小,差异具有统计学意义(P<0.01 或P<0.05),其余差异无统计学意义(P>0.05)。各组细胞的增殖变化见表3。
表3 各组细胞的增殖情况(,n=3)Tab 3 The proliferation of cells in each group(,n=3)

表3 各组细胞的增殖情况(,n=3)Tab 3 The proliferation of cells in each group(,n=3)
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05,##P<0.01Note:vs.blank control group,*P<0.05;vs.model group,#P<0.05,##P<0.01
3.4 A7r5细胞周期变化
与空白对照组比较,模型组A7r5细胞S期与G2/M期明显增加,G0/G1期细胞明显减少,差异具有统计学意义(P<0.05)。与模型组比较,10-8mg/ml吲哚-2,3-二酮组A7r5细胞G2/M 期明显减少,10-7、10-6mg/ml 吲哚-2,3-二酮组S 期细胞均明显减少,差异具有统计学意义(P<0.05),其余差异无统计学意义(P>0.05)。各组细胞的细胞周期分布情况见表4。
表4 各组细胞的细胞周期分布情况(,n=3)Tab 4 Distribution of cell cycle in each group(,n=3)
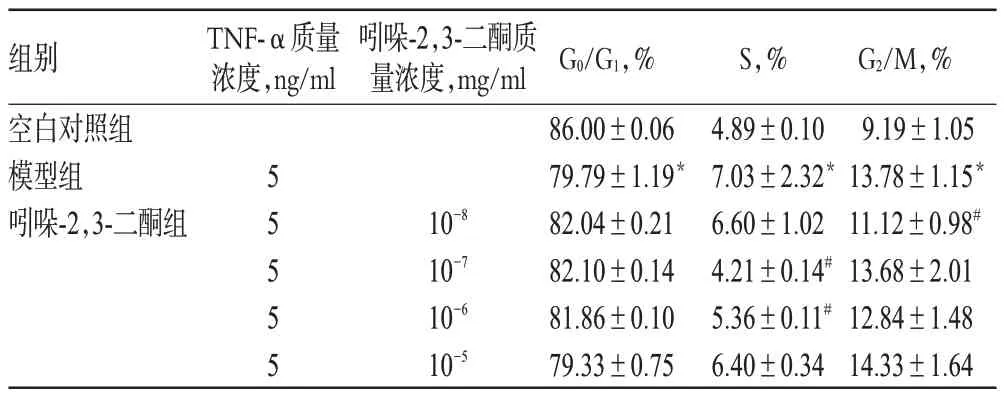
表4 各组细胞的细胞周期分布情况(,n=3)Tab 4 Distribution of cell cycle in each group(,n=3)
注:与空白对照组比较,*P<0.05;与模型组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.model group,#P<0.05
4 讨论
血管平滑肌细胞的移行和过度增殖在动脉粥样硬化发生和发展过程中起着关键的作用[6]。当血管内皮细胞损伤时,释放大量的TNF-α、IL-6 等炎性因子。在其刺激下,血管平滑肌细胞、内皮细胞和巨噬细胞可以合成并分泌大量的纤维母细胞生长因子、血小板源性生长因子等生长因子,使内膜平滑肌细胞增殖,中膜平滑肌细胞迁移至内皮下间隙,摄取脂质,逐步形成泡沫细胞,产生胶原、弹性纤维及蛋白多糖等,最终形成动脉粥样硬化。
本文用不同质量浓度的吲哚-2,3-二酮处理平滑肌A7r5细胞,观察其对A7r5细胞的增殖有无影响,从而为后续研究的试验质量浓度确定提供依据。本试验结果表明,吲哚-2,3-二酮在高质量浓度(10-5mg/ml)时,对细胞增殖无影响。结合对吲哚-2,3-二酮的其他药理作用的研究结果[4],选用10-8、10-7、10-6、10-5mg/ml这4个质量浓度作为本文中吲哚-2,3-二酮的试验质量浓度。
TNF-α是一种重要的前炎性细胞因子,出现在炎症早期,呈现出趋化、活化中性粒细胞及单核细胞,促进血管内皮细胞表达黏附分子等多种生物学活性,还能增加平滑肌细胞表达E-selectin,从而促进动脉粥样硬化斑块形成[7]。本试验采用不同质量浓度的TNF-α处理平滑肌A7r5细胞,观测其对A7r5细胞增殖的影响。结果表明,各质量浓度TNF-α均能明显促进A7r5 细胞的增殖,以TNF-α 5 ng/ml 促增殖作用最为明显,因此最终确定5 ng/ml为TNF-α造模质量浓度。结合对吲哚-2,3-二酮最大无毒浓度的探究,探讨吲哚-2,3-二酮拮抗TNF-α诱导平滑肌细胞增殖的作用。结果表明,吲哚-2,3-二酮对5 ng/ml TNF-α诱导的A7r5 细胞的增殖有明显的抑制作用,提示吲哚-2,3-二酮抗动脉粥样硬化炎性反应的作用机制与抑制平滑肌细胞的增殖有关。
据报道,调控细胞周期也是控制细胞增殖的关键环节之一[8-9]。本试验采用5 ng/ml TNF-α诱导A7r5细胞增殖,同时用不同质量浓度的吲哚-2,3-二酮进行干预,观测其对A7r5细胞周期的影响。结果表明,TNF-α可增加A7r5 细胞S 期和G2/M期的比例,即促进A7r5 细胞的增殖。经吲哚-2,3-二酮干预后,部分G2/M 期、S 期细胞比例下降,使细胞增殖周期停滞于G0/G1期,从而抑制A7r5细胞的增殖。这提示吲哚-2,3-二酮抑制A7r5细胞增殖的作用可能与阻止细胞周期有关。
本文从细胞水平初步研究表明,吲哚-2,3-二酮对TNF-α所致血管平滑肌细胞增殖和细胞周期具有抑制作用,为进一步寻找天然低毒的抗动脉粥样硬化药物提供了参考。
[1]柴惠,余军伟,马建龙,等.黄连素对肿瘤坏死因子TNFα介导的炎症作用机理研究[J].浙江中医药大学学报,2011,35(4):489.
[2]杨征,邱敏,郭晓华,等.瓜蒌皮提取物对PDGF-BB所致血管平滑肌细胞增殖周期的影响[J].中国动脉硬化杂志,2012,20(10):899.
[3]方立,李迎,祁珩.内皮祖细胞条件培养液对血管紧张素Ⅱ所致血管平滑肌细胞增殖的抑制作用[J].中国动脉硬化杂志,2013,21(11):997.
[4]黄霞,刘占涛,杨丽卿,等.吲哚-2,3-二酮的抗炎药理作用[J].齐鲁医学杂志,2008,23(3):258.
[5]刘占涛,岳旺,杨志宏,等.2,3-吲哚醌抗鹌鹑动脉粥样硬化作用及其机制研究[J].中国药房,2009,20(4):256.
[6]刘占涛,杨志宏,赵永娟,等.2,3-吲哚醌对实验性动脉粥样硬化调血脂作用的研究[J].中国药理学通报,2006,22(10):1 279.
[7]徐凤芹,徐浩,刘剑刚,等.芎芍胶囊对动脉粥样硬化兔血管平滑肌细胞增殖的影响[J].中国中西医结合杂志,2008,28(10):912.
[8]曹文疆,邢建国,王新春,等.香青兰总黄酮对TNF-α诱导的大鼠血管平滑肌细胞增殖的影响[J].中国实验方剂学杂志,2011,17(21):159.
[9]赵海梅,谭翌,杨小端.TNF-α诱导的衰老血管内皮细胞中泛素、细胞周期的变化及意义[J].山东医药,2013,53(5):25.
