HPLC法同时测定胎盘灌流液中双黄连冻干粉中8种成分的含量Δ
2015-03-09赵丽颖宋殿荣天津中医药大学研究生院天津300193天津中医药大学第二附属医院妇科天津300150
赵丽颖,宋殿荣(1.天津中医药大学研究生院,天津 300193;2.天津中医药大学第二附属医院妇科,天津 300150)
双黄连冻干粉由金银花、黄芩、连翘三味药材提取精炼而成,具有清热解毒、疏风解表之功效,是目前临床治疗呼吸道感染性疾病的首选药物之一[1],也可被用于妊娠期多种感染性疾病的治疗[2]。宋殿荣等[3-4]对双黄连冻干粉透过不同孕期妊娠大鼠胎盘屏障的药物成分进行了分析,然而,由于种属差异,动物实验结果难以直接外推到人类。2013年宋殿荣等[5]又利用胎盘组织薄片培养技术与尤斯扩散池(Ussing chamber)相结合建立了人胎盘屏障体外模型,该模型具备在体胎盘的内分泌和物质转运功能,能有效避免种属差异,模拟在体环境。而应用该技术的关键是建立胎盘灌流液中中药成分的分析方法。为此,在本研究中笔者建立了采用高效液相色谱(HPLC)法测定胎盘灌流液中双黄连冻干粉中8种成分含量的方法,为中药透过胎盘屏障药物成分研究提供分析方法学借鉴。
1 材料
1260 型HPLC 仪,包括四元泵、在线真空脱气机、自动进样器、柱温箱和二极管阵列检测器(美国Agilent 公司)等;数控系列超声处理器FS-150N(上海生析超声仪器有限公司)。
双黄连冻干粉(哈药集团中药二厂,批号:Z10960058,规格:600 mg/支);绿原酸(批号:110753)、连翘酯苷B(批号:111811)、连翘酯苷A(批号:111810)、黄芩苷(批号:110715)、连翘苷(批号:110821)、木犀草素(批号:111520)、汉黄芩苷(批号:P0641)、黄芩素(批号:111595)、葛根素(批号:110752)等对照品均购自中国食品药品检定研究院(纯度均>98%);甲醇(美国Fisher 试剂公司)、乙腈(美国Fisher 试剂公司)、甲酸(美国ROE试剂公司)均为色谱法,水为超纯水。
2 方法与结果
2.1 溶液的制备
2.1.1 混合对照品溶液 精密称取绿原酸、连翘酯苷B、连翘酯苷A、黄芩苷、连翘苷、木犀草素、汉黄芩苷、黄芩素对照品各适量,加入乙腈溶解并定容至同一10 ml棕色量瓶中,摇匀,配成混合对照品溶液,于4 ℃保存,备用。
2.1.2 内标溶液 精密称取内标物葛根素10 mg,置于10 ml量瓶中,加入乙腈稀释至刻度,得质量浓度为1 mg/ml 的标准液,于4 ℃保存,备用。临用前用乙腈稀释至质量浓度为10 μg/ml的内标溶液。
2.1.3 胎盘灌流液 精密称取NaCl 6.923 g、KCl 0.354 g、NaHCO32.1 g、Na2HPO40.136 g、MgSO4·7H2O 0.288 g、CaCl2·6H2O 0.56 g、葡萄糖(GS)1.8 g、L-丙氨酸0.178 g,混合后以800 ml 双蒸水充分溶解,调节pH 至7.4,双蒸水补足体积至1 000 ml,用Stericup过滤器滤过,于4 ℃保存,备用。
2.1.4 供试品溶液 精密称取双黄连冻干粉适量至10 ml 量瓶中,加入胎盘灌流液定容,超声(功率:80 W,频率:20 kHz)溶解,即得。
2.2 色谱条件
色谱柱:Zorbax-C18(250 mm×4.6 mm,5 μm);流动相:乙腈(A)-1%甲酸水溶液(B),梯度洗脱(洗脱程序详见表1);流速:1.0 ml/min;检测波长:280 nm;柱温:25 ℃;进样量:10 μl。

表1 梯度洗脱程序Tab 1 Gradient elution program
2.3 样品处理方法及测定
取“2.1.4”项下供试品溶液95 μl,置于1.5 ml 聚丙烯管中,加入乙腈5 μl,混匀后加入“2.1.2”项下内标溶液200 μl,涡旋30 s,以半径为3 cm、14 000 r/min 离心10 min,吸取上清液10 μl,按“2.2”项下色谱条件进样测定。
2.4 方法学考察
2.4.1 专属性考察 分别取上述胎盘灌流液、胎盘灌流液加内标溶液、胎盘灌流液加混合对照品溶液加内标溶液、胎盘灌流液加混合对照品溶液、供试品溶液各适量,按“2.2”项下色谱条件进样测定,记录色谱,详见图1。由图1可知,绿原酸、连翘酯苷B、连翘酯苷A、黄芩苷、连翘苷、木犀草素、汉黄芩苷及黄芩素的色谱峰与其左右的干扰峰分离度均大于1.5,各色谱峰的保留时间分别为7.299、10.896、11.728、30.800、18.638、19.336、22.029、22.667、28.955 min,理论板数均大于4 000。胎盘灌流液对双黄连冻干粉中8 种成分和内标溶液的测定无干扰。
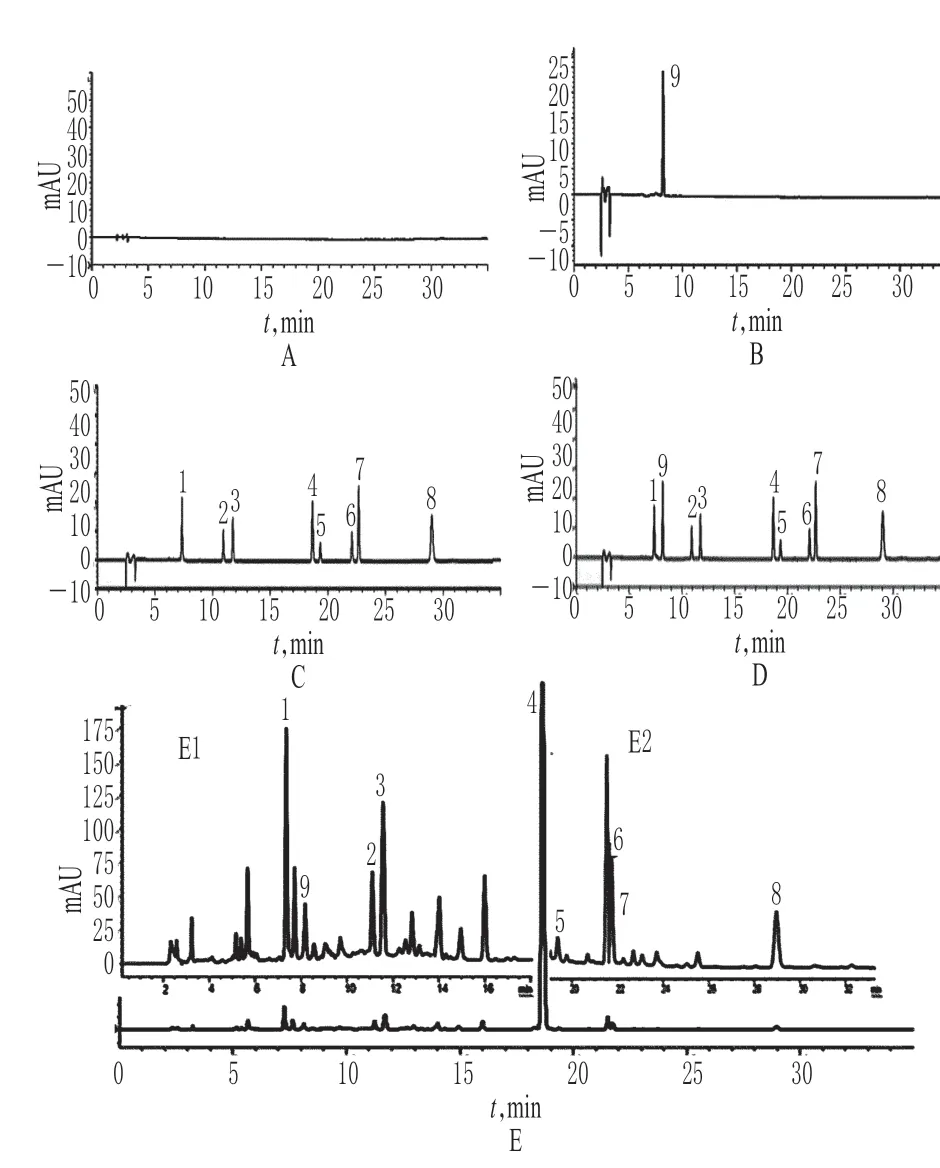
图1 高效液相色谱图A.胎盘灌流液;B.胎盘灌流液加内标溶液;C.胎盘灌流液加混合对照品溶液;D.胎盘灌流液加混合对照品溶液加内标溶液;E.供试品溶液;E1.图E在0~18 min放大图;E2.图E在19~33 min放大图;1.绿原酸;2.连翘酯苷B;3.连翘酯苷A;4.黄芩苷;5.连翘苷;6.木犀草素;7.汉黄芩苷;8.黄芩素;9.葛根素Fig 1 HPLC chromatogramsA.blank placental perfusate;B.blank placental perfusate and internal standard;C.blank placental perfusate and mixed reference substances;D.blank placental perfusate,mixed reference substances and internal standard;E.test sample;E1.the amplified chromatogram in 0-18 min;E2.the amplified chromatogram in 19-33 min;1.chlorogenic acid;2.forsythiaside B;3.forsythiaside A;4.baicalin;5.forsythia glycosides;6.luteolin;7.wogonoside;8.baicalein;9.puerarin
2.4.2 线性关系考察 取1.5 ml离心管8个,分别加入“2.1.3”项下胎盘灌流液95 μl,再分别加入“2.1.1”项下的混合对照品溶液5 μl,混匀后加入“2.1.2”项下内标溶液200 μl,使得胎盘灌流液中绿原酸、连翘酯苷B、连翘酯苷A、连翘苷质量浓度分别为2、4、6、8、10、20、30、40 μg/ml;黄芩苷、木犀草素、汉黄芩苷、黄芩素质量浓度分别为1、2、3、4、5、10、15、20 μg/ml,涡旋30 s,以半径为3 cm、14 000 r/min 离心10 min,吸取上清液10 μl,按“2.2”项下色谱条件进样测定。以质量浓度(x,μg/ml)为横坐标、各对照品和内标溶液的峰面积比值(y)为纵坐标进行线性回归,以信噪比为10计算8种成分的定量检测限(LOQ),结果见表2。
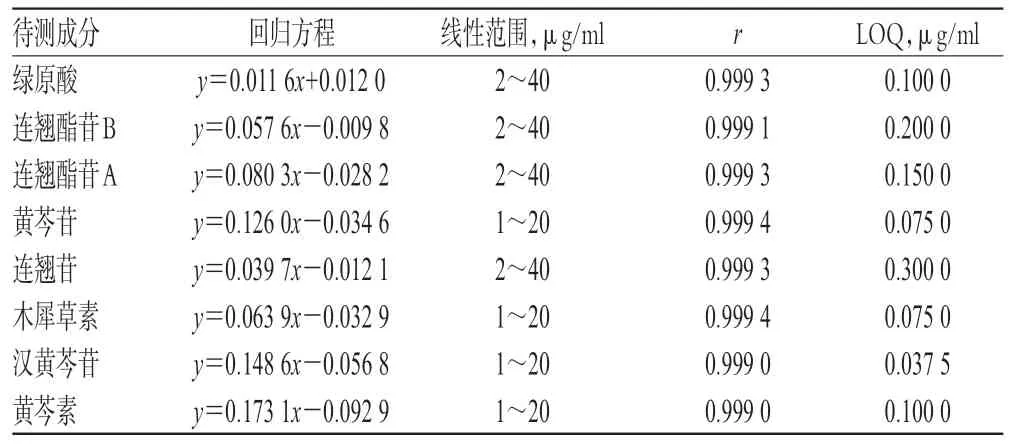
表2 线性关系试验结果Tab 2 Results of linear range
2.4.3 精密度试验 取“2.1.4”项下供试品溶液适量,按“2.2”项下色谱条件连续进样6 次,测定日内精密度;另连续测定6 d,每天进样1 次,测定日间精密度,结果见表3。由表3 可见,各成分的RSD均≤1.9,表明精密度良好。
表3 精密度试验结果(,n=6)Tab 3 Results of precision tests(,n=6)
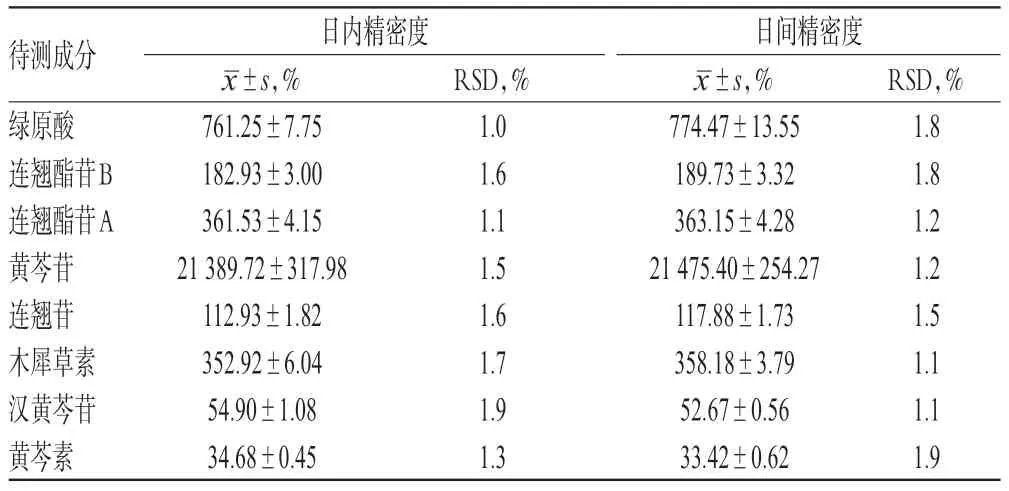
表3 精密度试验结果(,n=6)Tab 3 Results of precision tests(,n=6)
2.4.4 稳定性试验 以胎盘灌流液为基质,按“2.1.4”项下方法制备供试品溶液(批号:Z10960058),分别考察样品于室温下放置24 h、-20 ℃冷冻保存7 d 的长期稳定性和反复冻融3次的稳定性,结果见表4。由表4可见,各成分的RSD≤7.3%,表明供试品溶液稳定性较好。
表4 稳定性试验结果(,n=6)Tab 4 Results of stability tests(,n=6)

表4 稳定性试验结果(,n=6)Tab 4 Results of stability tests(,n=6)
2.4.5 重复性试验 取双黄连冻干粉(批号:Z10960058)6份,按“2.1.4”项下方法制备供试品溶液,精密吸取10 μl,按“2.2”项下色谱条件进样。结果,RSD 在1.2%~1.9%之间,表明该方法重复性较好。
2.4.6 基质效应和回收率试验 以胎盘灌流液为基质,按“2.1.4”项下方法制备供试品溶液共6 份,按“2.2”项下色谱条件进样测定,得双黄连冻干粉中各成分峰面积为A1;另取胎盘灌流液适量,加入适量“2.1.1”项下混合对照品溶液,配制成与双黄连供试品溶液浓度相同的溶液,每个浓度6份,按“2.2”项下色谱条件进样测定,得到双黄连冻干粉中各成分峰面积为A2;另取去离子水代替胎盘灌流液,加入适量“2.1.1”项下混合对照品溶液,配制成与双黄连供试品溶液浓度相同的溶液,每个浓度6份,按“2.2”项下色谱条件进样测定,得到双黄连冻干粉中各成分峰面积为A3;以A1/A2 计算回收率,A2/A3 计算基质效应,结果见表5。
3 讨论
胎盘灌流液中中药成分的测定是完成中药离体胎盘透过性研究的基础。郭洁等[6]曾建立了双黄连冻干粉HPLC指纹图谱,但未对胎盘灌流液中药物成分进行分析。本研究首次建立了测定胎盘灌流液中双黄连冻干粉中各成分的方法,可为中药透过胎盘屏障药物成分研究提供分析方法学借鉴。
为了获得较好的分离度和峰形,在色谱条件的探索中,笔者尝试在流动相中添加0.1%甲酸,提高了双黄连冻干粉中各成分和内标物的离子化效率和灵敏度;与等度洗脱相比,选择了能够使基质效应最小化,且能够使峰形最优化的梯度洗脱,最终实现了双黄连冻干粉中8 种成分和内标物的快速分析检测。

表5 基质效应和回收率试验结果(n=6)Tab 5 Results of matrix effects and recovery tests(n=6)
在样品前处理方法的优化中,本研究采用了更快捷的蛋白沉淀法。由于胎盘灌流液为特殊生物基质,其功能是在体外模拟妊娠期母体和胎儿的血液,使胎盘保持活性[7],因此其成分复杂多样,尤其是盐及蛋白含量较高,若在样品预处理过程中对多余成分去除不完全,易损伤或堵塞色谱柱。国外文献报道多将胎盘灌流液样品经不同试剂多次蛋白沉淀后,高速离心取上清液进样[8],这种方法处理过程较为复杂,且多次沉淀降低了样品浓度,增加了检测难度。本研究选用乙腈为蛋白沉淀剂对胎盘灌流液样品进行前处理,操作简便、快速、回收率高,可避免使用超滤膜或固相萃取柱带来的高成本以及液-液萃取的低效率和低提取率。
综上所述,该方法快速、灵敏,专属性强,可用于同时测定胎盘灌流液中双黄连冻干粉中8种成分的含量。
[1]顾媛媛,李殿明,石朗,等.注射用双黄连安全性问题研究近况[J].中国药房,2015,26(15):2 156.
[2]王丽伟,杨静.双黄连粉针剂在妊娠期合并症的临床应用[J].承德医学院学报,2007,24(2):157.
[3]郭洁,宋殿荣,宋红运,等.双黄连冻干粉大鼠血清药物成分的初步研究[J].天津中医药,2010,27(2):160.
[4]宋殿荣,郭洁,王跃飞,等.双黄连透过妊娠大鼠胎盘组织的药物成分研究[J].中国中药杂志,2010,35(12):1 626.
[5]Song D,Guo J,Han F,et al.Establishment of an in vitro model of the human placental barrier by placenta slice culture and ussing chamber[J].Biosci Biotechnol Biochem,2013,77(5):1 030.
[6]郭洁,宋殿荣,王跃飞,等.双黄连冻干粉HPLC 指纹图谱特征色谱峰的归属研究[J].天津中医药,2009,26(6):497.
[7]Hutson JR,Garcia-Bournissen F,Davis A,et al.The human placental perfusion model:a systematic review and development of a model to predict in vivo transfer of therapeutic drugs[J].Clin Pharmacol Ther,2011,90(1):67.
[8]Mathiesen L,Rytting E,Mose T,et al.Transport of benzo[αlpha]pyrene in the dually perfused human placenta perfusion model:effect of albumin in the perfusion medium[J].Basic Clin Pharmacol Toxicol,2009,105(3):181.
