循环肿瘤细胞在前列腺癌中的新检测方法及其临床应用的研究进展
2015-03-09窦小亮综述李颖毅审校
赵 波,窦小亮(综述),李颖毅,邵 晨※(审校)
(1.宝鸡市第一人民医院泌尿外科,陕西 宝鸡 721000; 2.第四军医大学西京医院泌尿外科,西安 710032)
循环肿瘤细胞在前列腺癌中的新检测方法及其临床应用的研究进展
赵波1,窦小亮2(综述),李颖毅1,邵晨2※(审校)
(1.宝鸡市第一人民医院泌尿外科,陕西 宝鸡 721000; 2.第四军医大学西京医院泌尿外科,西安 710032)
摘要:循环肿瘤细胞(CTCs)的检测不仅有助于肿瘤发生的早期预警,监测肿瘤的转移或复发,指导并判断肿瘤治疗效果,推断预后,而且可进一步研究肿瘤转移的机制。在肿瘤的临床治疗和转移机制的研究方面有重大的意义。目前检测血液中CTCs的传统方法有多种,但大多不能兼顾检测精确性、高效性、实用性和经济性。随着富集检测技术研究的进展,出现了一些新的检测方法,为临床肿瘤的治疗和机制研究提供了良好的平台。该文主要介绍几种新的CTCs的富集、检测和分析方法及其在前列腺癌患者中的临床应用。
关键词:前列腺癌;循环肿瘤细胞;检测;富集
循环肿瘤细胞(circulating tumor cells,CTCs)是指由肿瘤原发灶或转移灶主动或被动释放进入外周血液循环的肿瘤细胞。自1869年Ashworth[1]在1例癌症死亡患者的外周血中发现了类似肿瘤细胞后,CTCs的相关研究一步步深入。由于外周血中的CTCs数目很少,肿瘤患者的血液中每109个血细胞中才可能有1个[2],这就给CTCs的检测带来了很大的挑战,也成为了研究CTCs的技术瓶颈。但是,相关检测技术的研究一直没有止步,相继出现了密度梯度离心法、膜滤过法、上皮肿瘤细胞体积分离法[3]、核孔分析技术[4]、免疫磁珠法[5]、免疫细胞化学技术、反转录多聚酶链反应及流式细胞CTCs检测等。近年来随着对上述技术的整合和延伸,涌现出了一些更具价值的新方法,已经并将为临床肿瘤包括前列腺癌的治疗和转移机制研究带来深远的影响。现综述如下。
1CTCs的新检测方法
1.1Cellsearch系统Cellsearch系统是一种将磁性细胞分选技术、荧光抗体染色和半自动荧光显微镜分析方法结合的CTCs检测方法,具有较高的稳定性和敏感性,已被美国食品药物管理局批准用于乳腺癌、结肠癌和前列腺癌的监测。Cellsearch检测体系中的铁磁流体含上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)抗体,血样中的CTCs与细胞角蛋白(cytokeratin,CK)及4′,6-二脒基-2-苯基吲哚(4′,6-diamidino-2-phenylindole,DAPI)荧光抗体结合进行阳性分选,白细胞同抗CD45抗体结合进行阴性分选。 通过与EpCAM、CK及DAPI作检测标记的抗体/铁液复合物特异性接合,利用磁场随后把CTCs“牵引”出血样,再用生物分子和化学试剂染色后,就能明确鉴定CTCs。Cellsearch系统检测CTCs的效果已经过多项试验验证:Aliard等[6]选取了964例包括前列腺癌、乳腺癌、肺癌、卵巢癌及其他转移性恶性肿瘤患者和199例非恶性肿瘤患者以及145例健康体检者,应用Cellsearch系统检测7.5 mL外周血中的CTCs数目,结果发现CTCs广泛存在于恶性肿瘤患者中,但在非恶性肿瘤患者和健康人群中几乎检测不到CTCs。Hiraiwa等[7]在消化系统肿瘤患者中证实转移性肿瘤患者的CTCs计数显著高于无转移组和健康对照组。与现有的标准治疗相比较,Cellsearch系统可以在传统影像学之前运用,而且不像其他血清肿瘤标志物那样经常出现变异。并且多中心的前瞻性研究验证了系统的特异性、灵敏度和可重复性,确保了Cellsearch在科研和临床上的应用前景(表1)。
1.2CTCs芯片CTCs芯片是一种微流体学的CTCs检测技术。它是在一张硅片上面覆盖了78 000个显微位点,每个位点上包被有捕获CTCs的EpCAM抗体,同时,微米柱可防止EpCAM与白细胞的错误结合。当外周血标本以0.12 mL/h的速度通过芯片时,EpCAM阳性CTCs就可结合于包被有EpCAM微米柱上,最后通过显微镜便可观察捕获CTCs的形态、活力及肿瘤标志。此检测系统的阳性筛选标志物为CK和DAPI,阴性筛选标志物为CD45[8]。HB芯片是CTCs芯片的升级版,在增加血样检测量的同时,提高了捕获少见CTCs的能力,它不仅能利用病理检测方法对癌细胞进行鉴别,而且可对捕获的CTCs进行培育。最重要的是,可以将捕获的CTCs分离为若干个CTCs亚群,这些细胞亚群将有助于深入研究肿瘤的转移过程。通过对癌症患者血样品进行检测证实,HB芯片在CTCs芯片的基础上提高了25%的癌细胞捕获率,可捕捉血样中超过90%的癌细胞[9]。缺点在于这种设计制造相对复杂,成本昂贵,尚未获批用于临床(表1)。
1.3微流控成像细胞计数微流控成像细胞计数技术是由美国加州大学洛杉矶分校纳米研究中心的研究人员研发出一种新型的纳米硅片[10]。硅片的表面有三维纳米级的微丝,微丝的表面包被EpCAM抗体。这种纳米硅片除运用抗原-抗体免疫结合外,还充分利用三维纳米结构独一无二的表面与血液中CTCs表面的纳米级微丝相互作用,提高捕获效率,使用这种纳米级硅片,可在2 h内完成Cellsearch系统3~4 h内才完成CTCs的检测任务。硅片经过培养并进行CK和DAPI阳性筛选,CD45阴性筛选的免疫荧光染色后,通过自动荧光显微镜来识别并计算CTCs[10]。而且装在载玻片上的简单装置可允许在同一时间内进行多个CTCs检测。并且,联合激光显微切割或释放技术进行单细胞的实验分析。到目前为止,美国加州大学洛杉矶分校研发的新型“捕蝇纸”样CTCs检测方法比其他方法更快、更低廉、效率更高[10],但目前细胞分离培养技术尚不完善(表1)。
1.4多色活体流式细胞仪技术多色活体流式细胞仪是一种在体、实时、定量的生物光学检测技术。这种检测方法通过向静脉内注射肿瘤特异性荧光配体,然后对手腕或者面颊部等表浅血管进行多光子荧光影像检查,多色活体流式细胞仪上的激光每秒钟可将血管扫描1000次,这样就可以检测经过血管的每个细胞。CTCs结合荧光后,无需抽血就可以检测到流经外周血中的CTCs[11]。现已研发出两种可以注射的标记试剂,与不同的肿瘤细胞结合。Folate轭合物可以标记卵巢癌、肾癌、非小细胞肺癌、子宫内膜癌,已经进行了人体检测,没有不良反应,可以每周使用。而DUPA轭合物主要针对前列腺癌。这项新技术侵袭性小,可以比抽血分析检测到更大的血样。因此,多色活体流式细胞仪为研究者提供了一个更加灵敏、更便捷的肿瘤细胞检测方法。虽然已有一系列的研究证实了该技术的有效性,但是染料的安全性问题有待进一步的研究(表1)。
1.5酶联免疫斑点法酶联免疫斑点法以酶联免疫吸附为基础,通过对CD45阳性细胞的免疫磁性清除和对基质细胞趋化因子受体4阳性细胞富集来完成对CTCs的检测[12]。酶联免疫斑点法以前列腺特异性抗原(prostate specific antigen,PSA)和CK19为标志物检测前列腺癌CTCs,表现出较高的特异性和敏感性。通过显色反应,在细胞分泌这种可溶性蛋白的相应位置上显现清晰可辨的斑点,可直接在显微镜下人工计数斑点或通过酶联免疫斑点分析系统对斑点进行计数,1个斑点代表1个活性CTCs,从而根据斑点计算出分泌该蛋白或者细胞因子的细胞的频率[13](表1)。
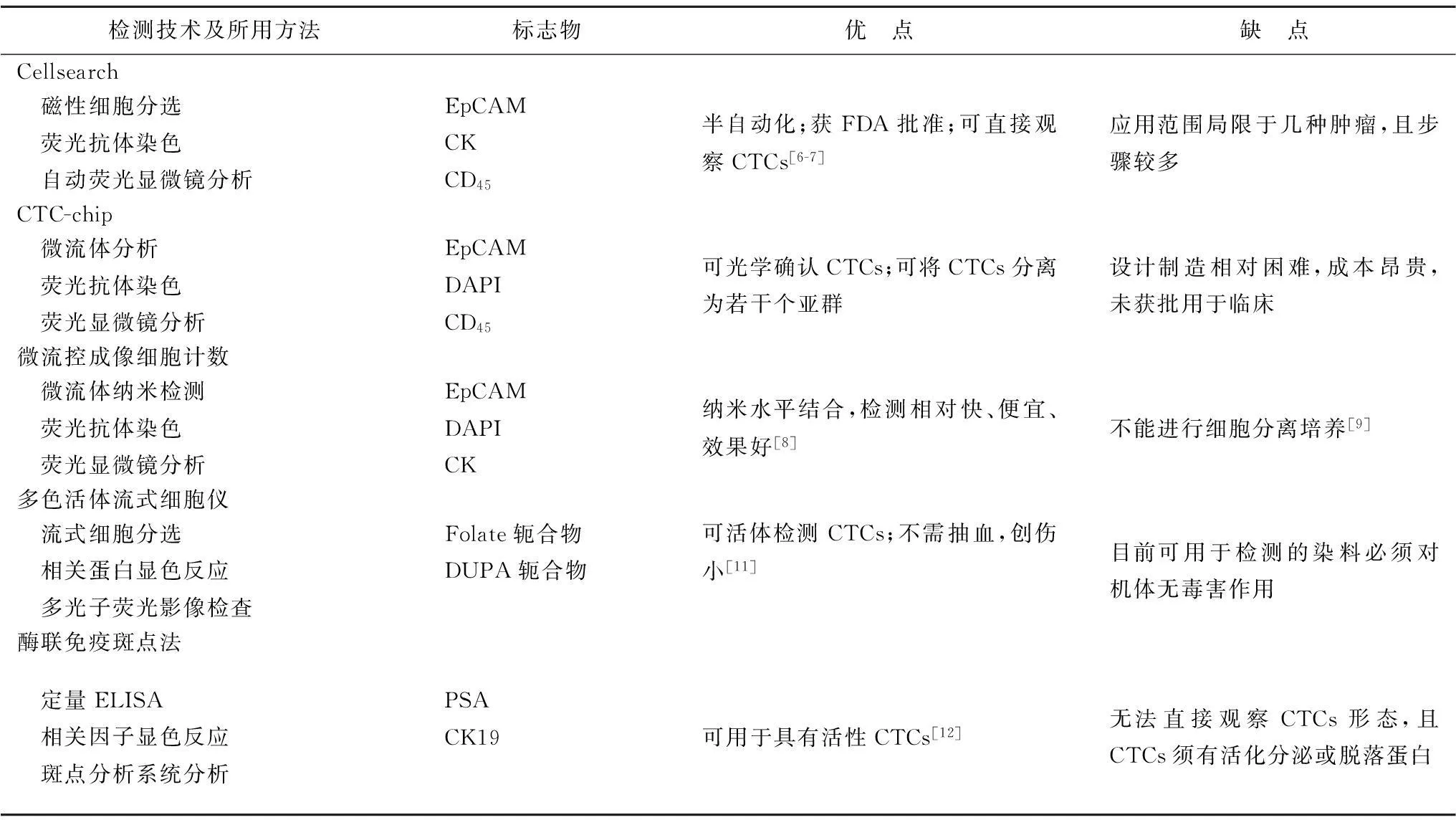
表1 最新前列腺癌CTC检测技术的比较
EpCAM:上皮细胞黏附分子; CK:细胞角蛋白; DAPI: 4′,6-二脒基-2-苯基吲哚; PSA:前列腺特异性抗原; ELISA:酶联免疫吸附测定; CTCS:循环肿瘤细胞
2CTCs在临床前列腺癌患者中的应用
肿瘤细胞通过上皮基质转化从原发灶脱离后进入淋巴或血液后成为CTCs[14]。虽然大多数CTCs经过循环的剪切力作用,免疫监视和其他监管机制而死于血液中,但仍有一些细胞能克服代谢困难、成功增殖,并逃避机体免疫系统,形成转移灶。尽管1000个CTCs中仅有1个能形成转移灶[15],但发现CTCs并不能证明肿瘤转移灶已经形成,但却为肿瘤的转移提供一种早期的检测手段。其价值已经在转移性前列腺癌[16]、转移性乳腺癌[17]、转移性结肠癌[18]等多种肿瘤中证实。前列腺癌是泌尿系肿瘤中最早研究CTCs的肿瘤,也是当前研究比较成熟的肿瘤之一。
2.1CTCs酶联免疫斑点法在前列腺癌诊断和分期中的应用欧洲泌尿外科协会前列腺癌的诊断指南建议前列腺癌的诊断工具主要有直肠指诊、血清PSA水平和经直肠B超检查[19]。上述方法在早期诊断前列腺癌的转移和进展上也有其局限性,CTCs的研究有可能为这一问题提供一个解决途径。虽然外周血中检测到CTCs并不意味着已有远处转移,但是会大大增加转移的概率。如果能在转移或复发灶出现前就预测并做出早期诊断,将对临床治疗有着十分重要的意义。因此,许多研究开始关注CTCs与肿瘤复发和进展的关系。De la Taille等[20]回顾了既往以PSA为标记检测前列腺癌CTCs的16项研究,其中有三项研究表明CTCs能够预测肿瘤复发。随后,也有研究发现转移性前列腺癌患者的CTCs数量显著高于局限性前列腺癌患者,且CTCs数目与PSA水平、肿瘤体积和增大淋巴结之间存在相关性[21]。然而,一项较大样本量的试验结果表明,21%雄激素抵抗性的前列腺癌患者和20%的PSA增高,但前列腺活检没有发现肿瘤的患者检测到CTCs,其CTCs数目与肿瘤病理分级、体积、Gleason评分之间没有相关性[22]。由此可见,CTCs可以作为与前列腺癌复发诊断的一个指标,但它与肿瘤分期分级的关系尚存争议,有待进一步研究。
2.2CTCs在前列腺癌疗效评估中的应用内分泌治疗是前列腺癌主要的治疗方法之一,起初对大多数患者都有效,但治疗一段时间以后,几乎所有的患者都将发展为激素非依赖性前列腺癌或激素难治性前列腺癌,预后较差。已有研究开始关注CTCs与内分泌治疗效果关系。一项研究利用Cellsearch的研究检测了80例接受内分泌治疗的转移性前列腺癌患者外周血中的CTCs,结果发现55%的血样中检出的CTCs数目≥5个/7.5 mL,其治疗中位有效期为17个月,而CTCs<5个/7.5 mL的患者的治疗中位有效期为32个月以上,差异有统计学意义(P<0.007),表明CTCs是内分泌治疗敏感的预测因子[23]。也有研究对CTCs数目和化疗效果作了进一步的研究,结果发现CTCs≥5个/7.5 mL,患者在接受两个疗程化疗之后,CTCs数目下降>30%者的总生存时间更长[24]。由此可见,可以把患者外周血中CTCs数目的下降值作为化疗效果的监测指标。另外,CTCs还可以评估手术治疗的疗效和术后复发可能性的大小。试验证实,在根治性前列腺癌切除术后,患者外周血中的CTCs可明显减少,且5年内没有复发的患者,在其骨髓中虽然可以检测到肿瘤细胞,但是这些休眠状态的细胞中具有肿瘤干细胞属性的CTCs数目很少[25]。有研究也比较了CTCs数目变化和血清PSA水平变化在激素抵抗性前列腺癌一线治疗后疗效监测方面的价值,发现治疗后4、8、12周CTCs计数变化与生存时间之间关系密切,而与PSA水平变化之间则无明显相关性,表明CTCs数目比PSA在检测治疗效果方面更有价值[16,26]。
2.3CTCs在患者预后预测中的应用目前为止,临床上主要依据肿瘤分期、肿瘤相关抗原、肿瘤细胞增生标志物、癌基因和抑癌基因等结果预测肿瘤预后,但大多缺乏准确性、简便性和个体化。因此,需要一个更可靠的判断肿瘤患者预后的个体化指标。已有多项临床研究表明,CTCs可以作为预测前列腺癌预后的一项独立指标。Olmos等[24]的一项研究观察了191例去势治疗失败的前列腺癌患者治疗前后CTCs数目与总生存时间的关系,结果表明CTCs数目与血清PSA、碱性磷酸酶等前列腺癌相关抗原以及骨转移相关。CTCs≥5个/7.5 mL患者的总生存时间为19.5个月,而CTCs<5个/7.5 mL患者的总生存时间则>30个月(P=0.012)。随后有结果显示,CTCs≥5个/7.5 mL可以作为预测转移性前列腺癌患者中位生存时间的界值[27]。另外,也有试验将判断预后的临界值定义为≥4个/7.5 mL外周血。一项研究通过对100例激素难治性前列腺癌患者进行了26个月的随访,发现CTCs≥4个/7.5 mL与总体生存期相关(P<0.001)[28]。尽管CTCs可以作为预测前列腺癌预后的一项独立预测因子,但其单一的预测价值尚待和肿瘤分期、PSA等临床基本资料结合,以期发挥更大、更为准确的预测价值。
3展望
目前,对前列腺癌CTCs的检测的单中心小样本研究已有多种,已经为前列腺癌的研究提供了重要的工具。部分研究已发现CTCs与临床分期分级和预后间的关系并确立了初步的临界值,但这些结果仍需大样本、多中心的研究证实,以期建立标准化的检测方法和精确的阈值。通过在临床治疗前进行CTCs检测,建立基数水平,在治疗过程中监测CTCs数目的变化,以更好地制订个性化治疗方案、监测治疗效果、评估预后;也可以对CTCs分选后研究其分子生物学特性,尽可能多地寻找肿瘤分子标记,建立检测分子特征谱,在提高CTCs检测的特异性的同时,为肿瘤治疗提供预后及预测肿瘤细胞分子模式;还可以通过对原发癌及不同阶段CTCs单细胞全外显子测序的比较,监测肿瘤细胞从原发瘤进入血液循环或靶器官的过程中获得或丧失某些基因的表达,以确定肿瘤进展过程中关键基因的表达模式,进而从基因水平了解前列腺癌的转移机制。
参考文献
[1]Ashworth TR.A case of cancer in which cells similar to those in the tumours were seen in the blood after death[J].Aust Med J,1869,14:146.
[2]Ross AA,Cooper BW,Lazarus HM,etal.Detection and viability of tumor cells in peripheral blood stem cell collections from breast cancer patients using immunocytochemical and clonogenic assay techniques[J]. J Blood,1993,82(9):2605-2610.
[3]Ntouroupi TG,Ashraf SQ,McGregor SB,etal.Detection of circulating tumor cells in peripheral blood with an automated scanning fluorescence microscope[J].Br J Cance,2008,99(5):789-795.
[4]Vona G,Sabile A,Louha M,etal.Isolation by size of epithelial tumor cells:a new method for the immunomorphological and molecular characterization of circulating tumor cells[J].Am J Pathol,2000,156(1):57-63.
[5]Jacob K,Sollier C,Jabado N.Circulating tumor cells: detection,molecular profiling and future prospects[J].Expert Rev Proteomics,2007,4(6):741-756.
[6]Aliard WJ,Matera J,Miller MC,etal.Tumor cells circulate in the peripheral blood of all major careinomas but not in healthy subjects or patients with nonmalignant diseases[J].Clio Cancer Res,2004,10(20):6897-6904.
[7]Hiraiwa K,Takeuchi H,Hasegawa H,etal.Clinical significance of circulating tumor cells in blood from patients with gastrointestinal cancers[J].Ann Surg Oncol,2008,5(11):3092-3100.
[8]Naume B,Borgen E,Nesland JM,etal.Detection of isolated tumor cells in peripheral blood and in BM: evaluation of a new enrichment method[J].Cytotherapy,2004, 6(3):244-252.
[9]Stott SL,Hsu CH,Toner M,etal.Isolation of circulating tumor cells using a microvortex-generating herringbone-chip[J].Proc Natl Acad Sci U S A,2010,107(43):18392-18397.
[10]Wang S,Liu K,Tseng HR,etal.Highly efficient capture of circulating tumor cells by using nanostructured silicon substrates with integrated chaotic micromixers[J].Angew Chem Int Ed Engl,2011,50(13):3084-3088.
[11]He W,Wang H,Low PS,etal.In vivo quantitation of rare circulating tumor cells by multiphoton intravital flow cytometry[J].Proc Natl Acad Sci U S A,2007,104(28):11760-11765.
[12]Muller A,Homey B,Soto H,etal.Involvement of chemokine receptors in breast cancer metastasis[J].Nature,2001,410(6824):50-56.
[13]Alix-Panabières C.EPISPOT assay:detection of viable DTCs/CTCs in solid tumor patients[J].Recent Results Cancer Res,2012,95:69-76.
[14]Gorges TM,Tinhofer I,von Ahsen O.etal.Circulating tumour cells escape from EpCAM-based detection due to epithelial to mesenchymal transition[J].BMC Cancer,2012,12(1):178.
[15]Liotta LA,Stetler-Stevenson WG.Tumor invasion and metastasis:an imbalance of positive and negative regulation[J].Cancer Res,1991,51(18 Supp1):5054-5059.
[16]de Bono JS,Scher HI,Montgomery RB,etal.Circulating tumor cells predict survival benefit from treatment in metastatic castration-resistant prostate cancer[J].Clin Cancer Res,2008,14(19):
6302-6309.
[17]Weigeh B,Bosma AJ,Hart AA,etal.Marker genes for circulating tumour cells predict survival in metastasized breast cancer patients [J].Br J Cancer,2003,88(7):1091-1094.
[18]Cohen SJ,Punt CJ,lannotti N,etal.Relationship of circulating tumor cells to tumor response,progression free survival,and overall survival in patients with metastatic eolorectal cancer[J].J Clin Oncol,2008,26(19):3213-3221.
[19]那彦群,孙光.中国泌尿外科疾病诊断治疗指南[M].北京:人民卫生出版社,2009:47-55.
[20]De la Taille A,Olsson CA,Katzt AE.Molecular staging of prostate cancer:dream or reality[J].Oncology(Williston Park),1999,13(2):187-194.
[21]Resel Folkersma L,Olivier Gómez C,San José Manso L,etal.Immunomagnetic quantification of circulating tumoral cells in patients with prostate cancer:clinical and pathological correlation[J].Arch Esp Urol,2010,63(1):23-31.
[22]Davis JW,Nakanishi H,Kumar VS,etal.Circulating tumor cells in peripheral blood samples from patients with increased serum prostate specific antigen:initial results in early prostate cancer [J].J Urol,2008,179(6):2187-2219.
[23]Okegawa T,Nutahara K,Higashihara E.Immunomagnetic quantification of circulating tumor cells as a prognostic factor of androgen deprivation respnsiveness in patients with hormone naive metastatic prostate cancer[J].J Urol,2008,180(4):1342-1347.
[24]Olmos D,Arkenau HT,Ang JE,etal.Circulating tumour cell(CTC)counts an intermediate end points in castration resistant prostate cancer(CRPC):a single centre experience[J].Ann Oncol,2009,20(1):27-33.
[25]Economos C,Morrissey C,Vessella RL.Circulating tumor cells as a marker of response:implications for determining treatment efficacy and evaluating new agents [J].Curr Opin Urol,2012,22(3):190-196.
[26]Scher HI,Jia de Bono JS,Fleisher M,etal.Circulating tumour cells as prognostic markers in progressive,castration resistant prostate cancer:a reanalysis of IMMC38 trial data[J].Lancet Oncol,2009,10(3):233-239.
[27]Shaffer DR,Leversha MA,Danila DC,etal.Circulating tumor cell analysis in patients with progressive castration-resistant prostate cancer[J].Clin Cancer Res,2007,13(7):2023-2029.
[28]Goodman OB Jr,Fink LM,Symanowski JT,etal.Circulating tumor cells in patients with castration-resistant prostate cancer baseline values and correlation with prognostic factors[J].Cancer Epidemiol Biomarkers Prev,2009,18(6):1904-1913.
New Detection Methods for Circulating Tumor Cells and Its Clinical Relevance in Prostate Cancer
ZHAOBo1,DOUXiao-liang2,LIYing-yi1,SHAOChen2.(1.DepartmentofUrology,BaojiCityFirstPeople′sHospital,Baoji721000,China; 2.DepartmentofUrology,XijingHospitaloftheFourthMilitaryMedicalUniversity,Xi′an710032,China)
Abstract:The detection of circulating tumor cells(CTCs) may contribute to early detection of cancer,monitoring the cancer metastasis and recurrence,predicting the prognosis and evaluating the therapeutic effect.In addition,it could also be used to study the mechanisms of cancer metastasis,which plays an important role in clinical treatment of tumor and the research of cancer metastasis. Although many different methods have been used for the detection of CTCs,many of them can′t have veracity,efficiency,practicality and the economy all in one.At present,some new detection methods appeared as technology progresses,which provide a great platform for clinical cancer treatment and mechanism research. Here mainly introduces the latest CTCs enrichment and detection methods and the use in prostate cancer patients.
Key words:Prostate cancer; Circulating tumor cells; Detection; Enrichment
基金项目:国家国际科技合作专项(2011DFA33110)
doi:10.3969/j.issn.1006-2084.2015.03.015
中图分类号:R737.1
文献标识码:A
文章编号:1006-2084(2015)03-0423-04
