斜带石斑鱼(Epinephelus coioides)两种神经肽NPB的发现及表达分析*
2015-03-08李伟萍宇肖李水生林浩然
李伟萍 胡 哲 李 玉 王 翔 黄 文 王 宇肖 玲 李水生 张 勇 林浩然,①
(1. 海南大学海洋学院 海口 570228;2. 中山大学水生经济动物研究所暨广东省水生经济动物良种繁育重点实验室 广州 510275)
鱼类的摄食和生长受许多神经内分泌因子的调节,如食欲素(Orexin)、促肾上腺皮质素释放因子(corticotropin releasing factor,CRF)、神经肽 Y (Neuropeptide Y,NPY)、神经肽 W (Neuropeptide W,NPW)和神经肽 B(Neuropeptide B,NPB)等(傅小锁等,1993; 肖东等,2000; 谭雪梅等,2004; 李昀等,2009; 雷治海等,2010)。在2002—2003年间,NPB作为G蛋白偶联受体GPR7 (Neuropeptide B/W receptor-1,NPBWR1)和GPR8 (Neuropeptide B/W receptor-2,NPBWR2)的内源性配体从哺乳动物的下丘脑提取物中被分离鉴定出来(Fujiiet al,2002; Shimomuraet al,2002;Brézillonet al,2003; Tanakaet al,2003)。随着研究的不断深入,NPB被认为是与调节摄食,能量平衡,睡眠,神经内分泌功能以及调节炎症性疼痛等功能相关(Ishiiet al,2003; Aikawaet al,2008; Hirashimaet al,2011; Skrzypskiet al,2012; Watanabeet al,2012)。
NPB广泛分布在整个脑组织的不同部位如海马组织、下丘脑室旁核、动眼神经副核和中脑导水管周围灰质等(Tanakaet al,2003; Jacksonet al,2006),特别是在下丘脑中,均能检测到了NPB与GPR7 mRNA的高度表达(Schulzet al,2007),此外,在哺乳动物中的一些外周组织,也检测到 NPB mRNA的表达(Brézillonet al,2003)。
在硬骨鱼类的研究中,NPB已从斑马鱼(Tanakaet al,2003)、鲑鱼(Leonget al,2010)和罗非鱼(Yanget al,2014)等鱼类中克隆得到,并发现NPB与摄食调控活动相关。由于鱼类作为脊椎动物中种类最多的一个群体,其进化的原始性、物种的多样性以及生活环境的复杂性,其摄食调控机制也复杂而多样性。斜带石斑鱼(Epinephelus coioides)是我国南方重要的经济鱼类,研究其生长与摄食调控机制具有重要的应用价值。
本文利用生物信息学分析和基因克隆技术在斜带石斑鱼中克隆得到了两种 NPB基因 cDNA序列,分析了 NPB的信号肽及成熟肽结构及其在不同组织器官中的分布表达模式,并进一步研究了其在摄食调控下的表达模式,证明了这两种 NPB均参与了斜带石斑鱼摄食调控。
1 材料与方法
1.1 样品采集
1.1.1 克隆和组织分布的样品采集 本实验所用斜带石斑鱼来自广东省大亚湾水产试验中心,均为健康的1—2龄鱼,体重为720—770g,并以25—30°C循环过滤海水饲养。取样前,先用冰块冷冻麻醉1—2 min,然后取出其不同分区的脑组织和外周组织,并放入液氮中进行速冻处理,而后转存放于–80°C超低温冰箱备用。取样时所用的所有解剖器械(如剪刀、镊子、锡箔纸等)均经过180°C 4h以上的烘烤灭菌,存放样品的1.5 mL离心管为进口离心管(不含有RNA酶)。所有的动物实验均按照中山大学动物研究伦理委员会对进行动物实验时所做的规章制度进行操作。
1.1.2 饥饿实验的样品采集 实验所用斜带石斑鱼来自广东省大亚湾水产试验中心,体重 32—60 g,体长 12—15 cm的仔鱼。将仔鱼(n=150)驯养于室内海水池中,并把短期饥饿的鱼分成 6组,驯养(每天9:00定点投喂)两周后开始进行短期(7d)饥饿实验:实验第 3天取饥饿组和对照组(投喂组)样品,并将其中3组恢复投喂; 实验第7天取饥饿组、对照组(投喂组)和饥饿复投组样品。取下的下丘脑组织于冻存管中,液氮速冻保存带回实验室,并将其转存到–80°C超低温冰箱备用。实验所用的解剖器具和玻璃器皿等均经过 180°C烘烤5h用以灭活RNA酶。
1.2 方法和处理
1.2.1 引物设计 根据已有的斜带石斑鱼转录组数据(未公开)和 GenBank上已上传的 NPB基因序列的比对分析,找出了两个与 NPB相似的基因序列,并暂命名为NPB1和NPB2。利用引物设计软件primer premier 5.0设计斜带石斑鱼NPB克隆和RT-PCR的特异性引物。具体引物序列如表1所示。

表1 PCR引物序列Tab.1 Sequences of the Primers used for PCR
1.2.2 总 RNA提取及 cDNA模版的制备 参照Trizol®reagent(由美国Invitrogen公司提供)说明书及操作步骤,将总 RNA提取出来,并通过反转录技术制备 cDNA模版以备基因克隆(polymerase chain reaction,PCR)和实时定量PCR (real time-polymerase chain reaction,RT-PCR)使用。
1.2.3 NPB基因的克隆与分析 以脑组织反转录产物为模板,利用NPB1和NPB2的简并引物(NPB-F和 NPB-R)进行聚合酶链式反应(PCR)来克隆和验证NPB1和NPB2基因。通过琼脂糖凝胶电泳后将PCR产物的目的条带进行切胶回收,用胶回收试剂盒E.Z.N.A®Plasmid Extraction Kit (Omega Bio-Tek公司,USA)进行分离纯化,并将胶回收产物进行连接和转化以及菌株培养鉴定,最后送至广州英骏公司进行测序。根据测序结果利用 DNAssist2.2和BioEdit软件将 NPB翻译成相应的氨基酸序列,通过使用Clustal W1.83 和MEGA 4.0软件将NPB的蛋白序列进行多重比对和进化树分析,并在在线预测网站SignalP 4.1 server (http://www.cbs.dtu.dk/services/SignalP/)和SMART (http://smart.embl-heidelberg.de/)对其NPB进行信号肽的预测分析等。
1.2.4 实时定量 PCR及数据分析 根据以上的实验方法,提取总RNA制备定量cDNA模版以及提取标准质粒 DNA制备标准曲线,以备 RT-PCR使用。选取β-actin作为内参基因和选用 SYBR®Green Realtime PCR Master Mix plus kit (TOYOBO公司,Japan)试剂盒进行 RT-PCR试验。使用仪器为 ABI 7900HT sequence detection system。具体反应程序为:首先95°C预变性2min; 然后 95°C变性15s,55°C退火15s,72°C延伸30s,共40个循环; 最后在84°C收集荧光。对溶解曲线分析,以确定PCR产物质量,用Excel对实验数据进行初步处理,再利用 Graphpad Prism5.0软件进一步处理和分析数据。
2 结果与分析
2.1 斜带石斑鱼NPB1和NPB2基因序列的鉴定与分析
在本研究中,作者在对斜带石斑鱼 NPB基因克隆分析的基础上,发现了两个NPB基因(分别命名为NPB1和NPB2),其开放阅读框(ORF)分别为393bp和387bp,各自编码的蛋白质序列为 130个氨基酸(aa)和128aa,如图1a所示。在NPB1和NPB2的氨基酸序列的N-末端均有一个包含了25aa的预测信号肽,而紧随其预测信号肽之后则出现了各自的包含 29aa成熟肽,以及两个由氨基酸残基(RR)构成的蛋白质水解切割位点(Arg49-Arg50和Arg55-Arg56),并且都具有一个相对较长的C-末端,如图1b所示。
如表 2所示,根据不同物种的 NPB的氨基酸序列比对表可知,斜带石斑鱼NPB1的氨基酸序列与尼罗罗非鱼和斑马宫丽鱼的同源性最高高达 92%; 其次是剑鱼、青 鳉和斑马鱼等,同源性高达 60%以上;而与哺乳类的同源性则比较低,如人类的52%,小家鼠的48%和大鼠45%。而斜带石斑鱼NPB2与鲑鱼的同源性最高,为61%; 与尼罗罗非鱼、青 鳉和斑马鱼等都在 50%以上; 与哺乳动物的相似性则在 45%左右,其中与人类的相似性为48%,较NPB1与人类的同源性(52%)略低。

表2 斜带石斑鱼NPB1和NPB2蛋白质前体氨基酸序列与其它脊椎动物的同源性百分比Tab.2 Pairwise comparison in homology for E. coioides NPB1 and NPB2 protein sequence with other species NPB protein sequences
如图2所示,根据斜带石斑鱼与某些典型的哺乳动物和鱼类的 NPB的氨基酸序列所构建的进化树系统分析表明,NPB前体蛋白斜带石斑鱼的 NPB1和NPB2基因共同聚集在硬骨鱼类的一个大分支上而与哺乳类分开。其中NPB1又与尼罗罗非鱼和斑马宫丽鱼关系较近, 与剑尾鱼和青 鳉关系次之,而与哺乳类关系较远,与鸟类关系最远; NPB2则与鲑鱼关系相近,与斑马鱼关系次之,同样与哺乳类和鸟类关系较远。
2.2 NPB在斜带石斑鱼中的组织分布表达模式
如图 3所示,通过逆转录 PCR和实时荧光定量PCR技术在斜带石斑鱼的不同器官组织中对NPB1和NPB2的mRNA的表达水平进行了空间表达模式的检测,所有的数据都表明了,NPB1和NPB2基因在脑组织中广泛表达,特别是在下丘脑中的表达极其丰富。其中而NPB1其它脑区如端脑、中脑、延脑和垂体的表达量较低,特别是嗅球和小脑的表达量在脑区中是最低的; 而NPB2则在嗅球和中脑的表达量是最低的。NPB1和NPB2在其它外周组织器官中也有少量的表达,如NPB1在性腺、鳃和肌肉中的表达量相对较高一点,而NPB2则在性腺和心脏中的表达量相对较高,其它组织如鳃、脾脏、肌肉、胃、肠和肝脏中的表达量都相对较低一些。由此可见,NPB2与NPB1在外周组织中的表达模式是有些微差异的,即 NPB2在外周组织中的表达更为广泛; 但是两者都在下丘脑中拥有更为丰富的分布表达。
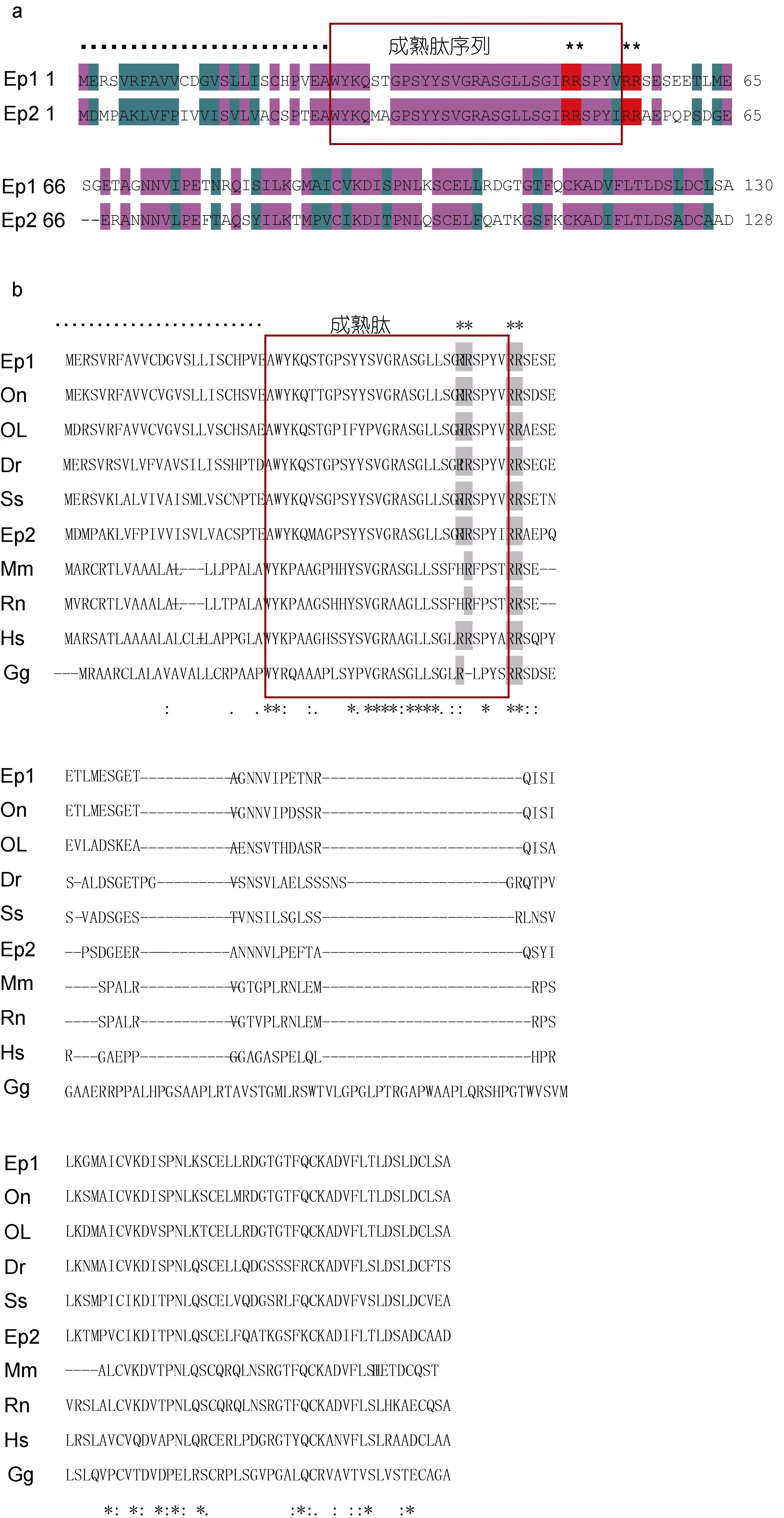
图1 a. 斜带石斑鱼NPB1和NPB2蛋白质前体氨基酸序列比对,b. 典型脊椎动物NPB蛋白质前体氨基酸序列比对Fig.1 Alignment of the deduced amino acid sequence of NPB (neuropeptide B) protein sequencesa: NPB1 and NPB2 of E. coioides,b. Alignment of E. coioides NPBs protein sequences with other species’小黑点“▪”表示预测的信号肽序列; 方框表示成熟肽序列; 上星号“*”表示由两个精氨酸RR氨基酸残基组成的蛋白质水解切割位点。下星号“*”表示一致的氨基酸; 冒号“:”表示高度保守度的氨基酸; 小圆点“.”表示低保守度的氨基酸。各物种的NPB缩写词如下: Ep1和Ep2,斜带石斑鱼(Epinephelus coioides) NPB1和NPB2; On,尼罗罗非鱼(Oreochromis niloticus,GenBank accession No. XP_003455810.1);Ol,青鳉(Oryzias latipes,No. XP_004066211.1); Dr,斑马鱼(Danio rerio,No. NP_001120841.1); Ss,鲑鱼(Salmo salar,No. ACI66524.1);Mm,小家鼠(Mus musculus,No. XP_006532795.1); Rn,大鼠(Rattus norvegicus,No. NP_695205.1); Hs,人类(Homo sapiens,No.NP_683694.1)Gg,鸡(Gallus gallus,No. XP_001231800.2)

图2 斜带石斑鱼NPB1和NPB2与其它物种的进化树分析Fig.2 Phylogenetic tree illustrating the relationship between E. coioides NPB1 and NPB2 with those of other species NPB斜带石斑鱼(Epinephelus coioides) NPB1和NPB2; 尼罗罗非鱼(Oreochromis niloticus,GenBank accession No. XP_003455810.1); 斑马宫丽鱼(Maylandia zebra,No. XP_004539074.1); 剑尾鱼(Xiphophorus maculatus,No. XP_005805134.1); 青鳉(Oryzias latipes,No.XP_004066211.1); 斑点雀鳝(Lepisosteus oculatus,No. XP_006635208.1); 矛尾鱼(Latimeria chalumnae,No. XP_005989170.1); 斑马鱼(Danio rerio,No. NP_001120841.1); 鲑鱼(Salmo salar,No. ACI66524.1); 非洲爪蟾蜍(Xenopus (Silurana) tropicalis,No. XP_002937351.1);雪貂(Mustela putorius furo,No. XP_004749308.1); 鸡(Gallus gallus,No. XP_001231800.2); 小家鼠(Mus musculus,No. XP_006532795.1);大鼠(Rattus norvegicus,No. NP_695205.1); 人类(Homo sapiens,No. NP_683694.1)
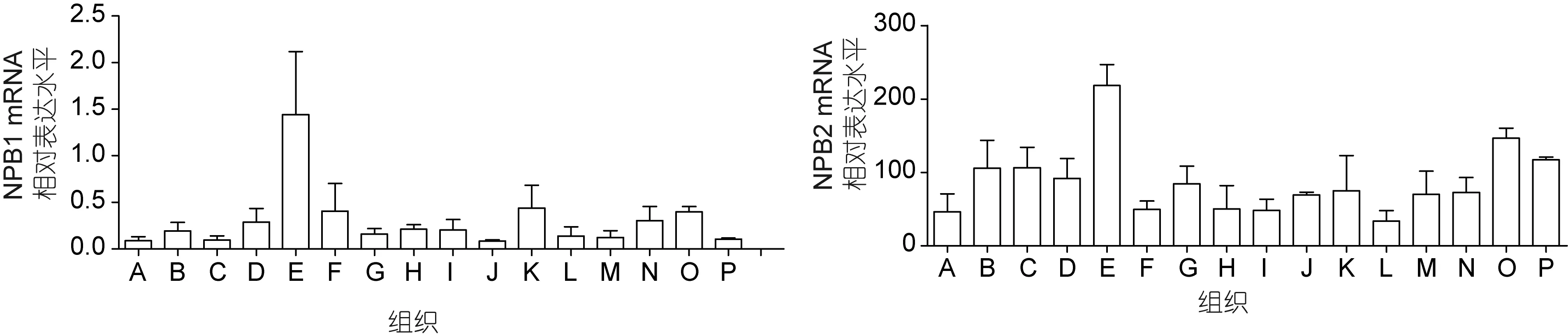
图3 斜带石斑鱼NPB1和NPB2在不同组织中的表达模式Fig.3 Tissue distribution of NPB1 and NPB2 of E. coioides所有数值用平均值±标准差(mean±SEM)来表示。各个字母所代表的组织器官如下: A. 嗅球; B. 端脑; C. 小脑; D. 垂体; E. 下丘脑; F.中脑; G. 延脑; H. 肝脏; I. 胃; J. 肠道; K. 肌肉; L. 肾脏; M. 脾脏; N. 鳃; O. 性腺; P. 心脏
2.3 饥饿试验中NPB在下丘脑表达模式
如图4所示,在饥饿试验的研究中发现,斜带石斑鱼在禁食3d和7d后,其NPB1和NPB2的mRNA相对表达量与投喂组的相比较,都显著发生了下调;复投喂后,NPB1和NPB2的mRNA表达恢复,与对照组水平相当。
3 讨论
基于 GenBank数据库和实验室研究组已有的石斑鱼转录组数据的比对分析结果,作者在斜带石斑鱼中克隆得到了两种编码神经肽 NPB的亚型基因NPB1和 NPB2,其在 N-末端的信号肽和成熟肽结构序列,与尼罗罗非鱼、斑马鱼、小鼠和人类等均在N-末端拥有的信号肽和成熟肽结构相似。除了哺乳动物,NPB在斑马鱼、非洲爪蟾和罗非鱼中也已被克隆出来(Tanakaet al,2003; Yanget al,2014),NPB是由不同的肽前体衍生的,即前体NPB (Hirashimaet al,2011),成熟的神经肽NPB则由29个氨基酸组成,并且它在 N-末端的色氨酸残基翻译后被溴化修饰(Fujiiet al,2002),这些数据表明,斜带石斑鱼NPB的蛋白质的一级结构与其它脊椎动物相一致。同源性分析表明,斜带石斑鱼NPB1和NPB2均与其它鱼类NPB的同源性相对较高,与哺乳类和鸡的同源性则相对比较低; 其中与哺乳类和鸡相比较,NPB1的同源性则比NPB2略高。而根据斜带石斑鱼与某些典型的哺乳动物和鱼类的 NPB的氨基酸序列所构建的进化树系统分析数据也证实了这一结果,NPB1和NPB2基因共同聚集在硬骨鱼类的一个大分支上而与哺乳类和鸟类分开。由此可见在,斜带石斑鱼的NPB1的氨基酸序列在结构上是比较保守的,而NPB2的保守性则比较低。此外,斜带石斑鱼NPB1和NPB2的氨基酸序列的相似性较高,达59%,并且都有两个潜在的由精氨酸残基(RR)组成的蛋白质水解切割位点(Arg49-Arg50和Arg55-Arg56),与人类和尼罗罗非鱼相似(Fujiiet al,2002; Yanget al,2014),这意味着斜带石斑鱼这两种亚型 NPB的成熟肽可能各自有两种肽蛋白质异构体NPB23和NPB29参与其生理调控功能。

图4 食物剥夺试验中斜带石斑鱼NPB1和NPB2在下丘脑的表达模式Fig.4 Expression pattern of the E. coioides NPB1 and NPB2 in food deprivation fed: 正常投喂组; unfed: 饥饿处理组; refed: 饥饿处理后复投喂组。NPB mRNA相对表达水平用平均值±标准差(mean±SEM)表示(n=10);*表示与正常投喂组差异显著(P<0.05)
组织分布的研究表明,斜带石斑鱼 NPB1和NPB2基因在脑组织中广泛表达,特别是在下丘脑中的表达极其丰富,这一结果与其它脊椎动物中的NPB表达分布情况相一致(Fujiiet al,2002; Brézillonet al,2003; Tanakaet al,2003; Yanget al,2014)。在哺乳动物中,NPB及其受体GPR7在脑组织区域广泛表达,特别是在下丘脑中表达丰富(Hocholet al,2006;Schulzet al,2007; Hondoet al,2008; Sakurai,2013),如 NPB广泛分布在整个脑组织的不同部位如海马组织、下丘脑室旁核、动眼神经副核和中脑导水管周围灰质等(Tanakaet al,2003; Jacksonet al,2006)。在大鼠中,NPB-免疫反应的阳性体细胞被发现于下丘脑内的许多区域,并且在下丘脑的这些区域也检测到GPR7 mRNA的高浓度表达,这些区域包括下丘脑腹内侧核、背内侧下丘脑核、弓状核、视前核和从腹侧到未定带(Schulzet al,2007)。而在硬骨鱼类中,也分别在斑马鱼(Tanakaet al,2003)、鲑鱼(Leonget al,2010)和尼罗罗非鱼(Yanget al,2014)等的下丘脑中检测到了 NPB的丰富表达。此外,在哺乳动物中的一些外周组织,如在人类的肾脏、子宫、卵巢、睾丸和胎盘中,在鼠科动物的胃、脊髓、睾丸、肝和肾等组织中也检测到 NPB mRNA 的表达(Brézillonet al,2003)。与此相似,在斜带石斑鱼的外周组如性腺、心脏和鳃等织器官中也检测到了 NPB mRNA的表达,特别是 NPB2在外周组织中的表达更为广泛。由于NPB1和NPB2在斜带石斑鱼中枢神经系统的广泛分布状和在各种外周组织的表达模式,暗示着这两种神经肽在斜带石斑鱼中可能与许多生理活动的调节有关。
由于下丘脑是许多复杂的生理活动的调节中枢,而就NPB和GPR7在下丘脑的分布情况推测其与摄食调控和能量消耗有关(Hondoet al,2008; Civelliet al,2008),而前人的研究也表明NPB/GPR7与摄食行为调节有关(Tanakaet al,2003; Samsonet al,2004;Johanssonet al,2008)。在本研究中,斜带石斑鱼在禁食3d和7d后,其NPB1和NPB2的mRNA相对表达量与正常投喂组相比都具有显著的下调表达变化;而复投喂后,NPB1和NPB2恢复上调表达并与正常投喂组无明显差异。这一结果表明NPB1和NPB2均参与了斜带石斑鱼的摄食调控。尼罗罗非鱼在禁食7d和14d后,NPB在下丘脑的表达没有明显的变化,而在复投喂之后出现了明显的上调表达(Yanget al,2014)。这些结果表明,在硬骨鱼类中,NPB也参与了摄食调节。
李 昀,肖云虹,张 磊,2009. 促肾上腺皮质激素释放因子及其受体的研究. 山东医药,49(48): 110—111
肖 东,林浩然,2000. 鱼类摄食和生长的神经内分泌调控途径研究进展. 中国水产科学 7(3): 102—106
傅小锁,张景艳,1993. 神经肽 Y 及其作用. 生理科学进展,24(2): 152—155
雷治海,苏 娟,贾晓庆等,2010. 神经肽W和神经肽B的研究进展. 畜牧与兽医,42(8): 94—99
谭雪梅,陈代文,羊云飞,2004. 增食欲素及其生理功能. 中国饲料,(14): 2—7
Aikawa S,Ishii M,Yanagisawa Met al,2008. Effect of neuropeptide B on feeding behavior is influenced by endogenous corticotropin-releasing factor activities.Regulatory Peptides,151(1—3): 147—152
Brézillon S,Lannoy V,Franssen J-Det al,2003. Identification of natural ligands for the orphan G protein-coupled receptors GPR7 and GPR8. Journal of Biology Chemistry,278(2):776—783
Civelli O,Zhou Q-Y,2008. Orphan G protein-coupled receptors and novel neuropeptides. Berlin Heidelberg: Springer,1—256
Fujii R,Yoshida H,Fukusumi Set al,2002. Identification of a neuropeptide modified with bromine as an endogenous ligand for GPR7. Journal of Biological Chemistry,277(37):34010—34016
Hirashima N,Tsunematsu T,Ichiki Ket al,2011. Neuropeptide B induces slow wave sleep in mice. Department of Molecular Pharmacology,University of Tsukuba,34(1): 31—37
Hochol A,Belloni A S,Rucinski Met al,2006. Expression of neuropeptides B and W and their receptors in endocrine glands of the rat. International Journal of Molecular Medicine,18(6): 1101—1106
Hondo M,Ishii M,Sakurai T,2008. The Npb/NPW neuropeptide system and its role in regulating energy homeostasis,pain,and emotion. Results and Problems in Cell Differentiation,46: 239—256
Ishii M,Fei H,Friedman J M,2003. Targeted disruption of GPR7,the endogenous receptor for neuropeptides B and W,leads to metabolic defects and adult-onset obesity. Proceedings of the National Academy of Science,100(18): 10540—10545
Jackson V R,Lin S H,Wang Z Wet al,2006. A study of the rat neuropeptide B/neuropeptide W system using in situ techniques. Journal of Comparative Neurology,497(3):367—383
Johansson A,Fredriksson R,Winnergren Set al,2008. The relative impact of chronic food restriction and acute food deprivation on plasma hormone levels and hypothalamic neuropeptide expression. Peptides,29(9): 1588—1595
Leong J S,Jantzen S G,Von Schalburg K Ret al,2010.Salmo salarandesox luciusfull-length cDNA sequences reveal changes in evolutionary pressures on a post-tetraploidization genome. Victoria,British Columbia: Biology,Centre for Biomedical Research,University of Victoria,279
Sakurai T,2013. NPBWR1 and NPBWR2: Implications in energy homeostasis,pain,and emotion. Front Endocrinol(Lausanne),4: 23
Samson W K,Baker J R,Samson C Ket al,2004. Central neuropeptide B administration activates stress hormone secretion and stimulates feeding in male rats. Journal of Neuroendocrinology,16(10): 842—849
Schulz S,Stumm R,Höllt V,2007. Immunofluorescent identification of neuropeptide B-containing nerve fibers and terminals in the rat hypothalamus. Neuroscience Letters,411(1): 67—71
Shimomura Y,Harada M,Goto Met al,2002. Identification of neuropeptide W as the endogenous ligand for orphan G-protein-coupled receptors GPR7 and GPR8. The Journal of Biological Chemietry,277(39): 35826—35832
Skrzypski M,Pruszyńska-Oszmalek E,Ruciński Met al,2012.Neuropeptide B and W regulate leptin and resistin secretion,and stimulate lipolysis in isolated rat adipocytes. Regulatory Peptides,176(1—3): 51—56
Tanaka H,Yoshida T,Miyamoto Net al,2003. Characterization of a family of endogenous neuropeptide ligands for the G protein-coupled receptors GPR7 and GPR8. Proceedings of the National Academy Sciences,100(10),6251—6256
Watanabe N,Wada M,Irukayama-Tomobe Yet al,2012. A single nucleotide polymorphism of the neuropeptide B/W receptor-1 gene influences the evaluation of facial expressions. PLoS One,7(4): e35390
Yang L,Sun C Y,Li W S,2014. Neuropeptide B in nile tilapiaOreochromis niloticus: Molecular cloning and its effects on the regulation of food intake and mRNA expression of growth hormone and prolactin. General and Comparative Endocrinology,200(1): 27—34
