P2X2阳性感觉神经末梢在小鼠食管的分布
2015-03-07庞传武安淑红王昭金
庞传武安淑红王昭金*
1.泰山医学院解剖学教研室,山东泰安2710002.泰山护理职业学院,山东泰安271000
P2X2阳性感觉神经末梢在小鼠食管的分布
庞传武1,2,安淑红1,王昭金1*
1.泰山医学院解剖学教研室,山东泰安271000
2.泰山护理职业学院,山东泰安271000
摘要:本文采用免疫荧光组织化学双标方法结合激光共聚焦显微镜技术研究了伤害性受体P2X2阳性感觉纤维末梢在小鼠食管内的分布及与降钙素基因相关肽(CGRP)阳性纤维的关系。结果表明:在食管各水平均可见到P2X2阳性感觉纤维末梢。P2X2阳性纤维集中分布于食管的内、外肌层之间,部分或全部的覆盖在肌间神经节的表面。一些串珠样的纤维深入到肌间神经节内,相互缠绕在一起形成许多结构复杂、形状各异的神经节内板状末稍(IGLEs)。荧光双标显示许多CGRP阳性纤维围绕在P2X2阳性IGLEs周围,没有见到P2X2和CGRP在同一纤维的共存。结状神经节内可见许多中小型神经元表达P2X2,P2X2/CGRP双标神经元稀少,而背根神经节内可见较多的P2X2阳性细胞含有CGRP。由此可见,小鼠食管内部分感觉神经末梢表达伤害性受体P2X2,并形成IGLEs样末梢结构。
关键词:P2X2受体;神经节内板状末梢;降钙素基因相关肽;食管;小鼠
ATP (Adenosine triphosphate,三磷酸腺苷)作为一个快速突触传递的神经递质,其作用可能参与机体感觉及其他多种不同生理功能的传递。ATP受体(Purinergic receptors,嘌呤能受体)P2X,为ATP门控的离子通道受体家族。到目前为止,已经克隆出7种不同的P2X受体亚型,每种亚型都具有独特的药理学特性和组织学分布特征[1]。免疫组织化学和原位杂交方法显示P2X2受体特异地分布于感觉神经元胞体及其周围突[2,3],其功能可能与伤害性刺激的传导有关[4,5]。研究发现,消化管内有来自迷走神经和脊神经的感觉纤维分布。其中脊神经传入纤维多为游离感觉纤维,而迷走传入纤维形成神经节内板状末稍(Introganglionic laminar endings,IGLEs)结构[6]。IGLEs是位于消化管内包绕肌间神经节(Myenteric ganglion)周围的精细神经末梢结构,这一结构是整个食管肌层内唯一的迷走感觉神经纤维,也代表了整个消化管内主要的迷走神经传入结构,具有机械感受器的作用并对ATP起反应[7]。本研究应用免疫荧光组织化学双标方法研究了P2X2受体阳性感觉末梢在小鼠食管的分布和结构特点,以及与作为脊神经传入纤维标志的降钙素基因相关肽(Calcitonin gene-related peptide,CGRP)阳性纤维[8]的关系。此外,还观察了P2X2受体和CGRP阳性神经元在结状神经节和背根神经节的分布。
1 材料与方法
1.1材料
雄性C57BL/6小鼠12只,0.4%戊巴比妥钠腹腔内注射麻醉,经升主动脉灌注固定。先用生理盐水冲洗,再用Zamboni’s固定液(2%多聚甲醛和0.2%苦味酸,0.1 mol/L PB, pH7.4)灌流固定1 h,分离食管、结状神经节和颈、胸部背根神经节,放入同一固定液中后固定4 h。然后浸入20%的蔗糖缓冲液(0.1 mol/L PB, pH7.4)中直至组织块下沉。恒冷箱切片机切片,厚12 μm,裱贴于预先涂有多聚赖氨酸的玻片上,室温下干燥1 h。
1.2免疫组织化学技术
切片用0.05 mol/L TBS(tris buffered saline,pH7.4)冲洗3次,每次10 min。再用1%牛血清白蛋白(Bovine serum albumin,BSA)、0.5%Triton X-100和10%正常驴血清室温下孵育1 h。切片用豚鼠抗P2X2受体多克隆抗体(1:500,Chemicon)及1%BSA混合液孵育,室温过夜。为了显示P2X2受体与CGRP的关系,同一切片中应用了P2X2/CGRP免疫组织化学双标法。在湿盒内切片分别用豚鼠抗P2X2受体多克隆抗体和羊抗CGRP多克隆抗体(1:500,Abcam)及1%BSA混合液孵育,室温过夜。切片用与第一抗体相匹配的结合了荧光素的二抗孵育1 h;双标切片用结合了荧光素的二抗混合液(1:1)湿盒内孵育,其中驴抗豚鼠IgG结合Cy3(1:400,Jackson),驴抗羊IgG结合DTAF(1:50,Jackson)。切片用TBS(pH8.6)与甘油混合液(1:1)封片。
多通道激光扫描共聚焦显微镜(BIO-RAD MRC2100)观察。图像处理应用Adobe Photoshop (7.0) 和Corel Draw (10.0)。
对照实验:省去第一抗体或用P2X2多肽(100 μg/mL)吸收,其它过程与上述免疫组织化学程序相同。结果均为阴性。
2 结果
2.1P2X2阳性感觉纤维在食管的分布
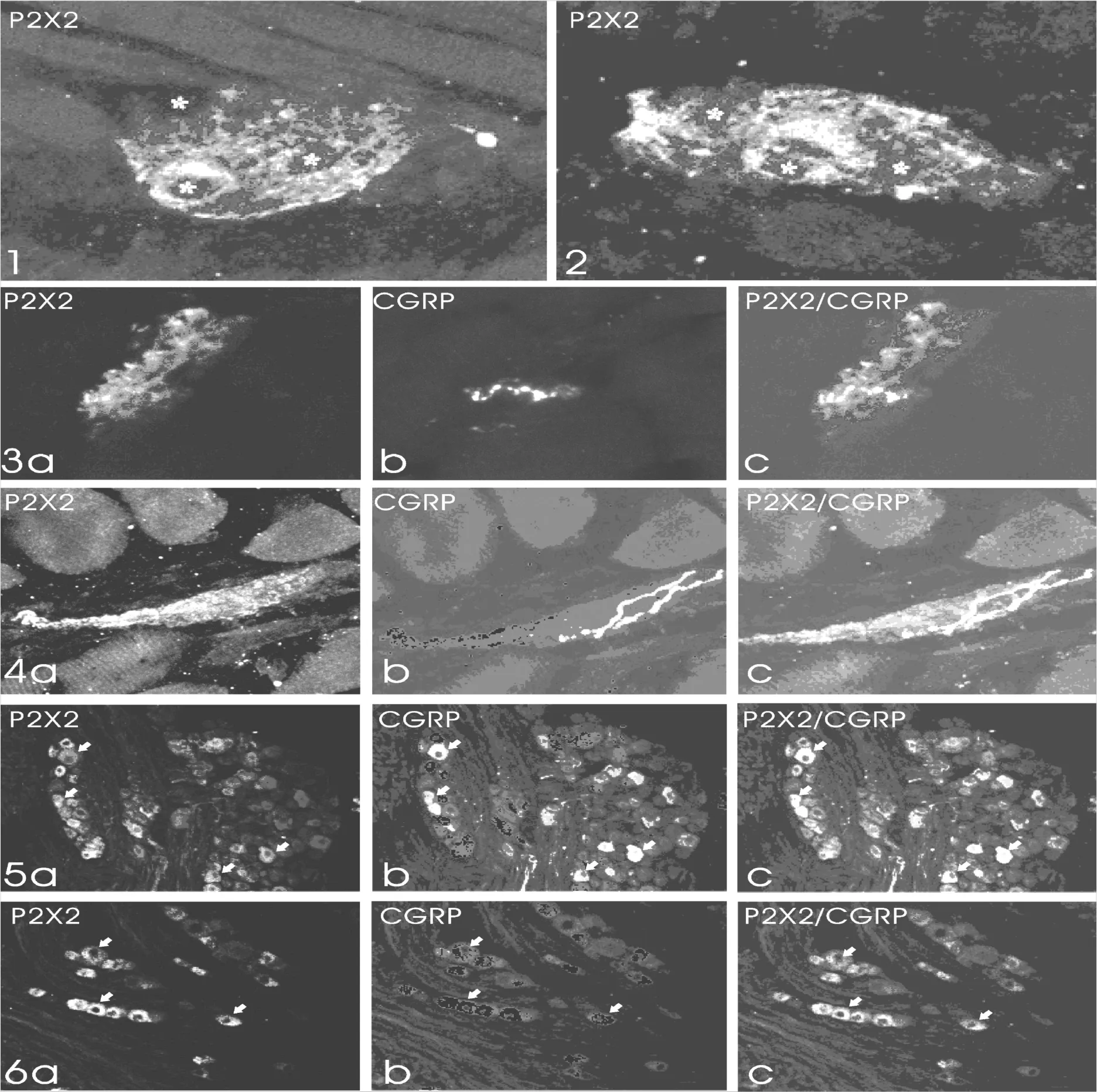
在食管颈部、胸部和腹部各个水平的切片均可观察到P2X2阳性神经纤维末梢。这些P2X2阳性纤维集中分布在食管肌层的内、外两层之间,肌间神经节所在区域,全部或部分的包绕在肌间神经节周围(图1,2)。一些P2X2阳性纤维伸入到肌间神经节内,许多带有树突棘样结构的分支或串珠样纤维分支相互缠绕在一起形成许多结构复杂、形态各异的板层状末梢结构(图3a),即所谓的神经节内板状末梢(IGLEs)。可见P2X2阳性IGLEs所形成的不规则板层末梢结构包绕在肌间神经元胞体的周围(图1,2,3a)。肌间神经节内未观察到P2X2阳性的神经元胞体。食管的粘膜层和粘膜下层未见到P2X2阳性的神经纤维和末梢。
2.2CGRP阳性纤维在食管的分布及与P2X2阳性纤维的关系
小鼠食管内有大量弥散分布的CGRP阳性纤维。在黏膜层、黏膜下层和肌层均可见许多游离分布的串珠样CGRP阳性纤维,可见到一些纤维分支伸入到肌间神经节内,或围绕在肌间神经节的周围。免疫荧光双标显示,食管内P2X2与CGRP分别代表两种分布和结构特点完全不同的神经纤维,CGRP阳性纤维为游离分布,而P2X2阳性纤维形成IGLEs。可见许多串珠样CGRP阳性纤维伸入到肌间神经节内与P2X2阳性IGLEs形成密切接触(图3a-c),或与P2X2阳性末梢缠绕在一起,或包绕在P2X2阳性IGLEs的周围(图4a-c)。没有观察到P2X2和CGRP在同一纤维或末梢的共存。
2.3P2X2在背根神经节和结状神经节的表达及与CGRP共存
背根神经节内存在大量P2X2阳性神经元胞体和弥散神经纤维。P2X2阳性神经元胞体多为中、小型神经元,其形态为圆形、卵圆形(图5a)。CGRP在背根神经节内的标记与P2X2类似,许多中、小型神经元胞体和神经纤维表现为CGRP阳性(图5b)。免疫荧光双标显示,背根神经节内许多中、小型CGRP阳性神经元表达P2X2(图5c)。
P2X2在结状神经节的标记与背根神经节类似,可见许多中、小型神经元胞体和弥散神经纤维呈P2X2阳性(图6a)。CGRP在结状神经节内的标记与背根神经节不同,结状神经节内CGRP阳性神经元胞体非常稀少(图6b),可见少量CGRP阳性神经纤维。P2X2与CGRP荧光双标结果与背根神经节结果也明显不同,没有见到P2X2/CGRP双标神经元胞体(图6c)。
3 讨论
本文结果证明了在小鼠食管肌间神经节内有丰富的P2X2阳性感觉末梢,并形成IGLEs样结构。食管内的感觉纤维有两类,一部分为来自结状神经节的迷走神经感觉纤维,另一部分为来自背根神经节的脊神经感觉纤维。消化管内IGLEs已经被实验性迷走神经切断术和迷走结状神经节顺行性追踪方法证实为迷走神经传入纤维[6]。顺行标记结合免疫细胞化学等方法发现豚鼠食管内顺行标记的IGLEs是迷走传入纤维,而食管内CGRP阳性纤维则是脊神经来源的感觉纤维,二者始终是分离的[8],因而CGRP被认为是脊神经传入纤维的标志。本文结果显示食管内P2X2阳性纤维未见与CGRP共存,根据结状神经节内P2X2阳性神经元较多,CGRP阳性细胞和P2X2/CGRP双标细胞稀少,脊神经节内CGRP阳性神经元较多,部分与P2X2共存的特点,也说明食管内CGRP阳性纤维来源于脊髓,而P2X2阳性的纤维末梢可能来源于迷走神经。根据以往研究结合本文结果,我们推测食管内P2X2阳性纤维可能是迷走神经来源的感觉纤维。食管内许多CGRP阳性纤维与P2X2阳性的IGLEs相互缠绕在一起,提示来自脊神经和迷走神经的感觉纤维在食管内可能存在着相互影响。
顺性追踪技术结合细胞内电位记录技术证实IGLEs与食管内张力感受器在形态学上密切相关,具有机械感受器的作用[7],这一发现和许多以形态学为背景的研究结果一致,也符合IGLEs化学特征[6]。有证据显示,食管和胃内迷走感觉神经末梢IGLEs可被ATP兴奋[7],说明IGLEs存在ATP受体,也表明ATP是食管内机械感受器的激动剂,与本文的结果一致。此外,在许多内脏器官,如小支气管、膀胱壁等部位,也发现感觉神经末梢有P2X2表达且参与机械和化学感受器兴奋诱发的痛觉信号的传到[9,10]。研究发现,气管和肺内的迷走感觉纤维也形成复杂的末梢结构且表达P2X2[11],与本文的结果类似。综合以往的研究和本文结果,说明小鼠食管内有丰富的P2X2受体阳性IGLEs,这种IGLEs可能是一种对ATP敏感、具有机械感受器作用的迷走感觉神经末稍,ATP可能作用于P2X2参与食管内机械和化学刺激诱发的伤害性刺激的调节。
参考文献
[1] North RA. Molecular physiology of P2X receptors [J]. Physiol Rev, 2002, 82(4):1013-1067
[2] Chen Y, Zhang L, Yang J, et al. LPS-induced dental pulp inflammation increases expression of ionotropic purinergic receptors in rat trigeminal ganglion[J]. Neuroreport, 2014;25(13):991-997
[3] Brederson JD, Jarvis MF. Homomeric and heteromeric P2X3 receptors in peripheral sensory neurons [J]. Curr Opin Investig Drugs, 2008,9(7):716-725
[4] Shieh KR, Yang SC, Tseng HL, et al. Evidence for up-regulation of purinergic receptor genes associating with TRPV1 receptors and neurotrophic factors in the inflamed human esophagus[J]. Curr Mol Med, 2014;14(9):1205-1214
[5] Chen X, Gebhart GF. Differential purinergic signaling in bladder sensory neurons of naive and bladder-inflamed mice [J]. Pain, 2010,148(3):462-472
[6] Neuhuber WL, Raab M, Berthoud HR, et al. Innervation of the mammalian esophagus [J]. Adv Anat Embryol Cell Biol, 2006,185(1):1-73
[7] Zagorodnyuk VP, Brookes SJ, Spencer NJ. Structure-function relationship of sensory endings in the gut and bladder [J]. Auton Neurosci, 2010, 153(1-2):3-11
[8] Hummel T, Barz S, Holscher T. Differences in responses to nociceptive stimulation of the oral and aboral esophagus [J]. J Clini Neurosci, 2003,10(2):223–225
[9] Nassenstein C, Taylor-Clark TE, Myers AC, et al. Phenotypic distinctions between neural crest and placodal derived vagal C-fibres in mouse lungs [J]. Physiol, 2010, 588(Pt 23):4769-4783
[10] Chen X, Gebhart GF. Differential purinergic signaling in bladder sensory neurons of naïve and bladder-inflamed mice [J]. Pain, 2010,148(3):462-472
[11] Oztay F, Brouns I, Pintelon I, et al. Neurotrophin-4 dependency of intraepithelial vagal sensory nerve terminals that selectively contact pulmonary NEBs in mice [J]. Histol Histopathol, 2010,25(8):975-984
图板说明
The Distribution of P2X2Immunoreactive Afferent Nerve Endings in the Mouse Esophagus
PANG Chuan-wu1,2,AN Shu-hong1, WANG Zhao-jin1*
1. Department of Anatomy, Taishan Medical University, Tai’an 271000, China
2. Taishan Vocational College of Nursing, Tai’an 271000, China
Abstract:The distribution of P2X2immunoreactive afferent endings and the relationship with calcitonin gene-related peptide (CGRP) immunoreactive fibers in the mouse esophagus was studied using double immunofluorescence method combined confocal laser scanning microscope technique. P2X2immunoreactive endings were seen in sections from all levels of the mouse esophagus. The distribution of P2X2immunoreactive structures concentrated in the area between outer and inner muscular layers, covered myenteric ganglia totally or partly. The dense clusters of fine varicose P2X2immunoreactive terminals protruded into myenteric ganglia forming complexes of profuse laminar structures for intraganglionic laminar endings (IGLEs). Double immunofluorescence for P2X2and CGRP revealed that numerous varicose fibers immunoreactive for CGRP closely surrounded P2X2immunopositive IGLEs. However, P2X2immunoreactive terminals never expressed CGRP immunoreactivity. In nodose ganglion, numerous neuronal cell bodies in small- and middle-sized displayed P2X2immunoreactivity. P2X2/CGRP double-labeling neurons were rare. However, many P2X2positive neurons in dorsal root ganglion contained CGRP immunoreactivity. These results demonstrated that some afferent endings in mouse esophagus expressed nociceptor P2X2, and formed IGLEs structures.
Keywords:P2X2receptor; intraganglionic laminar endings; calcitonin gene-related peptide; esophagus; mouse
*通讯作者:Author for correspondence. E-mail:zjwang@tsmc.edu.cn
作者简介:庞传武(1957-),男,副教授,主要从事人体解剖学和组织胚胎学教学与研究. E-mail:tawxpcw@126.com
基金项目:国家自然科学基金资助项目(81371234);山东省自然科学基金资助项目(ZR2013HM032);山东省医药卫生科技发展计划项目(2011HW080)
收稿日期:2014-10-11修回日期: 2014-11-30
中图法分类号:R3
文献标识码:A
文章编号:1000-2324(2015)04-0540-04
