5种藏医药用翠雀属植物的ITS2分子鉴别研究
2015-03-02李永波幕泽迳赵纪峰周华蓉钟国跃
李永波,吴 波,2,幕泽迳,2,赵纪峰,刘 翔,周华蓉,钟国跃,2*
(1.江西中医药大学中药资源与民族药研究中心,江西南昌330004;2.江西民族传统药现代科技与产业发展协同创新中心,江西南昌330004;3.重庆市中药研究院,重庆410065)
5种藏医药用翠雀属植物的ITS2分子鉴别研究
李永波1,吴波1,2,幕泽迳1,2,赵纪峰3,刘翔3,周华蓉3,钟国跃1,2*
(1.江西中医药大学中药资源与民族药研究中心,江西南昌330004;2.江西民族传统药现代科技与产业发展协同创新中心,江西南昌330004;3.重庆市中药研究院,重庆410065)
摘要:采用ITS2序列进行翠雀属5种藏医药用植物的分子鉴定。通过测定蓝翠雀花(Delphiniumcaeruleum)、光序翠雀花(Delphinium.kamaonense)、翠雀花(Delphinium.grandiflorum)和三果大通翠雀花(D.kamanensevar.glabrescens)的ITS2序列,借助MEGA6.0软件比较和分析ITS2序列特征,显示翠雀属5种药用植物ITS2长度均为220 bp,变异位点12个,其中信息位点9个;光序翠雀花与翠雀花遗传距离最小,三果大通翠雀花与其余4种翠雀属植物遗传距离较大,亲缘关系较远。结果表明5种翠雀属药用植物的ITS2序列可作为分子鉴定的依据。
关键词:藏药;翠雀属;ITS2序列;分子鉴定
An ITS2 Sequence Analysis of Five Tibetan
翠雀属(DelphiniumL.)是毛茛科(Ranunculaceae)中的一个大属,全世界约300种,我国有113种,全国各地均有分布,以云南北部、西藏东部和四川西部等的高原地区分布的种类最为丰富,约有48种,17变种,1亚种[1]。该属不少种类为藏药特色药材,以全草或花入药,具有清热解毒、疏肝利胆、止痛止泻等功效,在临床和民间常用于肝胆疾病、肠热腹泻、肠炎、痢疾、跌打损伤、风湿、牙痛等症,一些种类还可作为土农药,用来杀虱和蚊蝇的幼虫[2]。由于目前藏药材专业市场尚不健全,藏区各藏医医疗机构、制药企业使用的藏药材多为自行组织人员或委托各地牧民采集,同时各地用药习惯也有差异,各地使用的来源于该属植物的藏药材的基原植物极为复杂。据对有关藏药材的标准和专著文献记载的统计分析[3],藏医药用的翠雀属植物约有28种(为藏医药用毛茛科植物中药用种类最多的属),常见的种类有蓝翠雀花(Delphinium.caeruleumJacq.exCamb.)、粗距翠雀花(Delphinium.pachycentrumHemsl.)、三果大通翠雀花(Delphinium.pylzowiivar.trigynumW.T.Wang)、光序翠雀花(Delphinium.kamaonenseHunth.)及其变种展毛翠雀(Delphiniumkamanensevar.glabrescensW.T.Wang)、翠雀花(Delphinium.grandiflorumL.)等,这些种类涉及到“夏刚巴”、“玄果贝”、“逮木萨”[4-5]等8个药材品种,其“药材-基原”也多有交叉,为保证临床用药准确,有必要建立其有效的基原植物种鉴别方法。
准确鉴定药材的基原是保障临床用药准确和安全有效的前提。近年来,随着分子生物学的快速发展,DNA条形码技术为中药材物种鉴定研究提供了方便快捷的方法,已被广泛应用于药用植物的鉴别研究[6-9],即通过采用基因组中一段公认标准的、相对较短的DNA片段作为标记,对物种进行快速、准确地识别和鉴定。相对其他分子标记技术,DNA条形码技术具有它们无法比拟的优势:①鉴定过程更加快速,可以在短时间内鉴定大量样本;②试验过程标准化,操作简单,更容易实现物种鉴定的自动化;③试验结果重复性和稳定性高;④只需选用一个或少数几个合适的基因片段即可对整个属、科甚至几十个科的绝大部分物种进行准确地鉴定。ITS2序列作为药用植物鉴别的标准条形码序列[10],在种间及种下居群间具有进化速率快,变异程度高、区分物种能力强等特点,适用于药用植物与其近缘种类等较低分类阶元的分子鉴定[11-13]。近年来,有关藏药品种的生药鉴定有较多研究,而有关用ITS2序列鉴定翠雀属药用植物的研究未见报道。本研究以翠雀属5种药用植物为对象获得ITS2序列,采用DNA条形码技术从分子系统学角度探讨它们的亲缘关系,同时为藏医药用翠雀属植物的基原鉴定提供分子依据。
1材料与方法
1.1材料
实验采集蓝翠雀花、三果大通翠雀花、光序翠雀花、翠雀花共4个物种9个样本,经江西中医药大学钟国跃研究员鉴定,凭证样本保存于江西中医药大学植物标本馆。其余序列均来源于GenBank数据库,材料来源和GenBank数据详见表1。
1.2方法
1.2.1DNA提取将实验样品用75%乙醇擦拭表面后,用液氮研磨粉碎,取药材50 mg,再加入1 mL核分离液(1 mol/L Tris-HCl pH8.0,0.5 mol/L EDTA pH8.0,0.7 mol/L NaCl,2%β-巯基乙醇,2%PVP-40),涡旋5 min,弃上清。用核分离液分别处理3次后加入预热的GP1再56 ℃水浴过夜。以预冷的异丙醇代替GP2沉淀DNA。其他步骤均参照DNA提取试剂盒(TIANGEN BIOTECH BEIJING CO.,LTD)的方法提取样品总DNA。
1.2.2PCR扩增及测序使用通用引物ITS2F(5′-ATGCGATACTTGGTGTGAAT-3′),ITS3R(5′-GACGCTTCTCCAGACTACAAT-3′)进行PCR扩增。PCR反应体系为30 μL:ddH2O 10.8 μL,2×Taq MasterMix 15 μL,上下游引物各0.6 μL(10 μmol/L),总DNA3 μL(10 mg/L)。PCR扩增程序:94 ℃预变性5 min,再进行35个循环:94 ℃、30 s,59 ℃、45 s,72 ℃、45 s;最后72 ℃延伸10 min。采用1%的琼脂糖凝胶电泳检测对PCR产物进行检测。委托上海生工生物工程股份有限公司对PCR产物进行纯化并进行双向测序,实验样本序列已提交至GenBank数据库,登录号详见表1。

表1 研究材料信息
1.2.3数据分析采用CodonCodeAlignerV 5.1(CodonCode Co.,USA)对测序峰图进行校对拼接,去除低质量区及引物区,并将所有实验样本序列包括从GenBank下载的序列基于隐马尔科夫模型的HMMer注释方法去除两端的5.8 s和28 s区段获得ITS2间隔区序列[14]。然后,使用MEGA 6.0软件对获得的所有序列进行同源性分析,并计算遗传距离,采用NJ法构建系统发育树,采用Bootstrap(1 000次重复)检验各分支的支持率。
2结果与分析
2.15种翠雀属植物的ITS2序列比较
测序结果表明,序列中除ITS2序列全长外,还包含5.8 s和28 s的部分序列,翠雀属4种药用植物的ITS2序列已提交至NCBI,GenBank登录号和对应的植物名称见表1。
利用MEGA 6.0对翠雀属的16条ITS2序列进行比对结果表明,光序翠雀花与翠雀花之间的差异最小,仅存在2个碱基的差别;粗距翠雀花与光序翠雀花有6个碱基的差异,与翠雀花有4个碱基的差异;蓝翠雀花与光序翠雀花有5个碱基的差异,与翠雀花有3个碱基的差异;三果大通翠雀花与其余四种翠雀属植物种间差异很大。翠雀属5种药用植物ITS2长度均为220 bp,GC含量为71.8%~73.2%,共有12个变异位点,其中特异性位点9个,分别为44、46、62、79、85、142、159、173及202位点,分别占总位点数的5.45%和4.09%,具体变异位点信息详见表2。
2.2聚类分析
基于Kimura 2-parameter计算5种药用植物之间的遗传距离,结果翠雀花与光序翠雀花亲缘关系最近,种间平均K2P遗传距离为0.007 0。光序翠雀花与三果大通翠雀花亲缘关系最远,种间平均K2P遗传距离为0.038 0。
本研究基于ITS2序列,采用NJ法构建了系统发育树,经1 000次自举检测,从系统发育树(图2)可以看出,亲缘关系较近光序翠雀花与翠雀花处于同一分支,并得到88%支持,之后以64%的支持率与粗距翠雀花聚为一起,与它们遗传距离较远三果大通翠雀花自成另一分支。

表2 翠雀属药用植物ITS2序列变异位点
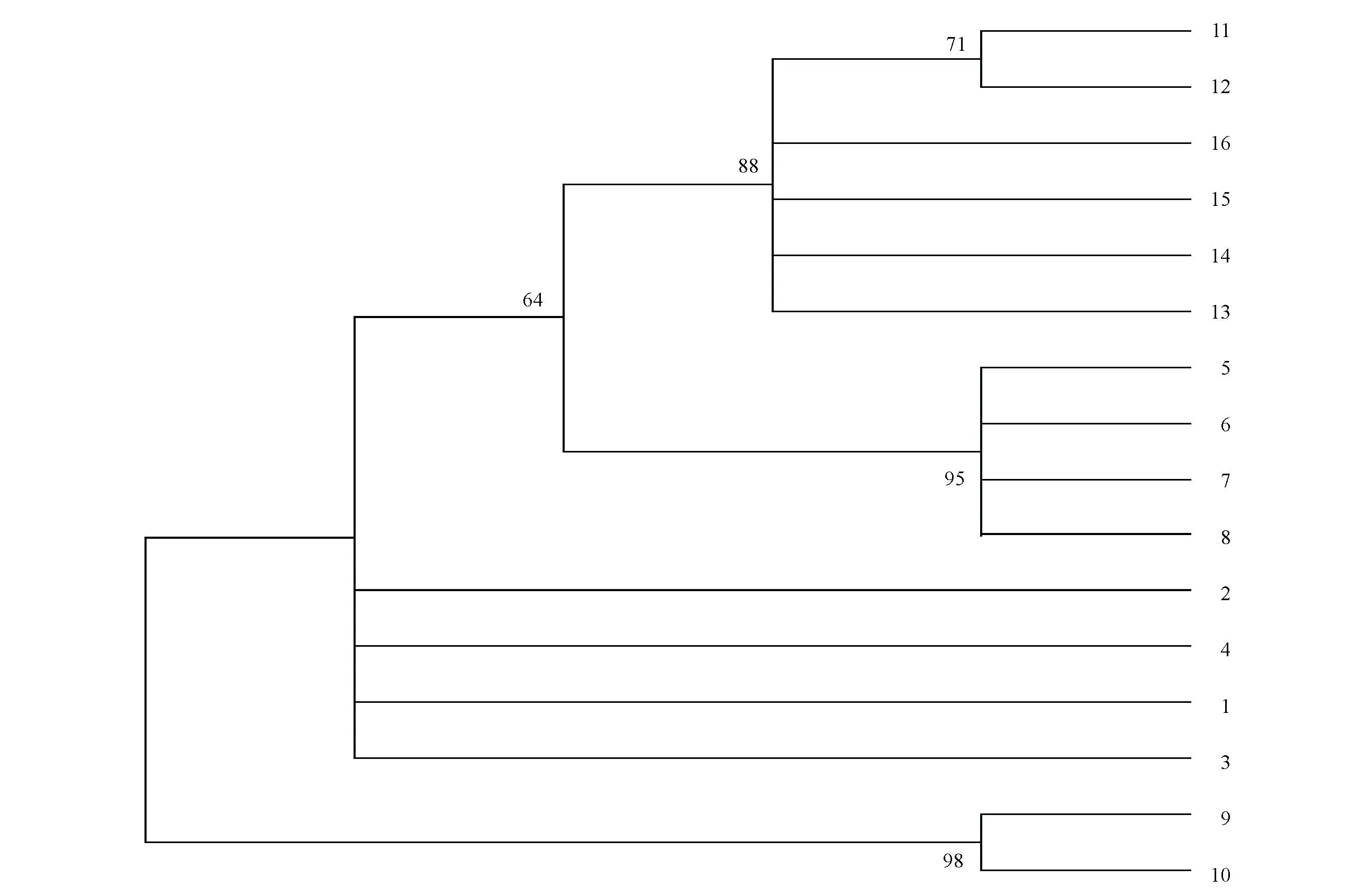
Bootstrap 1 000次重复,枝上数值仅显示自展支持率≥50%:1~4:蓝翠雀花,GB登录号分别为KT350987、KT350988、KT350989、KU095854;5~8:粗距翠雀花,GB登录号分别为KF233841、KF022341、KF022339、KF022340;9~10:三果大通翠雀花,GB登录号分别为KT350990、KT350991;11~12:光序翠雀花,GB登录号分别为KT350992、JF976235;13~16:翠雀花,GB登录号分别为KT350993、KT350994、KF022337、KF022338。图2 基于ITS2序列构建的NJ系统发育树Fig.2 NJ systematic tree based on ITS2 sequences
3讨论
(1)本实验采用改良的DNA提取试剂盒法,通过提取前用核分离液处理以及延长水浴时间等方法,可有效去除药材色素、蛋白质以及多酚类物质,尽管提取出来的DNA降解相对严重,但并未影响后续的PCR扩增及测序,这与罗焜[15]、辛天怡[16]等在中药秦艽、羌活的研究报道一致。
(2)《中国植物志》把光序翠雀花、翠雀花、蓝翠雀花划分为翠雀属翠雀组,三果大通翠雀花划分为翠雀属密花翠雀花组,粗距翠雀花划分为翠雀属滇川翠雀花组,由图2可以看出这5个物种基本按照上述植物分类组的划分聚为一起,但粗距翠雀花与光序翠雀花、翠雀花、蓝翠雀花同聚在第一大分支中,这与传统分类学观点有少许分歧。由于本实验所选择的种以及居群在翠雀属和藏区内所占的比例相对较小,故本文中基于ITS2序列分析的结果只能反映翠雀属植物遗传背景的一方面,尚难以准确判断,有关藏药翠雀属药用植物分子系统学的深入研究还需要增加翠雀属不同种、不同居群以及参考其他一些序列如psbA-trnH等做出进一步的判断。
(3)翠雀属是藏医药用毛茛科植物种类中应用最多的一个属,涉及到多个药材品种,各自在功能主治上也存在差异,《部颁标准·藏药分册》在“夏刚巴/展毛翠雀”条下收载的基原为“展毛翠雀(D.kamaonensevar.glabrescens)及同属数种植物”,《藏药标准》以“玄果贝/囊距翠雀”收载了囊距翠雀(D.brunonianumRoyle.),《青海省藏药标准》(1992)也收载了“展毛翠雀(D.kamaonensevar.glabrescens)、翠雀(D.grandiflorum)、白蓝翠雀花(D.albocoeruleumMaxim.)、大通翠雀(D.pylzowiiMaxim.)、蓝翠雀(D.caeruleum)等多种”,反映出藏医常用翠雀属植物的种类和基原较为复杂,但上述标准中均仅有性状或粉末鉴别,并且翠雀属植物在形态上十分相似,药材也较难区别,这种状况显然不利于保障其临床用药的准确和安全有效。本研究结果显示,从基于ITS2序列构建的NJ树可以看出,ITS2序列能够很好的区分这5种藏医常用翠雀属植物,为其植物之间的鉴定提供了一定的分子标记。
(4)本研究以5种藏医常用翠雀属植物为研究对象,利用DNA条形码技术测定了其中4种药用植物的ITS2序列,已提交GenBank数据库,这在一定程度上丰富了NCBI数据库中翠雀属植物的序列信息。
参考文献:
[1]吴玉虎.青藏高原维管植物及其生态地理分布[M].北京:科学出版社,2008:
[2]巩红冬.青藏高原东缘翠雀属藏药植物资原调查[J].安徽农业科学,2011(6):3222.
[3]李敏,雷志强,钟国跃.藏医学药用毛茛科植物药材品种与标准的现状分析[J].中药新药与临床药理,2015(1):133-137.
[4]《中华本草》编委会.中华本草·藏药卷[M].上海:上海科学技术出版社,2002.
[5]杨永昌.藏药志[M].西宁:青海人民出版社,1991.
[6]Kress W J,Wurdack K J,Zimmer E A,et al.Use of DNA barcodes to identify flowering plants[J].Proc Natl Acad Sci USA,2005,102(23):8369-8374.
[7]Song J Y,Yao H,Li Y,et al.Authentication of the family Polygonaceae in Chinese pharmacopoeia by DNA barcoding technique[J].J Ethnopharmacol,2009,124(3):434-439.
[8]Gao T,Yao H,Song J Y,et al. Identification of medicinal plantsin the family Fabaceae using a potential DNA barcode ITS2[J].J Ethnopharmacol,2010,130(1):116-121.
[9]陈士林,宋经元,姚辉,等.药用植物DNA条形码鉴定策略及关键技术分析[J].中国天然药物,2009(5):322-327.
[10]刘依丽,冯尚国,何仁锋,等.基于ITS2条形码对铁皮石斛及其混伪品分子鉴定的初步研究[J].杭州师范大学学报:自然科学版,2014(1):35-41.
[11]罗焜,陈士林,陈科力,等.基于芸香科的植物通用 DNA 条形码研究[J].中国科学:生命科学,2010,30(4):342-351.
[12]朱英杰,陈士林,宋经元,等.重楼属药用植物DNA 条形码鉴定研究[J].药学学报,2010,45(3):376-382.
[13]Pang X H,Song J Y,Chen S L,et al.Applying plant DNA bar codes for Rosaceae species identification[J].Cladistics,2011,27:165-170.
[14]KeHer A,Schleicher T,Schuhz J,et al.5.8S-28S rRNA interaction and HMM-based ITS2 annotation[J].Gene,2009,430:50-57.
[15]罗焜,马培,姚辉,等.多基原药材秦艽ITS2 条形码鉴定研究[J].药学学报,2012,47(12):1710-1717.
[16]辛天怡,姚辉,罗焜,等.羌活药材ITS/ITS2 条形码鉴定及其稳定性与准确性研究[J].药学学报,2012,47(8):1098-1105.
Medicine Plants ofDelphiniumL.
LI Yong-bo1,WU Bo1,2,MU Ze-jing1,2,ZHAO Ji-feng3,
LIU Xiang3,ZHOU Hua-rong3,ZHONG Guo-yue1,2*
(1.Research Center of Natural Resources of Chinese Medicinal Material and EthnicMedicine,Jiangxi University of Chinese Medicine,Nanchang 330004,China;2.Collaboration Innovation Center for the Modern Technology and Industial Development of Jiangxi Minority Traditional Medicine,Nanchang 330004,China;3.Chongqing Academy of Chinese Materia Medica,Chongqing 400065,China)
Abstact:The molecular identification of five Tibetan medicine plants inDelphiniumL.,Sequencingof ITS2 genes fromD.caeruleum,D.kamaonense,D.grandiflorumandD.kamanensevar.glabrescenswere performed.The sequence features were compared and analyzed using MEGA6.0 softwares.In the five Tibetan medicine plants inDelphiniumL.,the length of ITS2 was 220bp,with 12 variable sites and 9 parsimony information sites.The smallest genetic distance was observed betweenD.kamaonenseandD.grandiflorum,and the largest existed betweenD.kamanensevar.glabrescensand,the rest ofDelphiniumL.showed their farest genetic relationship.The conclusion is that ITS2 sequences of the five medicinal plants inDelphiniumL.can be used as the reference for molecular identification.
Key words:Tibetan medicine;DelphiniumL.;ITS2 sequence;molecular identification
作者简介:李永波(1989—),男,硕士生,E-mail:lyb6638@sina.com;*通信作者:钟国跃,研究员,博导,E-mail:zgy1037@163.com。
基金项目:“江西民族传统药现代科技与产业发展协同创新中心”资助项目(51316935)
收稿日期:2015-10-10修回日期:2015-10-25
中图分类号:Q943.2
文献标志码:A
文章编号:1000-2286(2015)06-1100-05
李永波,吴波,幕泽迳,等.5种藏医药用翠雀属植物的ITS2分子鉴别研究[J].江西农业大学学报,2015,37(6):1100-1104.
