野外保存对益智叶片基因组DNA的影响
2015-02-27高炳淼田建平张俊清
高炳淼, 王 朝, 何 萍, 田建平, 张俊清, 魏 娜
(海南医学院 海南省热带药用植物研究开发重点实验室, 海南 海口571199)
野外保存对益智叶片基因组DNA的影响
高炳淼, 王 朝, 何 萍, 田建平, 张俊清, 魏 娜*
(海南医学院 海南省热带药用植物研究开发重点实验室, 海南 海口571199)
为获得高质量的益智基因组DNA寻找一种简单可行的野外益智鲜叶保存方法,利用植物基因组提取试剂盒法提取益智基因组DNA,以新鲜叶片为对照及DNA的纯度、浓度、琼脂糖凝胶电泳和ITS-PCR扩增效果为评价指标,比较室温阴干、室外晒干、硅胶干燥和液氮保存4种鲜叶保存方法对提取益智基因组DNA效果的影响。结果表明:4种保存方法均可获得益智基因组DNA且ITS-PCR均获得约700 bp的PCR产物,其中液氮保存5 d的叶片提取DNA条带清晰明亮,室温阴干、硅胶干燥和室外晒干保存方法提取的基因组DNA分别在4 d、3 d和2 d后开始发生降解,不同保存方法效果依次是液氮保存>室温阴干>硅胶保存>室外晒干。在远距离野外资源调查和收集时,采用室温阴干保存新鲜益智叶片是经济简单可行的野外保存方法。
益智; DNA提取; PCR; 野外保存方法
益智(AlpiniaoxyphyllaMiquel)为姜科山姜属植物,其干燥成熟果实为常用中药。益智仁为海南道地药材之一,也是我国四大南药之一,具暖肾固精缩尿、温脾止泻摄唾之功效[1]。益智原产热带[2],主要为人工栽培,分布于海南、广东雷州半岛,此外广西、福建、云南等地亦有栽培。其中,海南益智仁产量占总产量的95%以上[3]。近年来,对野生益智资源滥采乱挖现象严重,致使益智野生资源日渐枯竭,已成为濒危药用植物[4]。因此,益智野生资源的可持续性利用和保护势在必行。
当前,基于基因多态性的DNA分子标记技术已在濒危药用植物野生资源利用与保护方面得到广泛应用,并成为科研工作者的研究热点[5]。已有文献报道利用不同方法保存麻黄、扁桃和杨树等一些植物材料,但不同植物种类其保存方法存在差异[6-8]。笔者按照Chase[9]采用硅胶法保存野外采集的益智新鲜叶片,提取益智基因组DNA结果并不理想。但关于益智新鲜叶片的不同保存方法对南药益智基因组DNA提取的影响尚未见报道。因此,寻找一种野外可行的保存益智叶片而不影响DNA质量的方法,是目前本研究首要解决的问题。笔者通过对室温阴干、室外晒干、硅胶和液氮保存4种野外可行的鲜叶保存方法保存的益智叶片样品进行基因组DNA提取,采用琼脂糖凝胶电泳和紫外分光光度计法对其完整性、纯度以及浓度进行鉴定,再对其ITS-PCR扩增产物进行分析,旨在确定新鲜益智叶片的最佳保存方法,为提取出高质量的基因组DNA奠定基础,为进一步的分子生物学试验提供可靠保证。
1 材料与方法
1.1 材料
1.1.1 植物 以益智的新鲜叶片为材料,采自野外移栽于海南医学院校园的益智新鲜叶片。标本凭证由海南医学院田建平副教授鉴定为姜科植物益智。
1.1.2 试剂 PCR TaqMix、DL2000、RNaseA、植物基因组DNA提取试剂盒(DP305)为天根产品均购于海南隽誉科技有限公司,β-巯基乙醇、西班牙琼脂糖(Biowest Agarose)均购于海南合辉实业有限公司,Goldview核酸染料购于赛百盛公司,其余试剂均为国产分析纯。
1.1.3 仪器 台式高速冷冻离心机(TGL16M)、恒温水浴锅(HH-S24)、凝胶成像系统(Tanon 4100)、核酸蛋白分析仪(Eppendorf)、电泳仪(DYY-7)、PCR仪(杭州博日TC-96)、涡旋混合仪(WH-3)。
1.2 植物样品保存
取益智嫩叶分别于室温阴干、硅胶保存、室外晒干、液氮保存共4种方法保存。其中,15份样品室温阴干和硅胶保存时间为5 d,9份样品室外晒干保存时间为3 d(样品2 d已完全干燥,故只保存3 d即可),3份液氮保存时间为5 d,每次取3份样品保存于-80℃,鲜叶为对照。
1.3 基因组DNA提取
称取200 mg益智新鲜或不同方法保存的叶片,置灭菌后的研钵中,加液氮迅速研磨后小心移入2 mL离心管中,按照天根植物基因组DNA试剂盒说明书提取。
1.4 DNA的电泳及紫外检测
取5 μL基因组DNA样品与1 μL上样缓冲液混匀后点样于含Goldview核酸染料的0.8%琼脂糖凝胶孔中,电泳缓解液为1×TBE溶液,电压为90 V条件下电泳30 min左右,用凝胶成像系统照相并保存。
取20 μL DNA样品用无菌ddH2O稀释50倍,混匀后加入石英比色皿中,用核酸蛋白分析仪测定波长260 nm和280 nm的光吸收值。根据A260/A280的值判断总DNA纯度,并计算质量浓度。DNA质量浓度(μg/mL)=A260×稀释倍数×50。
1.5 PCR扩增反应
以益智基因组中的核糖体DNA(nrDNA)内转录间隔区(ITS)序列为模板,扩增引物采用通用引物ITS1和ITS4,分别为5′-AGA AGT CGT AAC AAG GTT TCC GTA GG-3′和5′-TCC TCC GCT TAT TGA TAT GC-3′。具体ITS-PCR反应体系和反应条件参照文献[10]。
2 结果与分析
2.1 不同保存方法的基因组DNA纯度及浓度
由表可知,鲜叶和液氮保存提取的基因组DNA的A260/A280值分别为1.80和1.87,说明基因组DNA中的蛋白质和RNA等杂质较少,基因组DNA较纯净,基本无蛋白质、多糖或RNA的污染。液氮保存后提取的基因组DNA与鲜叶提取获得率基本相当。室外晒干和硅胶保存样品提取基因组DNA的A260/A280值均小于1.7,且随保存时间延长其A260/A280值和提取浓度不断降低,说明硅胶保存和室外晒干保存的样品提取的基因组DNA中蛋白或酚类杂质污染不易除去。室温阴干的叶片4 d内提取基因组DNA的A260/A280值为1.8~2.0,存在少量杂质如RNA未除净,说明在4 d内室温阴干保存新鲜益智叶片效果较好。
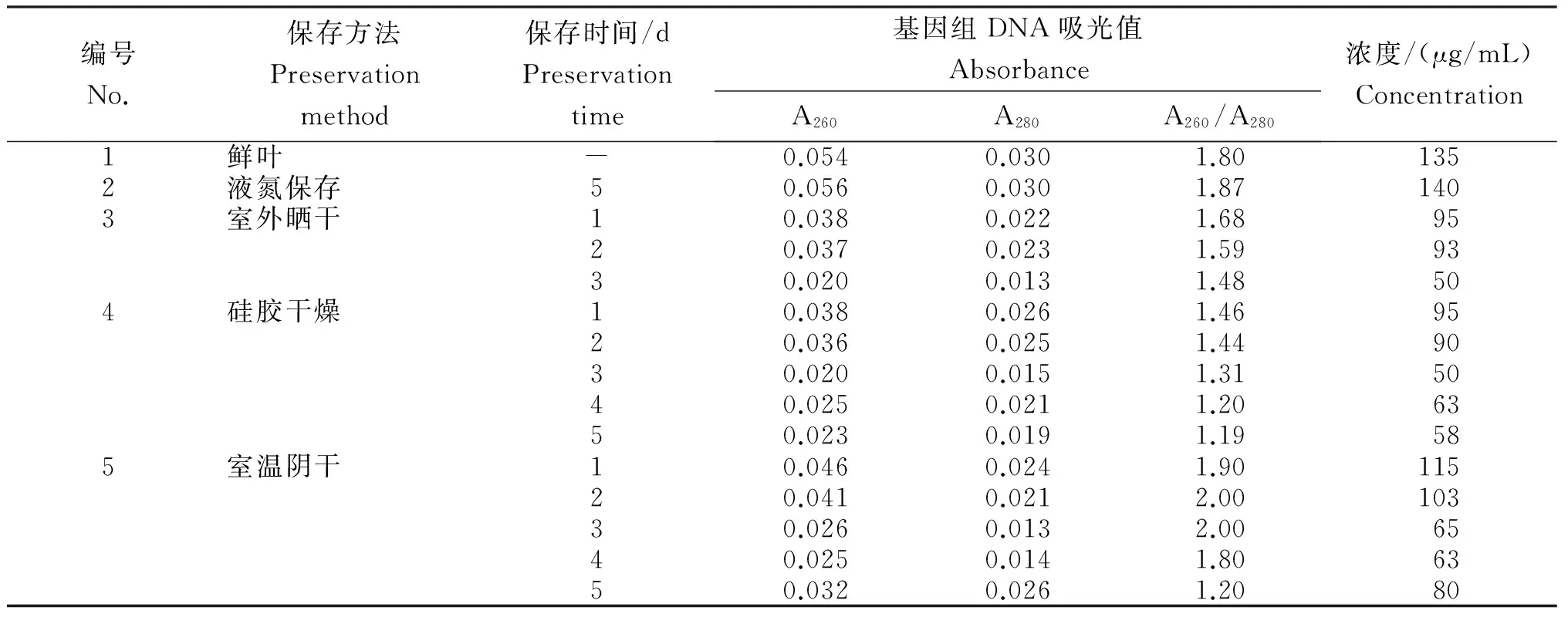
表 不同保存方法益智基因组DNA的纯度与得率
2.2 不同保存方法的琼脂糖电泳比较
由图1琼脂糖电泳可知,不同保存方法的南药益智叶片样品的基因组DNA提取效果存在明显差异。
1) 新鲜益智叶片提取的益智基因组DNA条带整齐、明亮且无拖尾现象,说明新鲜样品是提取基因组DNA的最理想材料(图1A)。
2) 新鲜益智叶片硅胶保存5 d后的样品提取基因组DNA如图1B显示,在保存的2 d前提取基因组DNA条带整齐,主条带下略有弥散带;当保存至第3天后,提取基因组DNA条带弥散程度随保存时间越来越严重,提取的量少且质量不佳,表明基因组DNA已部分发生降解。表明,硅胶保存超过3 d后新鲜益智叶片基因组DNA降解,影响提取质量。
3) 新鲜益智叶片放置于室温阴干保存5 d后的样品提取基因组DNA如图1C显示,在阴干保存3 d前提取基因组DNA样品的条带清晰、明亮整齐略带拖尾现象;保存第4天后提取基因组DNA条带明亮度明显下降,仅提取量较少,但基因组仍然比较完整。表明,室温阴干保存3 d内可获得产率较好的完整基因组DNA,5 d内仍然可获得完整的基因组DNA。
4) 新鲜益智叶片直接放于阳光充足的地方室外晒干保存,当晒到第3天已完全干燥。晒干样品提取基因组DNA如图1D显示,晒干第1天提取的基因组DNA样品条带清晰、整齐无拖尾现象,但获得率较低;晒干第2天后,提取的基因组DNA样品条带出现拖尾现象,说明基因组DNA开始发生降解。表明,室外晒干2 d后基因组DNA开始发生降解,得率较少。
5) 新鲜益智叶片迅速置于液氮保存5 d后样品提取基因组DNA如图1E显示,基因组DNA降解较少,提取效果好。保存时间不会影响其基因组DNA的提取效果。表明,液氮保存新鲜益智叶片能提取出高质量的基因组DNA且无降解。
2.3 ITS-PCR分析不同保存方法提取的基因组DNA
植物的ITS具有保守性强,总长度只有600~700 bp,采用通用ITS引物扩增的PCR条带应在700 bp左右。不同保存方法提取的基因组DNA进行ITS-PCR扩增结果表明,扩增的条带大小与预期大小相符合(图2)。从4种方法保存的益智叶片中提取的DNA均可扩增出条带,其中新鲜叶片、液氮和室温阴干保存的扩增条带清晰、明亮而无弥散现象。硅胶保存第4天和室外晒干第2天样品提取的基因组DNA扩增条带亮度相对较弱。表明,液氮和室温阴干保存优于硅胶和室温晒干2种保存方法,硅胶保存和室外晒干保存不宜作为长距离野外保存新鲜样品的方法。
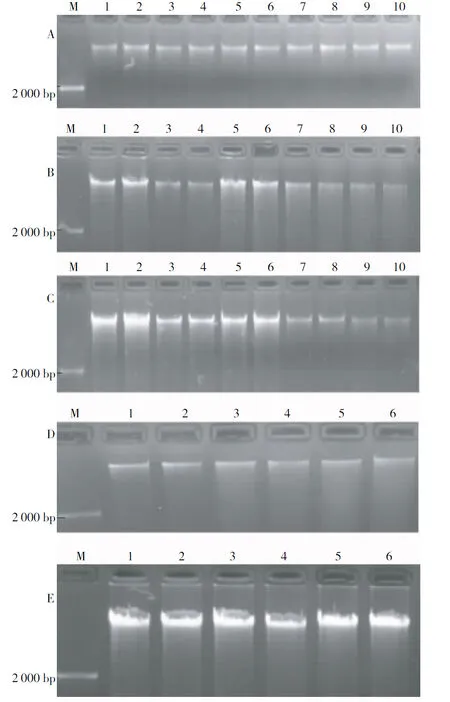
注: A 新鲜叶片:Lane M为D 2 000 DNA marker,泳道1~10为新鲜益智叶片。B 硅胶保存:泳道1~2为硅胶保存益智叶片1 d,泳道3~4为硅胶保存益智叶片2 d,泳道5~6为硅胶保存益智叶片3 d,泳道7~8为硅胶保存益智叶片4 d,泳道9~10为硅胶保存益智叶片5 d。C 室温阴干:泳道1~2为室温阴干保存益智叶片1 d,泳道3~4为室温阴干保存益智叶片2 d,泳道5~6为室温阴干保存益智叶片3 d,泳道7~8为室温阴干保存益智叶片4 d,泳道9~10为室温阴干保存益智叶片5 d。D 室外晒干:泳道1~2为晒干保存益智叶片1 d,泳道3~4为室外晒干保存益智叶片2 d,泳道5~6为室外晒干保存益智叶片3 d。E 液氮保存:泳道1~6为保存益智叶片5 d。
Note:A, fresh leaves: Lane M,D2 000 DNA marker; lane 1~10,fresh leaves. B, silica gel: lane 1~2, leaves with silica gel 1 d; lane 3~4, leaves with silica gel 2 d; lane 5~6,leaves with silica gel 3 d; lane 7~8,leaves with silica gel 4 d; lane 9~10,leaves with silica gel 5 d. C, room temperature: lane 1~2,leaves with room temperature 1 d; lane 3~4,leaves with room temperature 2 d; lane 5~6,leaves with with room temperature 3 d; lane 7~8,leaves with room temperature 4 d; lane 9~10,leaves with room temperature 5 d. D, outdoor season: lane 1~2,leaves with outdoor season 1 d; lane 3~4,leaves with outdoor season 2 d; lane 5~6,leaves with outdoor season 3 d. E, liquid nitrogen: lane 1~6,leaves with liquid nitrogen 5 d.
图1 不同保存方法叶片提取的基因组DNA电泳图谱
Fig.1 Electrophoresis of genomic DNA from leaves saved by different preservation methods
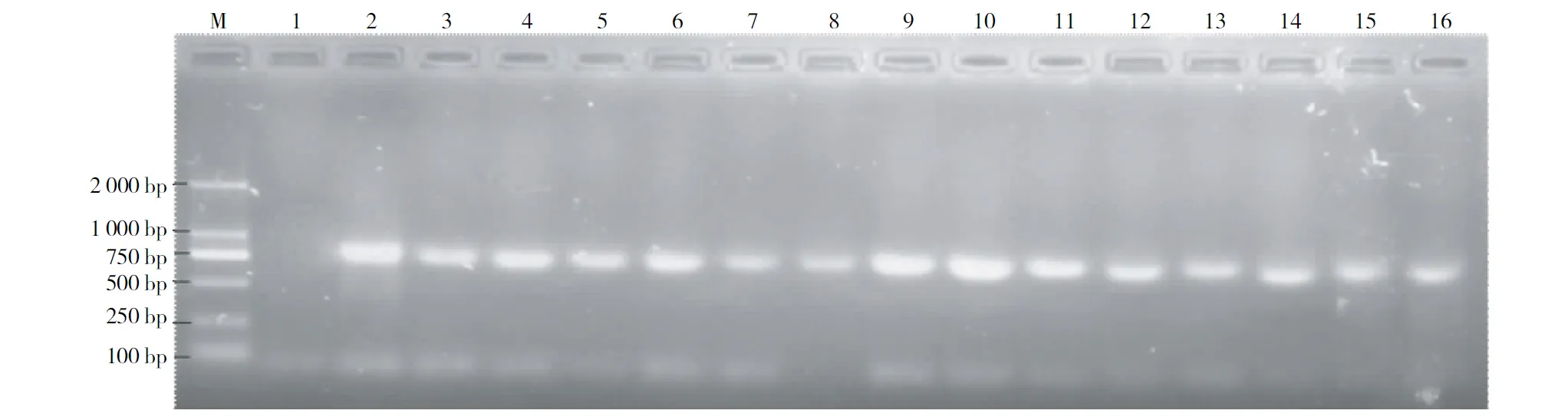
注:M为D2000 DNA marker,泳道1为阴性对照,泳道2为新鲜叶片DNA为模板,泳道 3为液氮保存叶片DNA为模板,泳道4~8为硅胶保存叶片DNA为模板,泳道9~13为室温阴干叶片DNA为模板,泳道14~16为室温晒干叶片DNA为模板。
Note: lane M,D2000 DNA marker; Lane 1,negative control;lane 2, DNA of the fresh leaves as a template;lane 3,DNA of leaves stored in liquid nitrogen as a template;lane 4~8,DNA of leaves saved in silica as a template;lane 9~13,DNA of leaves dried in room temperature as a template;lane 14~16,DNA of leaves dried at outdoor season as a template.
图2 ITS-PCR扩增不同保存方法提取的DNA电泳图谱
Fig.2 Electrophoresis of the ITS-PCR product for different preservation methods
3 结论与讨论
研究结果表明,4种保存方法均可获得益智基因组DNA且ITS-PCR均获得约700 bp的PCR产物,其中液氮保存5 d的叶片提取DNA条带清晰明亮,室温阴干、硅胶干燥和室外晒干保存方法提取的基因组DNA分别在4 d、3 d和2 d后开始发生降解,不同保存方法效果依次是液氮保存>室温阴干>硅胶保存>室外晒干。
药用植物基因组DNA提取是中药分子生物学研究的基本手段,是中药材分子标记、中药活性成分关键酶基因克隆等后续操作的基础。提取药用植物材料基因组的最佳材料是新鲜植物叶片,而干燥后中药材的基因组DNA已发生严重降解,要求质量较高的分子生物学研究无法满足后续的试验。植物基因组中DNA的提取方法有多种,如CTAB法[11]、SDS法[12]、高盐低pH法[13]等。不同提取方法对不同植物提取基因组DNA各有优点,当前植物基因组提取试剂盒法已广泛应用,且提取质量和稳定性好[14]。为保证提取方法不影响不同保存方法的样品DNA,本试验采用植物基因组DNA试剂盒法提取益智叶片基因组DNA。
多数药用植物,特别是野生及频危的药用植物都分布在偏远的山区,采集这些样品后若保存方法不当,新鲜材料在旅途中可能枯萎、腐烂,特别是一些离体材料极易受DNA酶的作用,从而导致DNA降解,而无法获得高质量的DNA[15]。通常情况下,植物材料在低温环境下可长期存放,如液氮保存下可以抑制相关酶的活性,使DNA降解速度减慢。因此,常采用液氮保存新鲜植物样品材料,以保持其材料的新鲜度。本研究液氮保存后益智基因组DNA提取结果与文献报道的研究结果相类似,液氮是保存新鲜叶片的理想方法[7]。但在较远山区或者时间较长的采样时,若携带液氮冻存植物材料存在液氮易挥发、体积大和成本高等导致诸多不便。已有研究表明,用硅胶干燥和室温阴干的叶子可以用于基因组DNA的提取[6-8]。从益智新鲜叶片中提取基因组DNA技术已比较成熟,但对于姜科植物益智从硅胶和室温阴干等保存叶片中提取DNA还未曾有报道。本研究对比了硅胶保存、室外晒干和室温阴干3种野外可行的保存野外新鲜益智叶片,结果表明室温阴干效果优于其他2种,与文献报道的硅胶保存能有效保存基因组DNA的结果不同[9]。原因可能是由于植物材料的不同,南药益智为多年生草本植物,其地上茎叶纤维质含量高,可以有效地防止组织或细胞失水,延长了其脱离母体后的保鲜时间,减缓了DNA的降解速度。室温阴干的新鲜叶片置于开放的空气中,而保存于硅胶密封袋内反而使细胞处于缺氧状态,加速了细胞凋亡导致基因组DNA更易发生降解[16]。
[1] 黄泰康.现代本草纲目(下卷)[M].北京:中国医药科技出版社,2001:2279-2281.
[2] 杨福孙,李榕涛,甘炳春,等.野生抚育益智光合特性研究[J].中国中药杂志,2011,36(2):123-126.
[3] 张俊清,段金廒,叶 亮,等.益智的历史沿革与应用特点[J].中国实验方剂学杂志,2011,21(17):289-292.
[4] 杨福孙,甘炳春,李榕涛,等.野生抚育益智主要性状与产量的回归模型及相关分析[J].中国农学通报,2010,26(2):272-276.
[4] He H M, Xu Q Q, Chen R H. Relationship between the nutritive components of Alpinia oxyphylla and the environmental factors[J].Nat. Sci. J.Hainan Univ.,1992,10:38-44.
[5] 毛 帅,刘朝奇,向婷婷,等.基于DNA水平的中国药用植物分子鉴定方法[J].中国实验方剂学杂志,2014,20(5):238-242.
[6] 马 帅,张 玲,焦培培,等.不同保存方法和提取方法对扁桃基因组DNA质量的影响[J].基因组学与应用生物学,2014,33(1):153-158.
[7] 朱田田,杜 弢,晋 玲,等.不同保存方法对中麻黄基因组DNA提取效果的影响[J].山西农业科学,2013,41(1):23-25.
[8] 刘春英,樊军锋,高建社,等.叶片不同保存方法对杨树基因组DNA提取效果的影响[J].西北林学院学报,2013,28(4):71-73.
[9] Chase H W, Hills H H. Silical gel: an ideal material for field preservation of leaf samples for DNA studies[J].Taxon,1991,40:215-220.
[10] 陈 业,张玉晶,李娅迪,等.兜兰ITS-PCR反应体系的建立及优化[J].贵州农业科学,2012,40(7):51-55.
[11] 刘晓静,王海燕,张根良,等.改良CTAB法提取益智基因组DNA[J].江西农业学报,2007,19(8):111-112.
[12] 王 玉,贾锦山,张娜娜,等.提取玫瑰基因组DNA几种方法的比较[J].农学学报,2014,4(9):59-64.
[13] 装 黎,牛慧媛,涂 政,等.改良高盐低方法提取陈旧大麻初探[J].中国法医学杂志,2009,24(3):145-147.
[14] 李 会,任志莹,王 颖,等.不同DNA提取试剂盒提取作物种子基因组DNA效果的比较[J].湖北农业科学,2013,52(8):1956-1958.
[15] 张海燕,焦培培,李志军,等.不同保存方法对胡杨、灰叶胡杨叶片总DNA质量的影响[J].塔里木大学学报,2008,20(2):47-52.
[16] 胡翔宇,丁 琼,宋希强,等.2种保存方法对五唇兰基因组DNA提取质量的影响[J].热带作物学报,2014,35(8):1546-1550.
(责任编辑: 刘忠丽)
Effects of Wild Preserved Methods on Genomic DNA fromAlpiniaoxyphyllaLeaves
GAO Bingmiao, WANG Chao, HE Ping, TIAN Jianping, ZHANG Junqing, WEI Na*
(HainanMedicalUniversity,HainanProvincialKeyLaboratoryofResearchandDevelopmentofTropicalMedicinalPlants,Haikou,Hainan571199,China)
In order to find a simple and practical method to save the wildA.oxyphyllafresh leaves, so as to obtain high quality genomic DNA,A.oxyphyllagenomic DNA was extracted using the plant genome Extraction Kit.Compared with fresh leaves, four different preserved methods (dried at room temperature, outdoor season, dried with silica gel, stored in liquid nitrogen) forA.oxyphyllaleaves were evaluated. The effects of which were compared based on the yield, purity, agarose gel electrophoresis and ITS-PCR amplification effect, to identify genomic DNA of leaves which were saved after different methods. Results:Four kinds of preservation methods can getA.oxyphyllagenomic DNA and ITS-PCR were obtained approximately 700 bp PCR product. Genomic DNA was extracted from leaves stored in liquid nitrogen five days, of which bands showed clear and bright, Genomic DNA was extracted from leaves stored in dried at room temperature, silica gel drying and outdoor season, which respectively start degraded after 4 d, 3 d and 2 d. The effect of different preservation methods are stored in liquid nitrogen > dried at room temperature > dried with silica gel > outdoor season.Therefore, freshA.oxyphyllaleaves stored at room temperature drying is both economical and feasible method of field preservation in the distant field resources investigation.
Alpiniaoxyphylla; DNA extraction; PCR; wild preserved methods
2014-01-29; 2015-05-11修回
海南省自然科学基金项目“益智遗传多样性的AFLP分析”(814291);海南医学院药学院大学生创新课题“益智AFLP-PCR体系的建立与优化”(Hyydc2013004);海南医学院引进人才科研启动经费
高炳淼(1982-),男,讲师,博士,从事南药资源开发与生物技术工作。E-mail:gaobingmiao@qq.com
*通讯作者:魏 娜(1980-),女,副教授,从事南药黎药的药效物质基础工作。E-mail:weina-0613@163.com
1001-3601(2015)07-0351-0019-04
S567.7+9
A
