三七皂苷R1对肺高压大鼠肺动脉平滑肌细胞SOCE的抑制作用
2015-02-26王瑞幸穆云萍黄秋虹吴枝娟焦海霞林默君
王瑞幸,戴 耄,穆云萍,江 娇,黄秋虹,吴枝娟,焦海霞,林默君
(福建医科大学基础医学院生理学与病理生理学系,心血管科学研究室,福建福州 350108)
三七皂苷R1对肺高压大鼠肺动脉平滑肌细胞SOCE的抑制作用
王瑞幸,戴 耄,穆云萍,江 娇,黄秋虹,吴枝娟,焦海霞,林默君
(福建医科大学基础医学院生理学与病理生理学系,心血管科学研究室,福建福州 350108)
中国图书分类号:R-332;R284.1;R322.121;R322.74;R543.502;R544.02;R845.22
摘要:目的 探讨三七皂苷R1(notoginsenoside R1)对慢性低氧(chronic hypoxia,CH)及野百合碱(monocrotaline,MCT)致肺高压(pulmonary hypertension,PH)大鼠肺动脉平滑肌细胞(pulmonary arterial smooth muscle cells,PASMCs)钙池操纵性钙内流(store-operated calcium entry,SOCE)的作用。方法制备CH及MCT致PH大鼠模型,通过Mn2+淬灭Fura-2荧光和Fluo-3荧光检测胞质游离Ca2+浓度(intracellular free calcium concentration,[Ca2+]i)观察三七皂苷R1对CH及MCT致PH大鼠PASMCs SOCE的作用。结果 成功制备CH及MCT致PH大鼠模型;在硝苯地平预处理情况下,10 μmol·L-1三七皂苷R1可明显降低环匹阿尼酸(cyclopia-zonic acid,CPA)诱导CH及MCT致PH大鼠PASMCs Mn2+淬灭幅度、Mn2+最大淬灭率、胞膜Ca2+内流量和静息[Ca2+]i。结论 三七皂苷R1对CH及MCT致PH大鼠PASMCs具有抑制SOCE和降低静息[Ca2+]i的作用。
关键词:肺高压;慢性低氧;野百合碱;三七皂苷R1;钙池操纵性钙内流;肺动脉平滑肌细胞
网络出版时间:2015-9-14 14:53 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20150914.1453.054.html
肺高压(pulmonary hypertension,PH)是与许多不同病理特征和发病机制的疾病密切相关的病理生理学改变[1]。它是一种以进行性肺血管重构为特征的严重疾病,表现为肺血管阻力增高,肺动脉压力增高,右心室肥厚,最终可引起右心衰竭,甚至死亡[2]。目前研究表明,肺动脉平滑肌细胞(pulmona-ry arterial smooth muscle cells,PASMCs)静息胞质游离Ca2+浓度(intracellular free calcium concentration,[Ca2+]i)水平持续性增高,在血管收缩增强和血管重塑以及PH致病过程中起重要作用[3]。在特发性肺动脉高压患者、慢性低氧(chronic hypoxia,CH)和野百合碱(monocrotaline,MCT)诱导PH模型动物中静息[Ca2+]i的升高和肺动脉(pulmonary arter-ies,PAs)血管张力的增加主要是由钙池操纵性钙内流(store-operated calcium entry,SOCE)功能增强引起[4-7]。虽然PH的研究取得了明显的进展,但迄今尚缺乏有效的治疗手段。目前,主要治疗方法是应用血管扩张剂,如前列腺素、磷酸二酯酶抑制剂和内皮素-1受体拮抗剂等,但这些药物价格昂贵,且疗效有限。
近年来研究发现,从传统中药三七中提取的活性成分三七皂苷R1(notoginsenoside R1)具有减轻低氧和高碳酸血症诱导游离大鼠肺动脉环收缩的作用[8],我们先前研究也发现,三七皂苷R1可能通过抑制SOCE,降低血管激动剂对肺高压模型大鼠肺动脉的收缩作用[9]。本研究进一步观察三七皂苷R1对CH及MCT致PH模型大鼠PASMCs SOCE的作用。
1 材料与方法
1.1实验动物和分组 清洁级SD大鼠,♂,体质量180~200 g,购自福建医科大学实验动物中心[SCXK(闽)2012-0001],随机分成正常对照组(CON组)、CH致PH模型组(CH组)和MCT诱发PH模型组(MCT组)3组。
1.2试剂 MCT、胶原酶Ⅰ、木瓜蛋白酶、环匹阿尼酸(cyclopiazonic acid,CPA)、硝苯地平(nifedipine,Nif)、CaCl2、MnCl2、EGTA和A23187均为Sigma公司产品;Fluo-3,AM和Fura-2,AM(Invitrogen公司);三七皂苷R1(成都格雷西亚化学技术有限公司)。
1.3PH大鼠模型的建立
1.3.1CH诱发PH大鼠模型的建立大鼠置于常压低氧(体积分数为0.1)密封的有机玻璃饲养箱内,饲养21 d。
1.3.2MCT诱发PH大鼠模型的建立[7]大鼠按
50 mg·kg-1剂量一次腹腔注射61.5 mmol·L-1MCT后,常规饲养21 d。
1.4PH大鼠模型的鉴定
1.4.1右心室收缩压测定 大鼠腹腔注射肝素(Heparin,3125 IU·kg-1)5min后,氨基甲酸乙酯(1 g·kg-1)腹腔麻醉后,经右颈外静脉行右心室插管术,记录大鼠右心室收缩压(right ventricular sys-tolic pressure,RVSP)。
1.4.2右心室质量指数测定 测完RVSP后,迅速剪开胸腔取出大鼠的心脏和肺。沿房室交界处剪去左右心房及血管,分离右心室(RV)及左心室+室间隔(LV+S),并用滤纸吸去多余水分,分别称重,计算RV/(LV+S)即右心室质量指数(right ventricular mass index,RVMI)。
1.4.3肺动脉形态学检测 将取下的肺以1.47 kPa压力沿气管注入甲醛,固定24 h,石蜡包埋,在距离肺尖约0.5 cm处切片,HE染色,光学显微镜下观察肺血管形态。用Image Pro 6.0软件分别测量并计算直径为51-100 μm和101-150 μm肺动脉的管腔面积与总面积的百分比,以及管壁厚度与动脉半径的百分比。
1.5PASMCs的分离和培养 大鼠麻醉后,迅速剪开胸腔取出肺叶,在解剖显微镜下分离肺叶内PAs,沿PAs纵轴剪开暴露内壁,用棉签在PAs内壁小心擦拭以去内皮。分离好的PAs放在4℃含1.5 mmol·L-1CaCl2的HBSS液(mmol·L-1:NaCl 130.0,KCl 5.0,MgCl21.2,HEPES 10.0,Glucose 10.0,pH 7.2)中静置30 min,随后取出放入室温下含20 μmol·L-1CaCl2的HBSS液中静置20 min。再将PAs放入酶溶液(L-1:胶原酶Ⅰ1.75×106U,木瓜蛋白酶9.50×103U,牛血清白蛋白0.03 mmol,DTT 1.00 μmol;用含20 μmol·L-1CaCl2的HBSS液配制)中37℃水浴消化20 min,后用尼龙网滤去酶溶液,并用含20 μmol·L-1CaCl2的HBSS液清洗PAs,后再将其置于0.5 mL含20 μmol·L-1CaCl2的HBSS液中慢慢吹打,使细胞脱落并分散于溶液中。将细胞悬液滴于细胞培养皿中,加F12细胞培养液,于体积分数为0.21氧气的培养箱(CON组和MCT组细胞)或体积分数为0.03氧气的三气培养箱(CH组细胞)中37℃培养18~24 h。
1.6Mn2+淬灭Fura-2荧光实验 培养好的PASMCs用Fura-2 AM(5 μmol·L-1)在室温下培养液中负载40 min,负载结束后,细胞用含2 mmol· L-1CaCl2的Tyrode液(mmol·L-1:NaCl 137.0,KCl 5.4,MgCl21.0,HEPES 10.0,Glucose 10.0,pH 7.4)冲洗以去除细胞外的Fura-2 AM,并静置20 min,以使细胞内染料完全脱酯化。将细胞放置于倒置显微镜上,选择视野中形态好且密集的细胞团。启动实时细胞动态荧光强度系统,设置激发光波长为360 nm,发射光波长为510 nm,按实验程序经给药灌流系统加入相应的灌流液,记录与分析Fura-2荧光变化。Fura-2荧光变化的计算公式为:ΔFluorescence%=(F-Fbs)(Fbs-Fbg)×100%,F为实时测量荧光值,Fbs为含0.1 mmol·L-1EGTA的无钙Tyrode液中得到的基础荧光值,Fbg为10 μmol·L-1A23187和10 mmol·L-1MnCl2诱发的背景荧光值。并用Clampfit 8.2软件计算Mn2+最大淬灭率(maximum rate of quenching)。三七皂苷R1处理组为实验前培养液中加入10 μmol·L-1三七皂苷R1预孵育细胞10 min,并在给药灌流系统各灌流液中加入10 μmol·L-1三七皂苷R1。
1.7Fluo-3荧光检测PASMCs的[Ca2+]i培养好的PASMCs用Fluo-3 AM(5 μmol·L-1)在室温下培养液中负载40 min,负载结束后,细胞用含2 mmol·L-1CaCl2的Tyrode液冲洗以去除细胞外的Fluo-3 AM,并静置20 min,以使细胞内染料完全脱酯化。将细胞放置于倒置显微镜上,选择视野中形态好且密集的细胞团。启动实时细胞动态荧光强度系统(美国PTI公司),设置激发光波长为488 nm,发射光波长为510 nm,按实验程序经给药灌流系统加入相应的灌流液,记录与分析Fluo-3荧光变化。[Ca2+]i的计算公式为:[Ca2+]i=KD×(F-Fbg)/(Fmax-F),其中Fluo-3的KD值为1.1 μmol·L-1,F为实时测量荧光值,Fbg为10 mmol·L-1MnCl2诱发的背景荧光值,Fmax为10 μmol·L-1A23187和10 mmol·L-1CaCl2诱发的最大荧光值。三七皂苷R1处理组为实验前培养液中加入10 μmol·L-1三七皂苷R1预孵育细胞10 min,并在给药灌流系统各灌流液中加入10 μmol·L-1三七皂苷R1。
2 结果
2.1PH大鼠模型的鉴定
2.1.1RVSP和RVMI的变化 CH组和MCT组大鼠的RVSP和RVMI均明显高于CON组(Fig 1),这表明CH和MCT均可致大鼠的右心室内压增高,肺动脉阻力增高;右心室肥大,右心室重构。
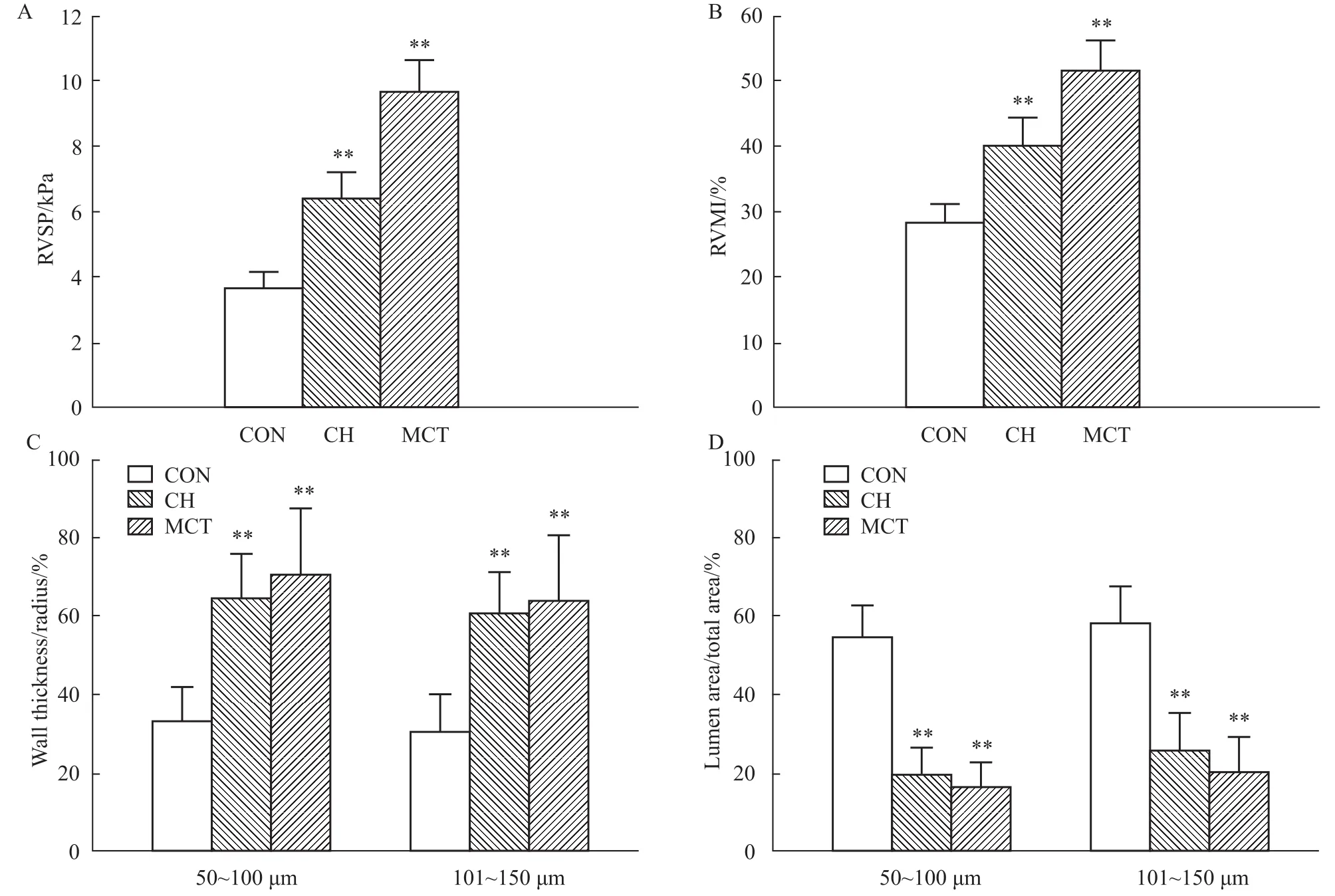
Fig 1 Change of RVSP(A),RVMI(B),and PAs morphology(C and D)of control,CH-and MCT-treated rats
2.1.2肺动脉形态学的改变 与CON组相比(Fig 1):CH组和MCT组大鼠肺动脉的管腔面积与总面积的百分比均明显减小;管壁厚度与动脉半径的百分比则均明显升高。以上结果表明,CH和MCT均可致大鼠的肺内动脉平滑肌增生,血管重构。
2.2三七皂苷R1对CPA诱导大鼠PASMCs胞膜Ca2+内流的作用 用Mn2+淬灭技术观察10 μmol ·L-1CPA的无钙Tyrode液(含0.1 mmol·L-1EGTA和3 μmol·L-1Nif)作用PASMCs 15 min后的胞膜Ca2+(Mn2+代替Ca2+)内流即SOCE的变化[10]。结果显示(Fig 2):CH组和MCT组大鼠CPA诱导PASMCs胞膜Ca2+内流速率均明显高于正常组大鼠[500 s的ΔFluorescence值:CON组=(-41.7±9.5)%,n=10;CH组=(-53.4± 10.5)%,n=10,P<0.01;MCT组=(-70.3± 7.0)%,n=10,P<0.01。Mn2+最大淬灭率:CON组=(-1.34±0.40)%·s-1,n=10;CH组=(-2.61±0.88)%·s-1,n=10,P<0.01;MCT组=(-3.51±1.56)%·s-1,n=10,P<0.01],提示CH组和MCT组大鼠PASMCs的SOCE功能增强。10 μmol·L-1三七皂苷R1预处理均可明显抑制CH组和MCT组大鼠CPA诱导PASMCs胞膜Ca2+内流速率[500 s的ΔFluorescence值:CON组=(-31.1±7.5)%,n=10,P<0.05;CH组=(-38.2±8.2)%,n=10,P<0.01;MCT组=(-50.4 ±8.3)%,n=9,P<0.01;Mn2+最大淬灭率:CON组=(-0.86±0.36)%·s-1,n=10,P<0.01;CH组=(-1.75±0.42)%·s-1,n=10,P<0.01;MCT组=(-1.64±0.51)%·s-1,n=9,P<0.01]。这提示三七皂苷R1均可抑制CH组及MCT组大鼠PASMCs的SOCE功能。
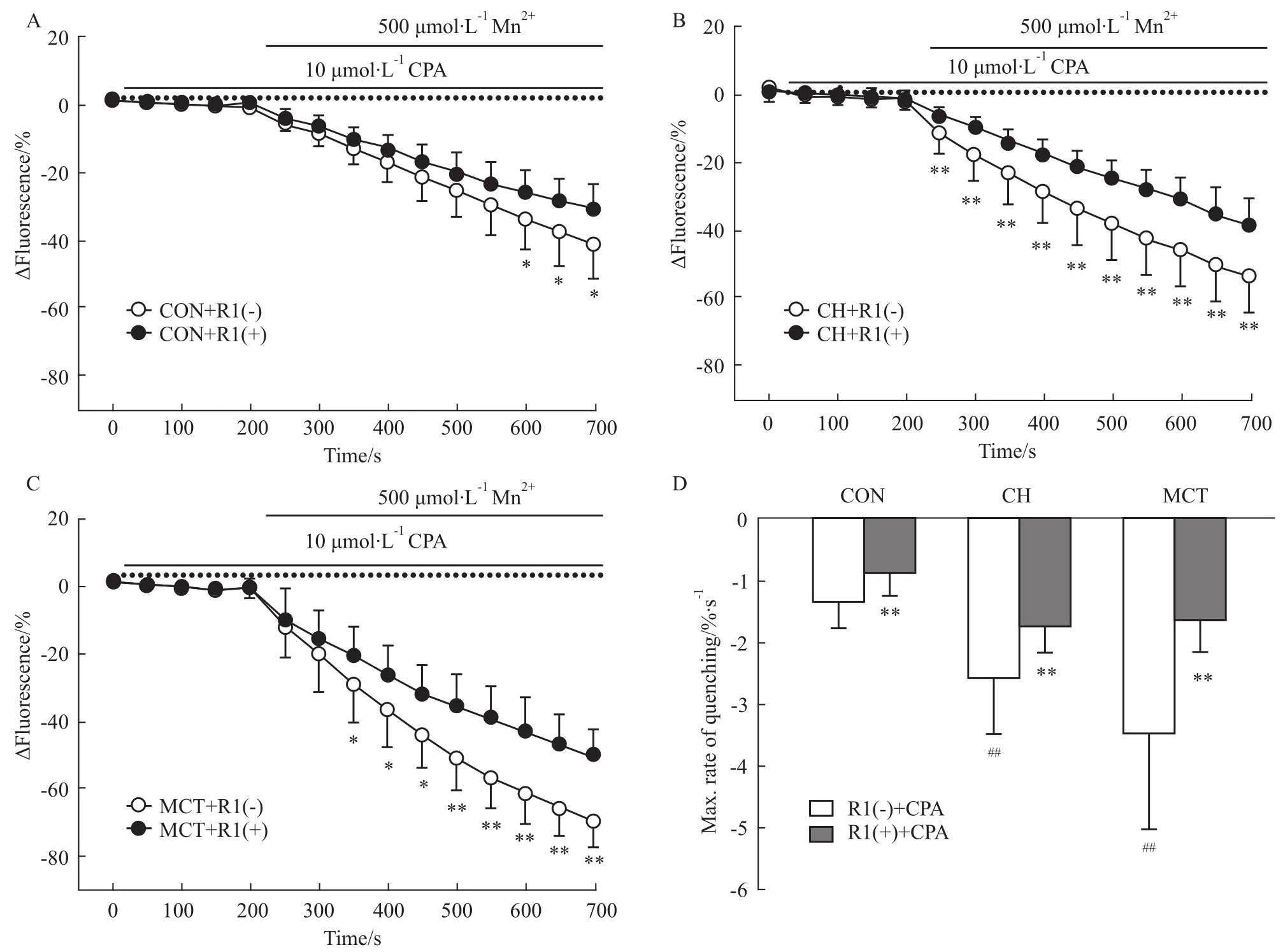
Fig 2 Effect of notoginsenoside R1 on CPA-induced Ca2+entry by Mn2+quenching in PASMCs of control,CH-and MCT-treated rats
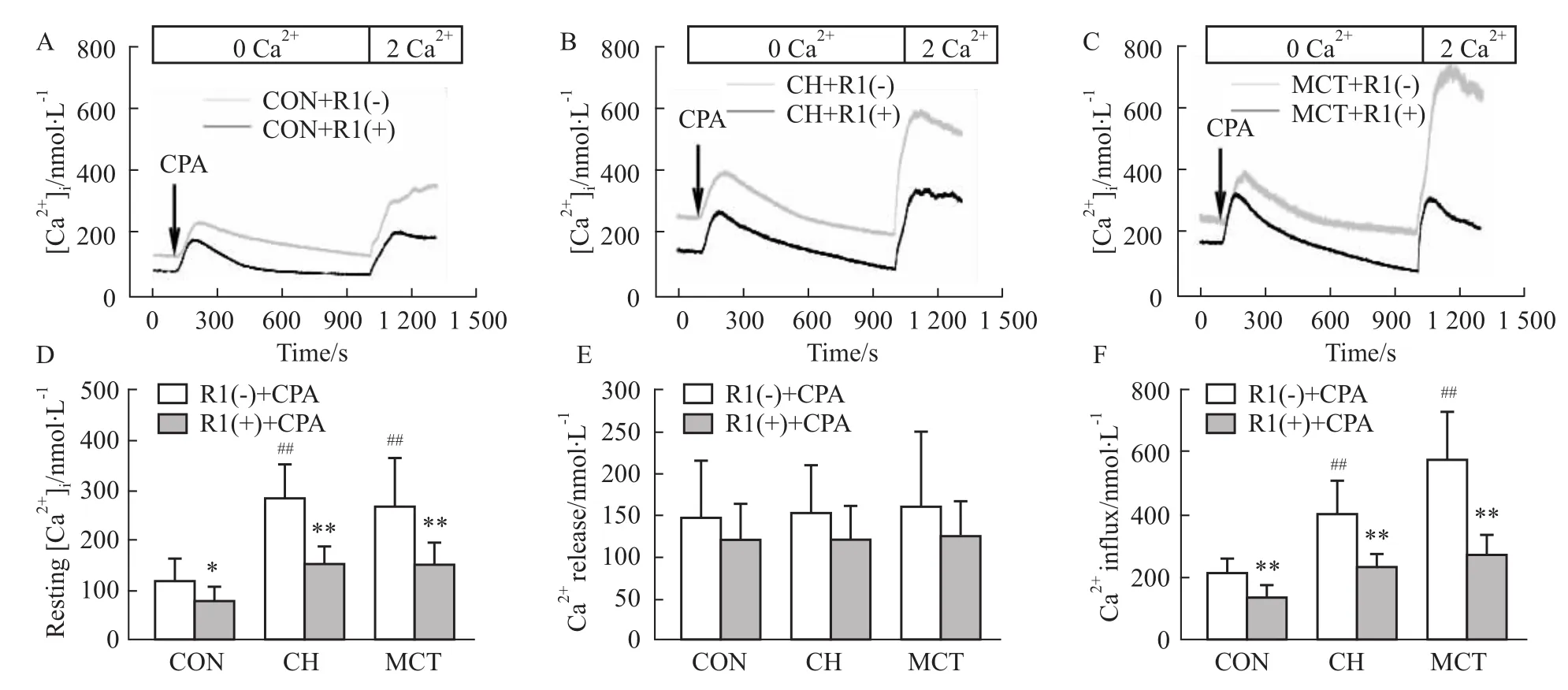
Fig 3 Effect of notoginsenoside R1 on CPA-induced Ca2+transients in PASMCs of control,CH-and MCT-treated rats
2.3三七皂苷R1对CPA诱导大鼠PASMCs [Ca2+]i变化的作用 10 μmol·L-1CPA的无钙Tyrode液(含0.1 mmol·L-1EGTA和3 μmol·L-1Nif)作用PASMCs 15 min,随后加入Ca2+(2 mmol· L-1)观察Ca2+内流引起[Ca2+]i的升高即SOCE的变化[10]。结果显示(Fig 3):相比CON组,CH组和MCT组大鼠的静息[Ca2+]i明显增高[静息[Ca2+]i:CON组=(119.9±43.5)nmol·L-1,n =8;CH组=(285.6±72.5)nmol·L-1,n=9,P <0.01;MCT组=(271.2±94.6)nmol·L-1,n=8,P<0.01)];CH组和MCT组大鼠的CPA诱导
Ca2+内流量也明显增高[Ca2+内流:CON组=(213.2±49.1)nmol·L-1,n=8;CH组=(406.1 ±103.5)nmol·L-1,n=9,P<0.01;MCT组=(581.1±147.5)nmol·L-1,n=8,P<0.01];但CH组和MCT组大鼠的CPA诱导Ca2+释放量无明显变化。这也说明CH组和MCT组大鼠PASMCs 对CPA的高反应性,从另一方面进一步提示MCT组大鼠PASMCs SOCE功能增强。10 μmol·L-1三七皂苷R1预处理可明显降低CH组和MCT组大鼠PASMCs静息[Ca2+]i静息[Ca2+]i:CON组=(75.9±31.1)nmol·L-1,n=9,P<0.05;CH组=(151.6±34.0)nmol·L-1,n=9,P<0.01;MCT组=(149.9±45.2)nmol·L-1,n=8,P<0.01]和抑制CPA诱导Ca2+内流量[Ca2+内流:CON组=(139.6±34.9)nmol·L-1,n=9,P<0.01;CH组=(231.1±45.5)nmol·L-1,n=9,P<0.01;MCT组=(267.1±66.7)nmol·L-1,n=8,P<0.01];但对CPA诱导Ca2+释放量也无变化。这从另一方面进一步证实三七皂苷R1可抑制CH组和MCT组大鼠PASMCs的SOCE功能。
3 讨论
PH是指由不同发病机制引起的肺动脉压力增高所表现的疾病状态,可导致右心室肥厚,最终引起右心衰竭而死亡。PH属于进展性疾病,严重威胁人类健康,迄今尚缺乏有效的治疗手段。2013年第五次全球PH会议将PH重新分为以下5类[1]:①肺动脉高压(pulmonary arterial hypertension,PAH),如特发性PAH和药物和毒素引起PAH等;②左心疾病相关的PH;③与肺部疾病或低氧有关的PH;④慢性血栓栓塞性PH;⑤其他各种原因所造成的PH。本研究采用CH或MCT诱发PH模型分别代表第三类和第一类的PH。研究发现两种造模大鼠RVSP、RVMI和肺动脉管壁厚度与动脉半径的的百分比均明显升高,而肺动脉管腔面积与总面积百分比均明显减小,说明CH或MCT均可致大鼠肺内动脉平滑肌增生、血管重构、肺动脉阻力增高,右心室内压增高导致右心室肥大和重构。这些结果表明CH或MCT诱发的PH大鼠模型均成功建立。
虽然不同类型的PH的发病机制各不相同,但它们都具有血管基础张力和血管反应性增加、血管平滑肌增生和血管重构等肺血管功能异常的共同特点,说明它们在疾病发展过程中可能存在着某些共同的信号通路。目前研究表明,[Ca2+]i水平的增加在PH形成和血管重构等过程中起重要作用[3]。SOCE是肺动脉平滑肌中一个很重要钙内流通路,由Ca2+池耗竭而激活[11]。先前的研究发现:特发性PAH患者PASMCs的SOCE增强[4];CH致PH大鼠中,SOCE增强,PASMCs静息[Ca2+]i水平上升和肺动脉紧张度增加[5],并在CHPH发生发展过程中起关键作用[6];MCT诱发PH大鼠中,SOCE增强,且SOCE在ET-1高血管反应性中起重要作用[7]。这说明[Ca2+]i增加和SOCE通路是不同PH发病机制中的共同通路。
三七总皂苷是人参属中药三七的主要有效活性成分。三七皂苷R1是三七总皂苷的主要活性成分之一,具有抗炎、抗氧化应激、抗凋亡等药理作用,可用于心血管系统疾病的治疗[12-13]。我们研究发现,人参属的人参皂苷Rb1抑制SOCE,降低正常和肺高压大鼠肺动脉对血管激动剂的收缩作用[14]。相同的是,有研究发现三七皂苷R1具有减轻低氧和高碳酸血症诱导游离大鼠肺动脉环收缩的作用[7]。我们先前研究也发现三七皂苷R1可能通过抑制SOCE,降低肺高压模型大鼠肺动脉对血管激动剂的收缩作用[8]。然而,三七皂苷R1对CH及MCT致PH模型大鼠PASMCs SOCE的作用,目前尚不清楚。
为明确三七皂苷R1对PASMCs SOCE的作用,本研究采用SOCE特异性激活剂CPA。CPA是内质网Ca2+泵抑制剂,通过抑制Ca2+泵,将Ca2+泵入内质网,引起内质网Ca2+释放所致的瞬时胞内Ca2+浓度升高,然后随着内质网Ca2+的耗竭,特异性激活SOCE。通过Mn2+淬灭Fura-2荧光实验,在Nif预处理情况下,本研究发现三七皂苷R1可明显抑制CH组和MCT组大鼠CPA诱导PASMCs胞膜Ca2+内流速率,提示三七皂苷R1可抑制CH组及MCT组大鼠PASMCs的SOCE功能。通过另一种观察SOCE的方法Fluo-3荧光检测[Ca2+]i[10],在Nif预处理情况下,本研究发现三七皂苷R1可明显降低CH及MCT致PH大鼠PASMCs静息[Ca2+]i和抑制CPA诱导Ca2+内流,从另一方面进一步证实三七皂苷R1可抑制CH组及MCT组大鼠PASMCs的SOCE功能,这可能是三七皂苷R1降低CH及MCT 致PH大鼠PASMCs静息[Ca2+]i的主要因素。
总之,三七皂苷R1具有抑制CH和MCT致PH大鼠PASMCs SOCE和降低静息[Ca2+]i的作用,而[Ca2+]i增加和SOCE通路是不同PH发病机制中的共同通路,因此三七皂苷R1对PH的临床治疗前景可观。
参考文献:
[1] Simonneau G,Gatzoulis M A,Adatia I,et al.Updated clinical classification of pulmonary hypertension[J].J Am Coll Cardiol,2013,62(25 Suppl):D34-41.
[2] Humbert M,Sitbon O,Simonneau G.Treatment of pulmonary ar-terial hypertension[J].N Engl J Med,2004,351(14):1425-36.
[3] Yamamura A,Yamamura H,Yuan J X.Enhanced Ca2+-sensing receptor function in pulmonary hypertension[J].Yakugaku Zasshi,2013,133(12):1351-9.
[4] Song M Y,Makino A,Yuan J X.Stim2 contributes to enhanced store-operated Ca2+entry in pulmonary artery smooth muscle cells from patients with idiopathic pulmonary arterial hypertension[J].Pulm Circ,2011,1(1):84-94.
[5] Lin M J,Leung G P,Zhang W M,et al.Chronic hypoxia-induced upregulation of store-operated and receptor-operated Ca2+chan-nels in pulmonary arterial smooth muscle cells:a novel mechanism of hypoxic pulmonary hypertension[J].Circ Res,2004,95(5):496-505.
[6] 穆云萍,焦海霞,朱壮丽,等.慢性低氧大鼠TRPC1表达与肺动脉收缩变化时间曲线关系[J].中国药理学通报,2014,30 (12):1667-71.
[6] Mu Y P,Jiao H X,Zhu Z L,et al.Relationship of time-course curve between the expression of TRPC1 and vascular tone of pul-monary arteries in chronic hypoxia pulmonary hypertension rats [J].Chin Pharmacol Bull,2014,30(12):1667-71.
[7] Liu X R,Zhang M F,Yang N,et al.Enhanced store-operated Ca2+entry and TRPC channel expression in pulmonary arteries of monocrotaline-induced pulmonary hypertensive rats[J].Am J Physiol Cell Physiol,2012,302(1):C77-87.
[8] Xu Y,Lin L,Tang L,et al.Notoginsenoside R1 attenuates hypoxia and hypercapnia-induced vasoconstriction in isolated rat pulmonary arterial rings by reducing the expression of ERK[J].Am J Chin Med,2014,42(4):799-816.
[9] 胡 莹,焦海霞,王瑞幸,等.三七皂苷R1对肺高压大鼠模型肺动脉的舒张作用[J].中国药理学通报,2013,29(11):1572 -6.
[9] Hu Y,Jiao H X,Wang R X,et al.Vasodilation of notoginsenoside R1 on pulmonary arteries of pulmonary hypertensive rats[J].Chin Pharmacol Bull,2013,29(11):1572-6.
[10]Peng G,Ran P,Lu W,et al.Acute hypoxia activates store-operated Ca2+entry and increases intracellular Ca2+concentration in rat distal pulmonary venous smooth muscle cells[J].J Thorac Dis,2013,5(5):605-12.
[11]Cheng K T,Ong H L,Liu X,et al.Contribution and regulation of TRPC channels in store-operated Ca2+entry[J].Curr Top Mem-br,2013,71:149-79.
[12]Jia C,Xiong M,Wang P,et al.Notoginsenoside R1 attenuates ath-erosclerotic lesions in ApoE deficient mouse model[J].PLoS One,2014,9(6):e99849.
[13]Sun B,Xiao J,Sun X B,et al.Notoginsenoside R1 attenuates car-diac dysfunction in endotoxemic mice:an insight into oestrogen receptor activation and PI3K/Akt signalling[J].Br J Pharmacol,2013,168(7):1758-70.
[14]Wang R X,He R L,Jiao H X,et al.Ginsenoside Rb1 attenuates agonist-induced contractile response via inhibition of store-opera-ted calcium entry in pulmonary arteries of normal and pulmonary hypertensive rats[J].Cell Physiol Biochem,2015,35(4):1467-81.
Inhibition of notoginsenoside R1 on SOCE in pulmonary arterial smooth muscle cells of pulmonary hypertension rats
WANG Rui-xing,DAI Mao,MU Yun-ping,JIANG Jiao,HUANG Qiu-hong,WU Zhi-juan,JIAO Hai-xia,LIN Mo-jun
(Dept of Physiology and Pathophysiology,Laboratory of Cardiovascular Science,Fujian Medical University,Fuzhou 350108,China)
Abstract:Aim To evaluate the effects of notoginsen-oside R1 on store-operated calcium entry(SOCE)in pulmonary arterial smooth muscle cells(PASMCs)of chronic hypoxia(CH)-and monocrotaline(MCT)-in-duced pulmonary hypertension(PH)rats.Methods Mn2+quenching of Fura-2 and measurement of intra-cellular free calcium concentration([Ca2+]i)using fluo-3 were examined in PASMCs of CH-exposed and MCT-treated rats.Results ①CH-exposed and MCT-treated rats exhibited profound PH when examined 3 weeks after hypoxia exposure or MCT injection,respec-tively.②In the presence of 3 μmol·L-1nifedipine,10 μmol·L-1notoginsenoside R1 significantly re-duced cyclopiazonic acid(CPA)-induced the percent reduction in Fura-2 fluorescence measured 500 sec af-ter application of Mn2+,the maximal rate of Mn2+quenching,the amplitude of the Ca2+influx transient and the resting[Ca2+]iin PASMCs of CH-exposed and MCT-treated rats.Conclusion Notoginsenoside R1 inhibits SOCE and reduces resting[Ca2+]iin PASMCs of CH-and MCT-induced PH rats.
Key words:pulmonary hypertension;chronic hypoxia;monocrotaline;notoginsenoside R1;store-operated cal-cium entry;pulmonary arterial smooth muscle cell
作者简介:王瑞幸(1976-),男,博士,讲师,研究方向:肺高压致病机制,E-mail:wrx530@163.com;戴 耄(1989-),男,硕士,研究方向:肺高压致病机制,并列第一作者,E-mail:daimao890629@163.com;林默君(1964-),男,博士,教授,研究方向:肺高压致病机制,通讯作者,Tel:0591-22862429,E-mail:mjlin@mail.fjmu.edu.cn
基金项目:国家自然科学基金资助项目(No 31171104,31371165,81400236);福建省自然科学基金资助项目(No 2015J01313)
收稿日期:2015-06-18,修回日期:2015-07-06
文献标志码:A
文章编号:1001-1978(2015)10-1463-06
doi:10.3969/j.issn.1001-1978.2015.10.027
