电离辐射对人脑胶质瘤细胞中Ataxin-1基因表达的影响
2015-02-24徐恩赐戴科军
徐恩赐, 戴科军, 欧 瑶, 汤 华
(江苏省常州市肿瘤医院 肿瘤放射治疗科, 江苏 常州, 213000)
电离辐射对人脑胶质瘤细胞中Ataxin-1基因表达的影响
徐恩赐, 戴科军, 欧瑶, 汤华
(江苏省常州市肿瘤医院 肿瘤放射治疗科, 江苏 常州, 213000)
摘要:目的探讨电离辐射对人脑胶质瘤细胞株U251、U87中Ataxin-1基因表达的影响。方法采用Western blot实验检测脑胶质瘤细胞株中A172、U251、U373、U87中Ataxin-1表达水平的差异,选取U251、U87为研究对象, 采用RT-PCR和Western blot法检测各组Ataxin-1mRNA及蛋白表达水平的变化。结果4种脑胶质瘤细胞中Ataxin-1的表达水平存在明显差异; U251、U87在不同剂量的X射线照射后24 h,其Ataxin-1蛋白及mRNA表达量与对照组相比均明显增加(P<0.05); 不同时间检测提示,在X射线照射后4 h,Ataxin-1蛋白及mRNA的表达量即开始上升,并持续到照射后48 h (P<0.05)。结论Ataxin-1在不同脑胶质瘤细胞中表达水平存在明显差异; Ataxin-1基因有可能作为临床脑胶质瘤放疗靶基因,对临床放疗疗效的判断具有一定的应用潜力。
关键词:Ataxin-1; 脑胶质瘤; 影响
Ataxin-1蛋白是Ⅰ型脊髓小脑共济失调(SCA1)的基因编码产物,主要在神经元核内表达,浦肯野氏细胞胞浆内也可以检测到,而在外周组织的胞浆中也有着广泛的表达[1]。根据SCA1基因中CAG序列重复次数不同,分别表达野生型及突变型Ataxin-1。突变型的Ataxin-1与神经元内正常蛋白相互作用并在细胞核内沉积形成核内包涵体,产生神经损害症状[2-3]。大多数肿瘤相关蛋白可以与核仁包涵体结合,并且核仁包涵体已经在非神经元细胞中被鉴定出来[4]。聚集体(核仁包涵体与胞浆包涵体均属于聚集体的一种)的形成不仅与许多疾病密切相关, 如阿尔海默氏症, 帕金森氏症等[5],而且聚集体的形成和破坏与肿瘤细胞的凋亡密切相关[6]。Huda Zoghbi等[7]发现正常的和突变形式的Ataxin-1在SCA1中都具有一定程度上类似的功能,但突变形式更加有效,而在神经元细胞内,正常蛋白的水平过高时也会导致一些异常神经元功能的产生,不过相关的机制尚未明确。在组织细胞中广泛表达的野生型Ataxin-1也可能通过一些途径与肿瘤相关因子作用,继而产生一些生物效应。
本实验研究通过Western blot实验检测脑胶质瘤细胞株中A172、U251、U373、U87中Ataxin-1蛋白的表达水平,并将电离辐射与脑胶质瘤细胞株内Ataxin-1表达水平联系起来,探讨电离辐射对人脑胶质瘤细胞株中Ataxin-1表达水平的影响,对进一步研究Ataxin-1基因对放射敏感性的影响有重要指导意义。
1材料与方法
1.1 实验材料
人脑胶质瘤细胞系A172、U251、U373、U87,均由原苏州大学长江学者实验室惠赠,购自美国细胞收藏中心(ATCC),由该实验室培养和保藏。RPMI 1640细胞培养基、0.25%胰酶、胎牛血清、反转录试剂盒购自美国Invitrogen公司。Western blot实验抗Ataxin-1单克隆抗体、辣根过氧化物酶(HRP)标记羊抗鼠IgG均购自美国Santa Cruz公司。化学发光显色试剂盒购自联科生物公司。PCR引物采用Premier Primer 5.0软件设计,由美国Invitrogen公司合成。PCR反应试剂盒购自美国Promega公司实验所需其余试剂均购自上海生物工程技术有限公司。
1.2 实验分组
X射线对Ataxin-1表达水平的影响,按吸收剂量1、3、5和8 Gy,共4个剂量组,3 Gy组再以照射后4、16、24、28 h分4个时间组,上述实验中均设立未处理对照组。
1.3 细胞培养及照射
人脑胶质瘤细胞系A172、U87、U251、U373培养于含10%胎牛血清、1%谷氨酰胺、1%非必需氨基酸及100万 U/L青霉素和链霉素的RPMI 1 640培养基中。细胞置于体积分数5%CO2、37 ℃培养箱内培养,每2~3 d传代1次。细胞置于直线加速器下,射线性质为高能6 MV X射线,照射野为20 cm×20 cm, 源皮距为100 cm,吸收剂量率为2 Gy/min。
1.4 Western blot实验
收集细胞,免疫沉淀裂解液裂解细胞,离心收集蛋白样品,BCA法测定蛋白浓度。每组样品取50 μg总蛋白采用10% SDS-PAGE分离,以5%脱脂奶粉进行非特异性抗原的封闭,加入特异性一抗溶液室温作用1 h,0.1% 吐温20 PBS洗涤后与HRP偶联的二抗溶液室温作用1 h,洗涤后采用化学发光显色试剂盒进行曝光。同一张膜测定β-肌动蛋白作为样品内参。通过quantity one图像分析软件对各条带灰度进行检测,以内参β-actin的灰度为标准,各组蛋白的灰度值与之相比。
1.5 RT-PCR法
收集细胞,按Trizol试剂盒说明书提取总RNA,用DEPC水溶解RNA,紫外分光光度计分别测定RNA纯度(A260/A280>1.80)。各取总RNA 5 μg,采用反转录试剂盒进行第1链cDNA合成(详见反转录试剂盒参考说明)。采用premier primer 5软件设计引物,Ataxin-1上游引物5′-GGA GGTCCTGAACGGTGAGATGG-3′,下游引物为5′-TTTGGAACACGGCAAATCAAGAG-3′,扩增产物为1063 bp。GADPH上游引物为5′-CAACTACATGGTCTACATGTTCC-3′, 下游引物为5′-CAACCTGGTCCTCAGTGTAG-3′,扩增产物为700 bp。反应产物经1%琼脂糖凝胶电泳,在凝胶成像仪上观察、拍照。通过quantity one图像分析软件对各条带灰度进行检测,以内参GAPDH的灰度为标准,各组mRNA的灰度值与之相比。
1.6 统计学处理
以上所有实验均重复3次以上,结果以均数±标准差表示。采用SPSS 17.0统计软件进行统计学分析,组间比较采用2个独立样本的t检验和单因素方差分析,以P<0.05为差异有统计学意义。
2结果
2.1 不同脑胶质瘤细胞株中Ataxin-1表达水平的差异
取对数生长期肿瘤细胞,收取蛋白,采用Western blot法以β-actin为内参,检测不同胶质瘤细胞株内Ataxin-1蛋白表达水平。并通过quantity one图像分析软件对各条带灰度进行检测,以各自β-actin条带的灰度为标准,计算各组的Ataxin-1条带灰度值与之的比值。A172脑胶质瘤细胞株中Ataxin-1的表达水平为(0.741±0.043), U87为(0.185±0.012), U251为(0.926±0.164),U373为(0.185±0.047)。
2.2 不同剂量电离辐射对肿瘤细胞内Ataxin-1表达水平
选取脑胶质瘤中Ataxin-1表达较高的U251和表达较低的U87,用RT-PCR和Western blot法检测Ataxin-1蛋白和mRNA在不同剂量的电离辐射照射24 h后表达水平的变化。照射不同剂量的X射线后Ataxin-1mRNA和蛋白表达与对照组相比,从受照3 Gy开始均明显增加(P<0.05)。见表1、2。

表1 不同剂量电离辐射照射后Ataxin-1
与0 Gy相比,*P<0.05。
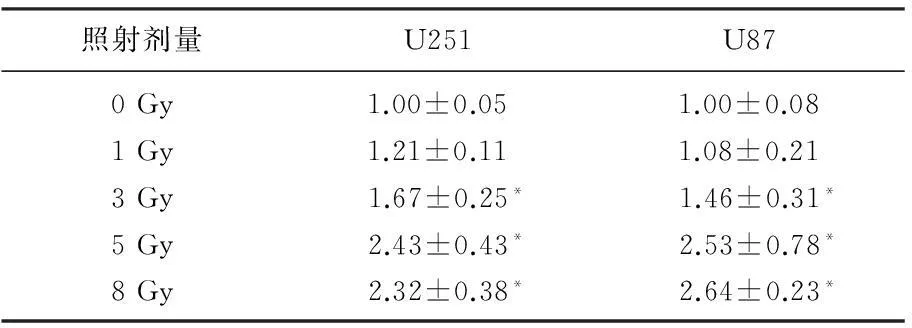
表2 不同剂量电离辐射照射后Ataxin-1 mRNA
与0 Gy相比,*P<0.05。
2.3 电离辐射后不同时间Ataxin-1表达水平的变化
用RT-PCR和Western blot法检测电离辐射(3 Gy)照射后不同时间Ataxin-1蛋白和mRNA表达水平的变化。3 Gy的X射线照射4 h后Ataxin-1 mRNA和蛋白的表达水平开始增加,照射48 h后仍保持较高的表达水平(P<0.05)。见表3、4。
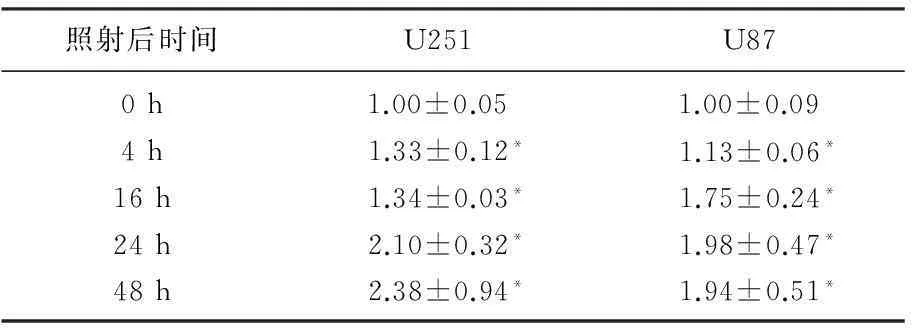
表3 电离辐射照射后不同时间点Ataxin-1
与0 h相比,*P<0.05。

表4 电离辐射照射后不同时间点Ataxin-1 mRNA
与0 h相比,*P<0.05。
3讨论
SCA1基因位于染色体6p22-23, 基因组跨度450Kb,cDNA长11Kb,含9个外显子。SCA1基因外显子中含有CAG(编码谷氨酸)重复序列,正常人的重复次数为6-38,可表达野生型Ataxin-1蛋白,含792-830个氨基酸残基,估计分子量约为87 kDa, 其中含有一段由(CAG)n编码的多聚谷氨酰胺链;CAG序列重复次数增多为40-83时,表达异常的突变型Ataxin-1蛋白。
核仁内含物在聚集泛素和很多泛素蛋白酶体系统的成分与靶点上,包括肿瘤相关转录因子和细胞周期调节因子以及神经退行性疾病涉及的一些蛋白(如Ataxin-1等),类似于胞浆的aggresomes-胞浆包涵体,这被称为“核仁aggresomes”即核仁包涵体[4]。编码谷氨酰胺的三核苷酸n重复序列异常扩增导致过度拷贝的多聚谷氨酰胺链(PolyQ)形成,致使含有多聚谷氨酰胺链的突变型Ataxin-1蛋白与神经元内正常蛋白相互作用并在细胞核内沉积形成核仁包涵体,产生神经损害症状[2-3], 这种作用随CAG数目增加而增强。而野生型Ataxin-1则通常被认为与SCA1的发病无关,但Huda Zoghbi[7]研究发现,将携带80个重复的异常的Ataxin-1蛋白引入小鼠,从而造成了浦肯野细胞发生了退化并导致小鼠发生共济失调,当将携带30个重复的大量正常蛋白引入小鼠还能导致异常的神经元功能。这意味着正常的和突变形式的Ataxin-1都具有一定程度上类似的功能,但突变形式更加有效,而在神经元细胞内,正常蛋白的水平过高时也会变成毒素。
本实验发现Ataxin-1在神经系统的脑胶质瘤细胞中有着不同水平的表达,以U251、A172为高,U87表达稍低,U373最低,不同细胞株中表达水平存在明显差异。通过Western blot及PCR法发现,脑胶质瘤细胞株U251、U87,在受到不同
梯度辐射剂量处理后,Ataxin-1蛋白及mRNA表达水平随着剂量的增加而增加,在3 Gy时开始有明显变化。随后采用6MV-X射线照射U251、U87细胞株3 Gy, 并检测照射后0、4、16、24、48 h时的蛋白及mRNA表达量,发现Ataxin-1蛋白及mRNA表达量在照射后4~16 h开始升高,并持续到24 h, 24 h到48 h保持较高的表达水平。以上结果说明Ataxin-1的表达与辐射剂量相关,一定范围内辐射剂量的增加可以诱导其表达的升高,且在电离辐射后4~16 h内即激活启动子,开始大量表达。Ataxin-1呈现出一些放射损伤反应基因的特点,在电离辐射后表达水平产生变化,且与剂量相关。
参考文献
[1]Servadio A, Koshy B, Armstrong D, et al. Expression analysis of the ataxin-1 protein in tissues from normal and spinocerebellar ataxia type 1 individuals [J]. Nat Genet, 1995, 10(1): 94.
[2]Klement I A, Skinner P J, Kaytor M D, et al. Ataxin-1 nuclear localization and aggregation: role in polyglutamine-induced disease in SCA1 transgenic mice[J]. Cell, 1998, 95(1): 41.
[3]Saud F, Flinkbeiner S, Devys D, et al. Huntingtin acts in the nucleus to induce apoptosis but death does net correlate with the formation of intranuc lear inclusions[J]. Cell, 1998: 95.
[4]Leena Latonen. Nucleolar aggresomes as counterparts of cytoplasmic aggresomes in proteotoxic stress. Proteasome inhibitors induce nuclear ribonucleoprotein inclusions that accumulate several key factors of neurodegenerative diseases and cancer[J]. Bioessays, 2011, 33(5): 386.
[5]Zaarur N, Meriin A B, Gabai V L, et al. Triggering aggresome formation.Dissecting aggresome-targeting and aggregation signals in synphilin 1 [J]. J Biol Chem, 2008, 283: 27575.
[6]Catley L, Weisberg E, Kiziltepe T, et al. Aggresome induction by proteasome inhibitor bortezomib and alpha-tubulin hyperacetylation by tubulin deacetylase (TDAC) inhibitor LBH 589 are synergistic in myeloma cells[J]. Blood, 2006. 108: 3441.
[7]Hiroshi Tsuda, Hamed Jafar-Nejad, Akash J-Patel, et al. The AXH Domain of Ataxin-1 Mediates Neurodegeneration through Its Interaction with Gfi-1/Senseless Proteins[J]. Cell, 200, 122(4): 633.
Influence of ionizing radiation on the expression of Ataxin-1 in human glioma cancer cell lines
XU Enci, DAI Kejun, OU Yao, TANG Hua
(DepartmentofTumorRadiotherapy,ChangzhouTumorHospital,Changzhou,Jiangsu, 213000)
ABSTRACT:ObjectiveTo explore the influence of ionizing radiation on the expression of Ataxin-1 in U251 and U87 of human glioma cancer cells lines. MethodsDifferences of Ataxin-1 expression in A172, U251, U373, U87 of human glioma cancer cells lines were detected by Western blot, and U251, U87 were selected as research object. Changes of Ataxin-1mRNAand protein level were detected by RT-PCR and western blot. ResultsThe different kinds of glioma cancer cells had different levels of the Ataxin-1 expression. The expression level of Ataxin-1 significantly increased in both mRNA (P<0.05). For time-dependent induction of Ataxin-1, the expression significantly increased 4 hours after exposed to X-rays (P<0.05). Conclusion The expression level of Ataxin-1 is significantly different in 4 kinds of glioma cancer cells. Ionizing radiation can up-regulate the expression of Ataxin-1 in glioma cancer cells in both mRNA and protein levels. Ataxin-1 may be a molecular target for radiotherapy in glioma cancer,and may have a potential value to evaluate the curative effects of radiotherapy.
KEYWORDS:Ataxin-1; glioma cancer; influence
通信作者:汤华
收稿日期:2015-07-01
中图分类号:R 739.41
文献标志码:A
文章编号:1672-2353(2015)21-070-03DOI: 10.7619/jcmp.201521019
