体外膜肺氧合支持治疗期间机体凝血功能的动态变化
2015-02-24高国栋胡金晓黑飞龙
高国栋, 龙 村, 胡 强, 胡金晓, 袁 媛, 黑飞龙, 于 坤
(中国医学科学院阜外心血管病医院 体外循环科, 北京, 100037)
体外膜肺氧合支持治疗期间机体凝血功能的动态变化
高国栋, 龙村, 胡强, 胡金晓, 袁媛, 黑飞龙, 于坤
(中国医学科学院阜外心血管病医院 体外循环科, 北京, 100037)
摘要:目的观察成人体外膜肺氧合(ECMO)支持治疗期间凝血指标的动态变化。方法42例成人心脏术后ECMO支持患者,于ECMO建立时,建立24 h及撤机前检测血小板计数。分别在ECMO建立前,ECMO建立1、6、24、48、72 h及撤机前测定全血激活凝血时间(ACT)、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)及纤维蛋白原(FIB)等指标。按发生院内死亡将患者分为存活组与死亡组,比较2组各时点上述指标的差异。结果血小板计数在ECMO期间明显下降(P<0.05)。PT、APTT与ECMO前相比均明显延长(P<0.05), 纤维蛋白原在ECMO建立后一过性降低, 6 h后逐渐升高,撤机前达峰值。结论ECMO支持治疗期间通过激活内外源性凝血途径,导致凝血功能紊乱。
关键词:体外膜肺氧合; 凝血; 血小板
体外膜肺氧合(ECMO)支持治疗技术是对严重心肺功能衰竭患者的有效治疗手段,近几年发展迅速,但仍存在较多问题,其中凝血障碍等相关并发症高发,严重影响着患者的治疗效果及预后[1-2]。ECMO过程中由于血液与非生物表面接触,血液系统不可避免出现一系列改变[3-4]。本研究拟对ECMO支持治疗期间机体凝血指标的动态变化进行观察,以期为ECMO支持期间凝血功能的临床管理提供依据。
1资料与方法
1.1 一般资料
选取2009年1月—2013年12月阜外心血管病医院42例心脏术后严重心肺功能衰竭的成人患者行ECMO支持治疗,其中男32例,女10例;年龄19~73岁。42例中11例接受心脏移植术; 10例接受CABG; 7例先天性心脏病手术; 6例接受瓣膜置换手术或成型手术; 5例接受CABG+瓣膜手术; 2例肺动脉内膜剥脱术; 1例接受心包剥脱术。平均ECMO时间为(108.7±73.7) h。42例患者中31例成功脱机, 27例存活出院。4例脱机后院内死亡,死亡的原因主要是感染及多器官功能衰竭。按发生院内死亡将患者分为死亡组和存活组,观察ECMO期间血小板计数、凝血因子等各项指标的变化。
1.2 方法
1.2.1ECMO建立及管理: ECMO设备:全套ECMO系统,包括膜式氧合器、插管、管道、接头及离心泵头均为肝素涂层(Bioline coating, maquet getinge group, Germany), 驱动系统采用MAQUET离心泵(Jostra Quadrox, Maquet cardiopulmonary AG, Germany), 在连接系统管路时串联氧饱和度及血球压积探头和静脉负压监测接头。
因所有患者均为心脏术后,所以均采用股静脉-股动脉插管方式。ECMO建立时患者麻醉镇静,运转开始后酌情降低麻醉深度。ECMO支持过程中一般ACT维持120~180 s; 流量根据患者血流动力学监测指标及血气结果来调整,辅助期间流量范围一般维持在40~80 mL/(kg·min),使静脉血氧饱和度在70%以上,动脉氧饱和度不低于95%; 呼吸机模式采用同步间歇指令通气, FiO20.3~0.6, 呼吸频率10 次/min, 潮气量8~10 mL/kg; 每天常规超声心动图检查,结合患者血流动力学指标及胸片、血气结果综合评判患者循环、呼吸功能。在保证心肺功能基本恢复并有一定的储备的情况下,逐渐减低辅助流量,直至终止ECMO。
1.2.2资料及标本采集:血小板计数标本采集时点为ECMO建立时,建立24 h及撤机前,抽取中心静脉血标本,枸橼酸钠抗凝。凝血指标采集时点分别为ECMO建立前(T1), ECMO建立1 h(T2)、6 h(T3)、24 h(T4)、48 h(T5)、72 h(T6)、撤机前(T7), 采集中心静脉血,测定各时点全血激活凝血时间(ACT)、凝血酶原时间(PT)、活化部分凝血酶原时间(APTT)及纤维蛋白原(FIB)等指标及记录各时点肝素用量。
1.2.3试剂和仪器:在阜外心血管病医院临床检验中心对血常规和凝血因子检测。凝血因子检测仪器及试剂为美国Beckman Coulter公司ADVANCE全自动血凝仪及其配套试剂, PT、APTT检测原理为一期法, FIB检测原理为PT衍算法。血常规检测采用日本Sysmex XE21000血细胞分析仪及其配套试剂。
1.3 统计学处理
采用SPSS 16.0统计软件进行统计处理,计量资料采用均数±标准差表示。相关数据资料先行方差齐性分析,再采用独立样本t检验;组内比较采用配对的t检验。所有检验均选择双尾检验,P<0.05为差异有统计学意义。
2结果
2.1 ECMO期间血小板变化情况
2组患者血小板计数于ECMO建立后均进行性下降,与ECMO建立时血小板计数比较,差异均有统计学意义(P<0.05), 组间比较各时点血小板计数无显著差异。见表1。
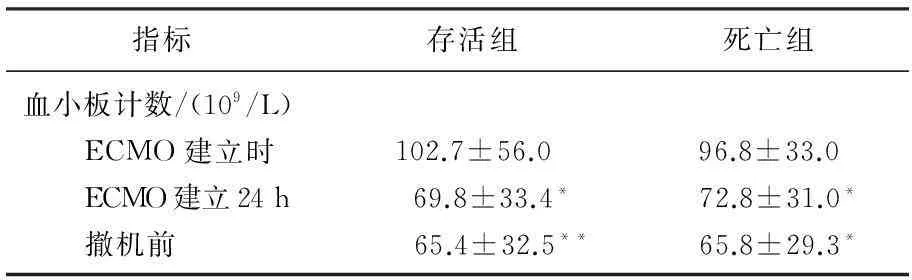
表1 ECMO期间血小板变化
与ECMO建立时比较,*P<0.05,**P<0.01。
2.2 凝血指标变化情况
2组ECMO前ACT值均较高,ECMO建立后ACT值逐渐下降,至辅助24~48 h稳定在140~160 s, 撤机前ACT再度上升。ECMO期间肝素用量进行性增高,组内比较差异有统计学意义(P<0.05)。PT和APTT在ECMO建立后迅速上升,与ECMO前相比均明显延长(P<0.05), 于ECMO建立1 h达到峰值,之后逐渐下降,撤机前再度升高。纤维蛋白原(FIB)含量于ECMO建立初较低,在ECMO建立6 h后开始逐渐进行性上升,至撤机前显著高于ECMO建立前(P<0.05); 以上各指标组间比较均无显著差异。见表2。

表2 ECMO期间凝血指标变化
ACT: 全血激活凝血时间; PT: 凝血酶原时间; APTT: 活化部分凝血酶原时间; FIB: 纤维蛋白原; 与T1比较,*P<0.05,**P<0.01。
3讨论
作为目前在世界范围内越来越受到重视的体外生命支持技术,体外膜肺氧合(ECMO)近年来发展迅速,已成为严重心肺功能衰竭病人的有效救治手段。但ECMO毕竟是一门新技术,受到材料、病情等多种因素的限制,并发症较多,其中凝血功能障碍是ECMO支持治疗过程中最重要的机体并发症之一,发生率高,影响预后。如何减少出血,预防血栓形成,成为ECMO支持治疗中面临的首要问题之一[3-8]。
本研究结果显示,ECMO建立前ACT值较高,均值大于300 s,分析原因主要是由于本组病例中部分患者因心脏手术后心肺功能障碍体外循环无法脱机,从而直接转为ECMO辅助支持。这部分患者因体外循环中全量肝素化,因此ECMO前的PT、APTT及FIB无法测定准确数值,故未对其进行统计。ECMO建立后ACT逐渐下降, 24 h降至理想水平,至撤机前轻度上升。纤维蛋白原在ECMO建立后一过性降低,主要原因与血液稀释及血液与异物表面接触纤维蛋白大量消耗有关; PT、APTT在ECMO建立后迅速上升,与ECMO前比较均明显延长,导致这些变化主要原因是ECMO预充导致的血液被稀释和手术创伤导致的凝血因子消耗。此外,ECMO建立时因血液中的肝素不能完全中和也是导致其上升的重要原因。
在ECMO中,凝血系统通过内外源性凝血途径被激活。内源性凝血途径激活主要是由于血液与生物材料接触,生物材料会选择性吸附纤维蛋白原,纤维蛋白原黏附于生物材料表面,随即发生构象改变,与血小板受体结合,激活血小板,导致血小板脱颗粒[8-9],因子Ⅻ被吸附,从而活化内源性凝血途径[10]。此外,ECMO支持患者在行机械辅助前均曾接受过心脏手术治疗,因此外源性凝血途径也被激活[11]。
文献[12-13]报道,ECMO支持过程中血小板计数会进行性下降,在本研究中也观察到这一现象。导致ECMO支持治疗过程中血小板功能障碍和的计数下降原因主要有以下几点:① ECMO过程中预充、出血等可导致血液稀释; ② 血小板的消耗,主要是由于血小板与生物材料接触被激活,底物释放,引起更多的血小板激活。同时,凝血系统激活产生血栓,也促进血小板的激活,从而导致血小板数量减少; ③ 膜肺、管道表面的生物材料虽然进行了肝素涂层,但仍不可避免具有生物的非相容性; ④ 在支持过程中,血液在管道中的血流非生物切应力造成血小板机械性破坏,从而其导致数量减少; ⑤ ECMO过程中由于膜肺氧合的需要一般吸入较高浓度的氧,导致氧化应激反应,产生过氧化氢等物质,可造成血小板的激活和损害,最后导致其数量减少。Klippenstein等在测量7例呼吸衰竭新生儿使用ECMO前后的脾脏超声时发现,在使用ECMO支持治疗后, 7例患儿脾脏体积较前均有所增大,分析原因认为血小板等血细胞成分在ECMO循环中被破坏和消耗所致。
由于血液与非生物表面接触后激活的一系列细胞成分及蛋白成分相互激活、相互促进,最后可
导致整个凝血-抗凝平衡愈来愈倾向于促凝优势发展[14-15]。本研究结果也证实了这一点,纤维蛋白原在ECMO辅助6 h后开始逐渐进行性上升,至撤机前显著高于ECMO建立前(P<0.05), 而纤维蛋白原增高提示血液的高凝状态。同时在ECMO支持治疗过程中,所需要的肝素剂量随ECMO时间的延长而进行性增加,也提示随着辅助时间的延长,血液促凝逐渐增强。因此, ECMO期间要维持一定的抗凝水平,以防血栓的形成,减少相关并发症的发生。
参考文献
[1]Pellegrino V, Hockings L E, Davies A. Veno-arterial extracorporeal membrane oxygenation for adult cardiovascular failure[J]. Curr Opin Crit Care, 2014, 20(5): 484.
[2]Abrams D, Combes A, Brodie D. Extracorporeal membrane oxygenation in cardiopulmonary disease in adults[J]. J Am Coll Cardiol, 2014, 63(25): 2769.
[3]Cheng R, Hachamovitch R, Kittleson M, et al. Complications of extracorporeal membrane oxygenation for treatment of cardiogenic shock and cardiac arrest: a meta-analysis of 1,866 adult patients[J]. Ann Thorac Surg, 2014, 97(2): 610.
[4]Zangrillo A, Landoni G, Biondi-Zoccai G, et al. A meta-analysis of complications and mortality of extracorporeal membrane oxygenation[J]. Crit Care Resusc, 2013, 15(3): 172.
[5]Doll N, Kiaii B, Borger M, et al. Five-year results of 219 consecutive patients treated with extracorporeal membrane oxygenation for refractory postoperative cardiogenic shock[J]. Ann Thorac Surg, 2004, 77: 151.
[6]高国栋, 龙村, 黑飞龙, 等. 107例体外膜肺氧合并发症回顾分析[J].心肺血管病杂志, 2010, 29(4): 296.
[7]Tweet M S, Schears G J, Cassar A, et al. Emergency cardiac support with extracorporeal membrane oxygenation for cardiac arrest[J]. Mayo Clin Proc, 2013, 88(7): 761.
[8]Bowen F W, Edmunds Jr H L. Coagulation,anticoaguhtion and the interaction of blood and artificial surfaces[A]. //Zwischenberger JB,Steinhorn RH,Bartlett RH,editors, ECMO:extracorporeal cardiopulmonary support in critical care[M]. 2nd. Ann Arbor:Mich ELSO, 2000: 67.
[9]Esper S A, Levy J H, Waters J H, et al .Extracorporeal membrane oxygenation in the adult: a review of anticoagulation monitoring and transfusion[J]. Anesth Analg, 2014, 118(4): 731.
[10]Levi M, ten Cate H, van der Poll T. Endothelium:interface between coagulation and inflammation[J]. Crit Care Med, 2002, 30(5 Supp1): s220.
[11]Mackman N. The role of the tissue factor-thrombin pathway in cardiac ischemia repefusion injury [J]. Scmin Vasc Med, 2003, 3(2): 193.
[12]Stiller B, Lemmer J, Merkle F, et al. Consumption of blood products during mechanical circulatory support in children: comparison between ECMO and a pulsatile ventricular assist device[J]. Intensive Care Med, 2004, 30(9): 1814.
[13]Pellegrino V, Hockings L E, Davies A. Veno-arterial extracorporeal membrane oxygenation for adult cardiovascular failure[J].Curr Opin Crit Care, 2014, 20: 484.
[14]Oliver W C. Anticoagulation and coagulation management for ECMO[J]. Semin Cardiothorac Vasc Anesth, 2009, 13(3): 154.
[15]Doll N, Kiaii B,Borger M, et al. Five-year results of 219 consecutive patients treated with extracorporeal membrane oxygenation for refractory postoperative cardiogenic shock[J]. Ann Thorac Surg, 2004, 77: 151.
Dynamic changes of body coagulation function
during the supportive treatmentof
extracorporeal membrane oxygenation
GAO Guodong, LONG Cun, HU Qiang, HU Jinxiao, YUAN Yuan, HEI Feilong, YU Kun
(DepartmentofExtracorporealCirculation,FuwaiCardiovascularDiseaseHospitalof
ChineseAcademyofMedicalSciences,Beijing, 100037)
ABSTRACT:ObjectiveTo observe dynamic changes of body coagulation indexes during the supportive treatment of extracorporeal membrane oxygenation (ECMO)in adults. MethodsThe platelet count of 42 cardiac surgery patients with postoperative ECMO at the beginning of ECMO, 24 hours after the establishment of ECMO and before removal were detected. The indexes in activated coagulation time (ACT), prothrombin time (PT), activated partial thromboplastin time (APTT) and fibrinogen (FIB) were also tested before the establishment of the ECMO and at the 1sthour, 6th, 24th, 48th, 72ndhours after the establishment of ECMO and before weaning of the ECMO. In addition, the patients were divided into survival group and death group according to the survival in hospital and the indexes mentioned above were compared between the two groups. ResultsDuring the ECMO support, blood platelet count declined significantly(P<0.05). The PT and APTT were significantly longer after the establishment of ECMO than before(P<0.05). FIB decreased transiently after the establishment of ECMO, increased after 6 hours, and reached the peak value before the weaning of ECMO. ConclusionCoagulation dysfunction is caused by stimulating exterior and interior coagulation system during the supportive treatment of ECMO.
KEYWORDS:extracorporeal membrane oxygenation; coagulation function; platelet
通信作者:于坤, Email: yukunfw@163.com
基金项目:教育部博士点基金(20101106110010); 首都临床特色应用研究基金(Z111107058811090)
收稿日期:2014-12-11
中图分类号:R 329.3
文献标志码:A
文章编号:1672-2353(2015)09-009-03
DOI:10.7619/jcmp.201509003
