枸杞接种尖孢镰孢菌后抗氧化酶类活性的变化
2015-02-24冯丽丹王有科陈秀蓉张宝琳
李 捷,冯丽丹,王有科,何 静,陈秀蓉,张宝琳
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.甘肃农业大学 林学院,甘肃 兰州 730070;3.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070;4.甘肃省林业科学研究院,甘肃 兰州 730020)
枸杞接种尖孢镰孢菌后抗氧化酶类活性的变化
李 捷1,2,冯丽丹3,王有科2,何 静2,陈秀蓉1,张宝琳4
(1.甘肃农业大学 草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美草地畜牧业可持续发展研究中心,甘肃 兰州 730070;2.甘肃农业大学 林学院,甘肃 兰州 730070;3.甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070;4.甘肃省林业科学研究院,甘肃 兰州 730020)
以枸杞栽培品种宁杞一号和美洲引进野生种L.exsertum为试验材料,采用切根法接种分离自发病枸杞的强致病菌F.oxysporum,研究接种后0~20 d枸杞叶片中过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)等抗氧化酶的动态变化。结果显示,接种后L.exsertum的POD,SOD和PAL活性和活性增加量均高于宁杞一号;CAT和PPO活性虽低于宁杞一号,但活性增加量高于宁杞一号,且高酶活持续时间较长,与宁杞一号差异显著(P<0.05)。接种后SOD和PAL活性的高低,POD、CAT、SOD、PPO和PAL活性的增加幅度均可以作为筛选枸杞抗镰孢菌根腐病能力的指标。
枸杞;根腐病;Fusariumoxysporum;抗氧化酶类;抗病性
枸杞(Lyciumbararum)为茄科多年生落叶灌木,是重要的“药食同源”型植物资源之一,具有抗衰老、抗氧化、调节免疫等重要功能,是中国西北地区的特色经济林,已成为农村重要的经济来源。近年来枸杞根腐病发病率连年上升,已经严重影响到了该产业的可持续发展[1]。1980年枸杞根腐病在西宁市省军区园艺场成片发生,香日德农场的发病率一度高达53.2%[2]。1994年枸杞根腐病在宁夏普遍发生,最重的病株数37.6%,枯死株26.5%[3]。1998年新疆枸杞主栽区栽植苗木2~3年后死亡率为20%~30%,重者全田被毁[4]。王国珍等[3]1994年报道尖孢镰孢菌(Fusariumoxysporum)是宁夏产区枸杞根腐病的最主要的致病菌。近年来对于病原菌与植物互作的研究较多,接种大豆疫霉根腐病菌后,抗病野生大豆比感病野生大豆的SOD活性增大[5];2013年赵庆芳等[6]研究黄芪接种尖孢镰孢菌后,黄芪叶中SOD,CAT和POD活性均呈现出先升高后降低的变化规律;韩珊等[7]对板栗不同抗性品种叶片经栗疫菌毒素Cp-处理后发现中抗病品种CAT,APX和PAL活性变化幅度大于感病品种。选用2种枸杞为材料,接种强致病菌F.oxysporum后研究抗氧化酶类活性的变化,以期为西北地区枸杞根腐病抗病栽培和抗病品种选育等提供理论依据。
1 材料和方法
1.1 材料
枸杞:采用枸杞主栽品种宁杞一号(Ningqi Ⅰ)(感病)和美国的野生种L.exsertum(抗病),于2014 年在甘肃农业大学林学院森林培育实验室进行组织培养,炼苗移栽后,选用苗高20 cm的生长健壮均一苗木进行试验。
病原菌:尖孢镰孢菌(F.oxysporum)自甘肃省靖远县枸杞产区发病植株分离获得,经测定是当地枸杞根腐病的优势菌株且致病性强。在接种前7 d于PDA培养基上活化备用。
1.2 方法
1.2.1 接种方法 取长至满皿的尖孢镰孢菌加无菌水制成浓度为106个/mL菌悬液。采取伤根后灌根的方法接种。先用锋利的刀具在距离苗木2 cm处垂直向下切断根系至盆底,苗木的4个方向各切一刀;然后将配制好备用的菌悬液每盆浇灌20 mL,每处理接种10盆,以浇灌20 mL无菌水为对照;每处理均重复3次。接种后覆膜、插上编号标签,黑暗培养24 h后正常光照培养,7 d后去膜,浇灌无菌水保持土壤湿润。宁杞一号标记为N,接种处理标记为NT,对照标记为NCK;L.exsertum标记为L,接种处理标记为LT,对照标记为LCK。
1.2.2 防御酶类相关指标样品处理及采样 接种后立即采样,然后每4 d在14∶00定时采样,采集植株中上部的叶片,做成0.2 g混合样若干,液氮速冻后放入-80℃低温冰箱内保存备用;接种后0~20 d共采样6次。
1.2.3 样品指标测定的方法 随机抽取样品进行测试,每个指标重复3 次。超氧化物歧化酶(SOD)活性参照Kyle[8]、Hou等[9]的方法测定;过氧化物酶(POD)活性参照高俊凤[10]、李合生等[11]的方法测定;过氧化氢酶(CAT)活性参照刘俊[12]、Freguson等[13]的方法测定;苯丙氨酸解氨酶(PAL)活性参照高俊凤[10]、李合生等[11]的方法测定;多酚氧化酶(PPO)活性参照高俊凤[10]、邹琦等[14]的方法测定。
1.3 数据处理
采用Microsoft Excel 2010和SPSS 19.0软件进行统计分析。应用SPSS 19.0对数据进行单因素方差分析(One-way ANOVA),并利用Duncan’s多重比较对差异显著性进行分析。
2 结果与分析
2.1 接种尖孢镰孢菌后SOD活性的变化
SOD活性变化都呈先上升后下降的趋势。NT峰值高出NCK 8.79 U/(g FW·min),LT峰值高出LCK 6.56 U/(g FW·min),出现峰值的时间分别在第8 d和第12 d(图1-A)。L.exsertum的SOD活性起始值高于感病品种宁杞一号,差异显著(P<0.015)。LT的SOD高活性持续到了第20 d,而宁杞一号仅在第12 d之前高于NCK。宁杞一号接种与对照在第12 d之前SOD活性净增加值为正值,12~20 d为负值,活性下降快;而在0~20 dL.exsertum的SOD活性一直为正值,均值达到了9.8 U/(g FW·min),极显著高于宁杞一号(F=4 504.56)。
2.2 接种尖孢镰孢菌对POD活性的影响
NT与LT的POD活性呈现出先升后降的变化趋势。宁杞一号POD峰值出现在第8 d,在0~8 d从33.54 μg/(g FW·min)上升为144.06 μg/(g FW·min),活性上升了4.29倍;8~20 d POD活性下降较快,第20 d时比NCK高11.01 μg/(gFW·min)。L.exsertum的POD峰值出现在第12 d,而宁杞一号的峰值出现在第8 d,0~12 d从10.22 μg/(g FW·min)上升到了117.45 μg/(g FW·min),活性上升了11.49倍;12~20 d POD活性下降缓慢,高活性持续时间较长,第20 d时高出LCK 57.33 μg/(g FW·min)。0~20 d内NT与NCK之间活性差值平均为7.23 μg/(g FW·min),而LT与LCK之间为38.53 μg/(g FW·min),差异极显著(P<0.01)。但整体为宁杞一号POD活性比L.exsertum强(图1-B)。
2.3 接种尖孢镰孢菌对CAT活性的影响
LT与NT处理CAT活性呈现先升后降的变化趋势。宁杞一号的CAT活性峰值出现在第4 d,最高值达到了165.37 μg/(g FW·min),是第0 d活性的5.37倍。L.exsertum的CAT活性峰值出现在第8 d,最高值达到了32.11 μg/(g FW·min),是第0 d活性的7.23倍。宁杞一号达到峰值后迅速下降,而L.exsertum达到峰值后下降平缓,在峰值附近持续时间较长。NT与NCK、LT与LCK的CAT活性的净增加值分别为9.43 μg/(g FW·min)和12.44 μg/(g FW·min),L.exsertum大于宁杞一号(图1-C)。
2.4 接种尖孢镰孢菌后枸杞PPO活性的变化
2种枸杞PPO活性出现先升后降的变化趋势,但升降幅度各有不同。LT的PPO活性迅速上升,高活性持续到了第20 d。NT活性的峰值出现在第8 d,高于起始值21.64 μg/(g FW·min)的1.96倍,高出同时段的NCK15.52 μg/(g FW·min)。LT在达到第一个峰值(24.66 μg/(g FW·min)后,直到第20 d较稳定,23.98 μg/(gFW·min),高出LCK 11.28 μg/(g FW·min)(图1-D)。比较宁杞一号与L.exsertum在20 d内均值比较发现,NT只在第8 d高于NCK,而LT在所有的时段均高于LCK,上升了69.54%,PPO活性增幅显著(P<0.05)。
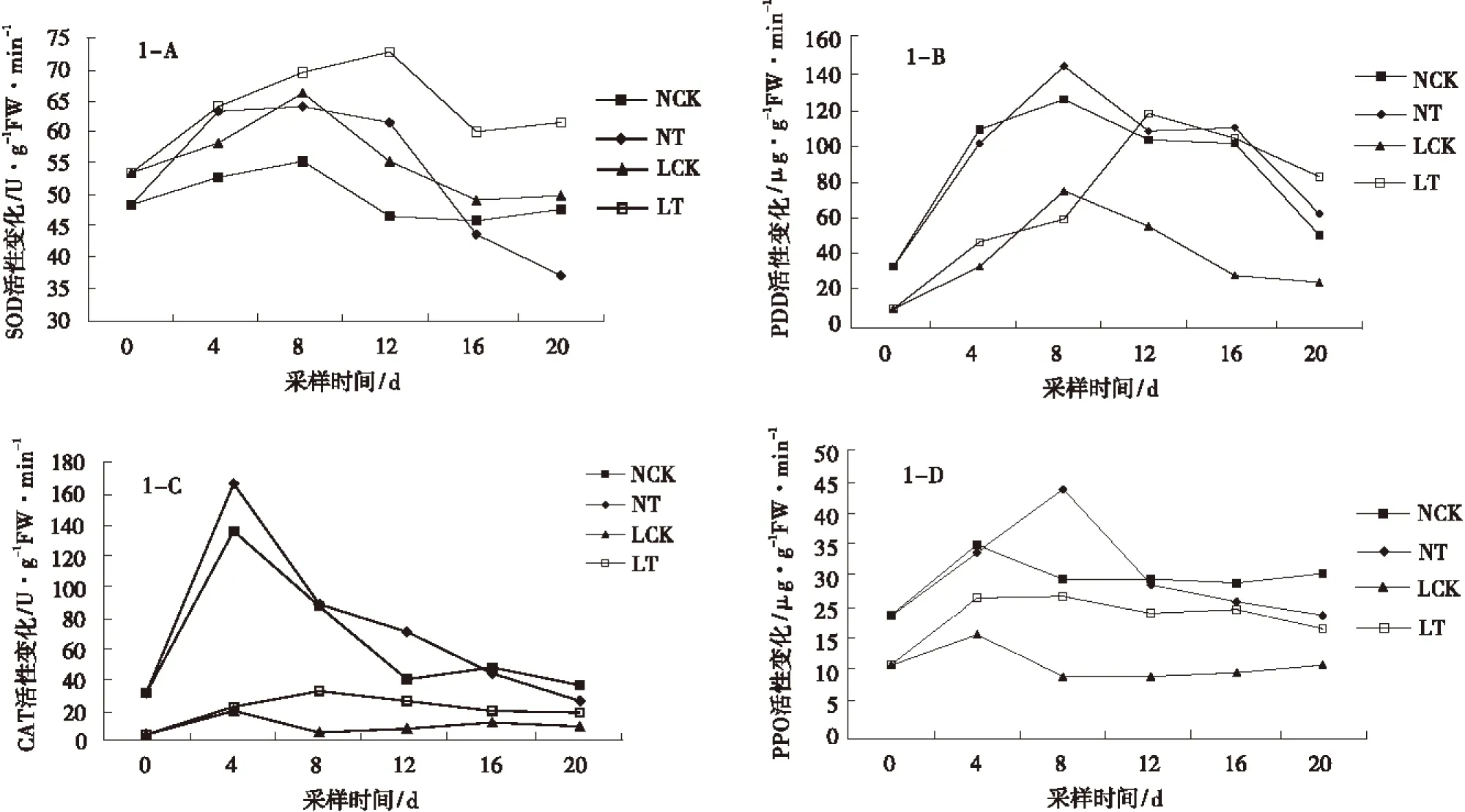
图1 接种尖孢镰孢菌后抗氧化相关酶类的活性Fig.1 Changes of antioxidant enzymes activity of inductive reactance Lycium after inoculation with F.oxysporum
2.5 接种尖孢镰孢菌对枸杞PAL活性的影响
宁杞一号的PAL活性在整个过程中呈现出“降-升-降”的变化趋势,NT在第8 d时出现PAL酶活高峰,达到了78.22 U/(g FW·min),随即下降,第20 d时下降到了与起始值接近的51.28 U/(g FW·min);NCK的变化比较平缓。L.exsertum的变化复杂,LT的PAL酶活性基本呈现出上升的趋势,在第20d达到峰值81.49 U/(g FW·min);LCK的PAL活性波动较小,在第8 d时出现峰值,为72.00 U/(g FW·min),但很快降至起始值附近。LCK与NCK时PAL活性在0~20 d的活性值均值与起始值相当,差异不显著。LT与NT的PAL活性均与起始值相比差异极显著,净增值分别为5.60 U/(g FW·min)和6.67 U/(g FW·min)。在整个过程中L.exsertum的PAL酶活性要高于宁杞一号(表1)。
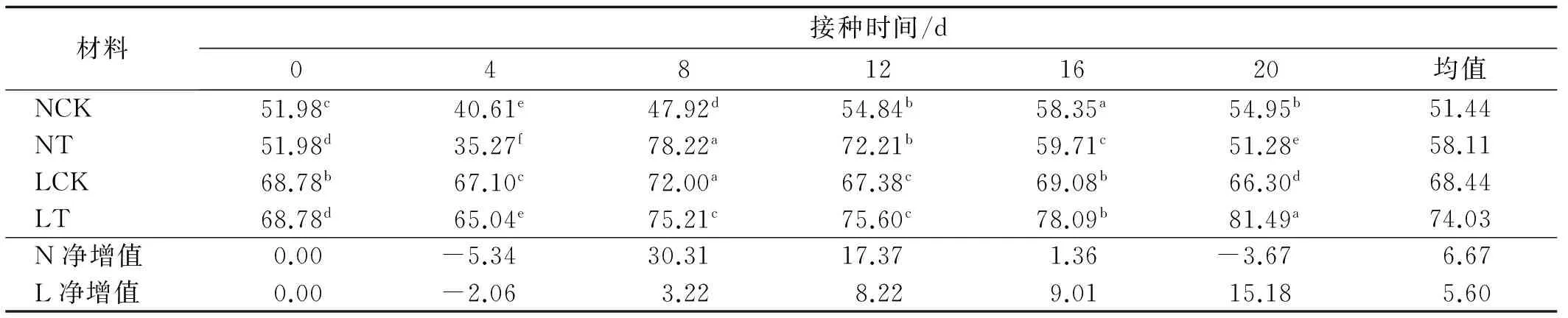
表1 接种尖孢镰孢菌感抗枸杞PAL活性及净增加值Table1 PAL activity and its net increment of inductive reactance Lycium after inoculation with F.oxysporum U/(g FW·min)
注:同行不同小写字母表示差异显著(P<0.05)
3 讨论与结论
SOD是植物体内专一清除超氧阴离子自由基的酶[15],接种尖孢镰孢菌后L.exsertum的SOD活性迅速增强,SOD活性的起始值、峰值以及净增加值均大于感病的宁杞一号,且差异显著;研究结果与番茄感染青枯菌[16]、白粉病菌侵染红三叶[17]、盐胁迫景天三七结果类似[18]。
POD是植物细胞内源活性氧重要的清除剂[19],参与植物酚类的氧化与聚合[20],参与木质素和质保素的合成,降低对胞外酶降解的敏感性,阻止病原物入侵[21]。POD在植物对病原物或逆境因子的抗性中有重要的作用。研究结果显示,接种尖孢镰孢菌可以大幅提高抗病L.exsertum的POD酶活性,而抗性较弱的宁杞一号则提高幅度有限,这与前人在小麦抗条锈病研究[22]、大白菜小黑点病[23]研究上结果类似。
CAT作为植物体内存在的重要的抗氧化酶类,在接种尖孢镰孢菌后L.exsertum在高酶活性下持续时间较宁杞一号长,增加值较宁杞一号高,与不同品种苹果抗褐斑菌的研究结果相似[16],而与高粱抗黑穗病和小麦抗条锈菌[24,25]研究结果有差异。
植物通过PPO获得的抗性可催化形成木质素和其他的酚类物质[26],可催化形成o-醌,其毒性、黑色素集结以及共价结合修饰亲核氨基酸的特性,以抑制致病微生物的繁殖[27]。接种尖孢镰孢菌后抗病L.exsertum的PPO活性的起始值、峰值以及净增加值均大于感病的宁杞一号,且差异显著(P<0.05),与甘蓝链格孢菌侵染白菜、黄瓜枯萎菌粗毒素处理黄瓜幼苗研究结果一致[28-30],与对苜蓿匍柄霉叶斑病[31]的结果则不同。
PAL是苯丙烷途径的关键酶,参与了多种激发子诱导的抗性[32],增强了植物对病原侵染的抵抗能力[33]。本研究结果显示,接种尖孢镰孢菌可以大幅提高L.exsertum的PAL酶活性,而抗性较弱的宁杞一号则提高幅度有限,这与前人在黄瓜[30]、匍匐翦股颖和棉花[34,35]上的研究结果类似。
不论接种尖孢镰孢菌与否,POD、SOD和PAL在第8 d,CAT、PPO在第4 d均出现了酶活性上升的情况,研究后发现可能与切根接种的接种方法有关,这种接种方式对植株造成的机械损伤引起抗氧化相关酶类的表达,在第8d后对照处理酶活下降回归正常。
研究结果表明,接种后L.exsertum抗氧化相关酶类POD、CAT、SOD、PPO和PAL酶活性或酶活性增加量高于宁杞一号,且持续时间长差异显著。说明接种尖孢镰孢菌后抗病的L.exsertum抗氧化相关酶类被激发,产生了更高的活性,使植物有了更强的抗病能力,表明抗氧化相关酶类在抗枸杞根腐病的过程中具有十分重要的作用。SOD和PAL的酶活性高低,POD、CAT、SOD、PPO和PAL酶活性接种后的增加情况可以作为筛选抗枸杞镰孢菌根腐病的技术指标。接种尖孢镰孢菌后,抗病能力强的L.exsertum抗氧化酶类活性激增且持续时间长。这可能与接种处理可以激发植物中的抗性基因表达有关。
[1] 刘淑娟.景泰县草窝滩镇枸杞根腐病的发生及防治[J].防护林科技,2009,90(3):116-117.
[2] 刘振荣.枸杞枯萎病研究初报[J].青海农林科技,1980(3):43-45.
[3] 王国珍,鲁占魁.宁夏枸杞根腐病病原的研究[J].微生物学通报,1994,21(6):330-332.
[4] 李晖,李国英,付建红.新疆枸杞烂根病病原的鉴定[J].植物保护学报,1998,25(3):253-257.
[5] 徐鹏飞,鹿文成,靳立梅,等.野生大豆接种大豆疫霉根腐病菌后超氧化物歧化酶活性变化[J].作物杂志,2011(5):31-35.
[6] 赵庆芳,陈玉萍,李巧峡,等.黄芪感染根腐病菌后抗氧化系统的变化规律研究[J].西北师范大学学报(自然科学版),2013,49(2):71-74.
[7] 韩珊,朱天辉.不同抗性板栗品种的防御酶系对栗疫菌Cp-毒素的响应[J].植物保护学报,2009,36(4):305-309.
[8] Kyle M E,Nakae D,Sakaida I,etal.Endocytosis of superoxide dismutase is required in order for the enzyme to protect hepatocytes from the cytotoxicity of hydrogen peroxide [J].J Bio Chem,1988(8):73-84.
[9] Hou Wen-Chi,LuYeh-Lin,Liu Sin-Yie,etal.Activities of superoxide dismutase and glutathione peroxidase in leaves of different cultivars ofLiriopespicataL.on 10% SDS-PAGE gels[J].Bot Bull Acad Sin,2003(44):37-41.
[10] 高俊凤.植物生理学实验技术[M].北京:高等教育出版社,2006.
[11] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:105-109.
[12] 刘俊,吕波,徐朗莱.植物叶片中过氧化氢含量测定方法的改进[J].生物化学与生物物理进展,2000(5):548-551.
[13] Freguson I B,Watkins C B,Harman J E.Inhibition by calcium of senescence of detached cucumber cotyledons[J].Plant physiol,1983(1):182-186.
[14] 邹琦.植物生理学实验指导[M].北京:中国农业出版社,1995:97-106.
[15] Schopfer P,Plachy C,Frahry G.Release of reactive oxygen intermediates(superoxide radicals,hydrogen peroxide,and hydroxyl radicals) and peroxidase in germinating radish seeds controlled by light,gibberellin,and abscisic acid.Plant Physiol 125[J].Plant Physiology,2001,125(4):1591-1602.
[16] 王曼.两个苹果品种叶片接种褐斑菌后抗病相关酶活性变化研究[D].杨凌:西北农林科技大学,2013.
[17] 刘晓玲,宋超,杜文华.红三叶对白粉病抗性机理研究[J].草原与草坪,2011,31(3):73-76.
[18] 田晓艳,刘延吉,张蕾,等.盐胁迫对景天三七保护酶系统、MDA、Pro及可溶性糖的影响[J].草原与草坪,2009(6):11-14.
[19] Rotruck J T,Pope A L,Ganther H E,etal.Selenium:Biochemical Role As A Component Of Glutathione Peroxidasec[J].Nutrition Reviews,2009,38(8):280-283.
[20] Svalheim Ø,Robertsen B.Induction of peroxidases in cucumber hypocotyls by wounding and fungal infection[J].PhysiologiaPlantarum,1990,78(2):261-267.
[21] Michiels C,Raes M,Toussaint O,etal.Importance of Se-glutathione peroxidase,catalase,and Cu/Zn-SOD for cell survival against oxidative stress[J].Free Radical Biology & Medicine,1994,17(3):235-248.
[22] 姜睿.成株抗条锈小麦品种的筛选及其抗病机理的研究[D].杨凌:西北农林科技大学,2007.
[23] 于业志.大白菜小黑点病及其抗病生理基础的研究[D].青岛:山东农业大学,2007.
[24] 邢慧清.高粱丝黑穗病群体生理指标测定与抗病基因分子标记分析[D].沈阳:沈阳师范大学,2013.
[25] 张彬.小麦抗病基因同源序列分析及条锈菌诱导的防御酶活性研究[D].雅安:四川农业大学,2006.
[26] Thygesen P W,Dry IB,Sp.R.Polyphenol oxidase in potato.A multigene family that exhibits differential expression patterns.[J].Plant Physiology,1995,109(2):525-531.
[27] Thipyapong P,Stetfens J C.Tomato Polyphenol Oxidase(Differential Response of the Polyphenol Oxidase F Promoter to Injuries and Wound Signals)[J].Plant Physiology,1997,115(2):409-418.
[28] 胡颖慧.唐菖蒲根腐菌粗毒素的致毒作用及抗病无性系筛选[D].哈尔滨:东北农业大学,2012.
[29] 王利英,侯喜林,刘琳,等.甘蓝链格孢菌侵染对白菜保护酶活性和H2O2含量的影响[J].园艺学报,2008(7):1065-1068.
[30] 田雪亮,刘鸣韬,杨家荣.黄瓜枯萎菌粗毒素对不同抗性黄瓜种子萌发及幼苗胁迫作用研究[J].中国生态农业学报,2008(6):1495-1498.
[31] 张静妮.不同秋眠等级苜蓿匍柄霉叶斑病抗性评价及抗病机理研究[D].北京:北京林业大学,2008.
[32] Mauch-Mani B,Slusarenko A J.Production of salicylic acid precursors is a major function of phenylalanine ammonialyase in the resistance of Arabidopsis to Peronosporaparasitica[J].The Plant Cell,1996(8):203-212.
[33] Whetten R,Sederoff R.Lignin biosynthesis[J].Plant Cell,1995(7):1001-1013.
[34] 马祥,马晖玲,安惠惠,等.诱导剂丁二醇对匍匐翦股颖抗病相关的防卫酶活性的影响[J].草原与草坪,2012,32(3):37-42.
[35] 冯洁,陈其煐.棉株体内几种生化物质与抗枯萎病之间关系的初步研究[J].植物病理学报,1991(4):53-59.
The change of antioxidant enzymes ofLyciumInfected byFusariumoxysporum
LI Jie,1,2,FENG Li-dan3,WANG You-ke2,HE Jing2,CHEN Xiu-rong1,ZHANG Bao-Lin4
(1.CollegeofGrasslandScience,GansuAgriculturalUniversity,Lanzhou,China,730070;2.CollegeofForestryScience,GansuAgriculturalUniversity,Lanzhou,China,730070;3.CollegeofFoodScienceandEngineering,GansuAgriculturalUniversity,Lanzhou,China,730070;4.GansuAcademyofForestryScience,Lanzhou,China,730020)
Used the wolfberries,NingqiⅠcv.andL.exsertumas the testing materials,the studying isolated the strong pathogenic that Fusarium oxysporum with root cutting method from the materials,and studied the change of peroxidase,catalase,superoxide dismutase,polyphenol oxidase as well as phenylalanine ammonialyase of leaves from 0 to 20 days after inoculation.The result showed that the enzyme activity,including POD,SOD,PAL and its increment of L.exsertum were higher than that of Ningqi Ⅰcv.The activity of CAT and PPO were lower than that of Ningqi Ⅰcv.,but,the increment of the enzyme activity was higher than that of Ningqi Ⅰcv.and the high enzyme activity had longer time,which had significant difference compared to that of Ningqi Ⅰcv.(P<0.05).The enzyme activity level of SOD and PAL and its increment of POD,CAT,SOD,PPO and PAL after inoculation can be used as a index of screening against root rot with Fusarium of Chinese wolfberry.
Lycium spp.;root rot;Fusariumoxysporum;anti-oxidant enzymes;disease resistance
2015-06-29;
2015-07-13
国家林业局“948”项目(2011-4-29);甘肃中草药科技攻关项目(GYC11-01);甘肃农业大学盛彤笙科技创新基金(GSAU-STS-1338)
李捷(1981-),男,四川仁寿人,博士研究生,讲师,主要从事经济林抗逆生理和病害防治研究。 E-mail:lj81658@gsau.edu.cn 陈秀蓉为通讯作者。
S 567.23
A
1009-5500(2015)06-0077-06
