龙眼胚性愈伤组织AGO6基因克隆及其在体胚发生过程中的表达分析
2015-02-22杨曼曼林玉玲王天池赖钟雄
杨曼曼,林玉玲,王天池,赖钟雄
(福建农林大学园艺植物生物工程研究所/亚热带果树研究所,福建福州350002)
龙眼胚性愈伤组织AGO6基因克隆及其在体胚发生过程中的表达分析
杨曼曼,林玉玲,王天池,赖钟雄*
(福建农林大学园艺植物生物工程研究所/亚热带果树研究所,福建福州350002)
摘要:依据龙眼胚性愈伤组织转录组数据库Unigene序列,利用RT-PCR结合RACE技术,以龙眼胚性愈伤组织cDNA为模板,获得DlAGO6基因的cDNA全长序列,共3 168 bp(登录号为KF819529),完整开放阅读框2 700 bp,编码900个氨基酸。生物信息学分析表明:DlAGO6的cDNA所编码的氨基酸序列含有2个高度保守的PAZ和PIWI结构域,具有典型的AGO类蛋白的结构特征;与拟南芥AGO6蛋白序列有较高的同源性。 龙眼体胚发生过程中DlAGO6表达量的qPCR分析表明: DlAGO6在龙眼松散型胚性愈伤组织时期的表达量最高,在鱼雷形胚时期表达量最低,推测DLAGO6在龙眼松散型胚性愈伤组织阶段的高表达量,可能与细胞的旺盛分裂有关。
关键词:龙眼;体胚发生;AGO6;基因克隆;定量PCR
Argonaute蛋白(AGO)是在细菌、古细菌、真菌、植物以及动物中发现的一类进化上高度保守的碱性蛋白,根据其功能结构域可分为AGO亚族和PIWI亚族,目前在植物中所发现的AGO 蛋白都属于AGO亚族[1]。拟南芥中的AGO6蛋白属于AGO亚族,与siRNA介导的异染色质的积累、DNA的甲基化以及基因沉默具重要的作用[2-3]。AGO蛋白含有保守结构域 PIWI和PAZ,除此之外,还有包括N末端和Middle。其中 PAZ 结构域在 Dicer 蛋白中也有,含有β亚结构域能够识别并结合sRNA的3端核苷酸,PIWI结构域具有RNaseH构象并具备RNA内切酶活性,在基因沉默过程中行使sRNA靶标mRNA的切割作用,形成3′-OH和5′-磷酸酸基末端[4]。
AGO蛋白在基因沉默的过程中发挥着重要的功能,是构成RNA诱导沉默复合体(RISC)的核心元件,参与靶向mRNA的断裂、翻译抑制或染色质修饰[5]。AGO蛋白在与小RNA的共同作用下对于基因组的稳定具有维持的作用,对组织发育具有调控作用,参与逆境胁迫响应以及激发免疫防御[6]。该蛋白存在于所有高等真核生物,并在不同的胚胎发育、细胞分化和转座子沉默等过程中具有重要作用。拟南芥中AGO蛋白含有10种,可分为3个分支,分别为AGO1/AGO5/AGO10、AGO2/AGO3/AGO7、AGO4/AGO6/AGO8/AGO9[7],不同的AGO蛋白形成沉默复合体结合的小RNA有所差异,其中AGO6偏向于与长度为24nt并且5′端为腺嘌呤的小RNA结合形成沉默复合体[8]。
近年来随着小RNA逐步成为研究热点,与小RNA调控相关的Argonaute蛋白也成为了研究的焦点,然而关于Argonaute蛋白家族的研究主要集中在拟南芥和水稻等草本植物,在木本植物果树中有关这类基因的研究却鲜有报道,在本研究以龙眼胚性愈伤组织的转录组数据为基础,借助龙眼体胚发生系统,对龙眼胚性愈伤组织Argonaute(AGO)基因进行克隆,对其进行生物信息学分析,同时检测其在体胚发生过程中不同发育阶段的表达情况,为将来研究AGO蛋白与小RNA代谢调控作用的研究奠定基础。
1材料与方法
1.1材料
本研究以长期继代保持且遗传稳定的“红核子”品种龙眼(DimocarpuslonganLour.cv.Honghezi)胚性愈伤组织(LC2细胞系)为试验材料,由赖钟雄[9]1994年诱导并由福建农林大学园艺植物生物工程研究所长期进行继代保存。龙眼胚性愈伤组织的转录组数据已在GenBank上登陆,登陆号为SRA059205。依据龙眼体胚发生同步化调控的方法[10],获得的龙眼体胚6个不同阶段的胚性培养物的同步化材料,即松散型胚性愈伤组织、不完全胚性紧实结构、球形胚、心形胚、鱼雷形胚和子叶形胚,将其作为目的基因实时荧光定量分析的试验材料。
1.2方法
1.2.1总RNA的提取第一链cDNA的合成取龙眼体胚发生各阶段的培养物0.2 g,采用TriPure提取法提取总的RNA(总RNA的提取采用Invitrogen公司的Trizol Reagent,参考试剂盒说明书提取),用DNAaseⅠ处理除去基因组DNA,测OD确定RNA的质量以及浓度,选取A260/A280在1.9~2.1的RNA进行逆转录。qPCR的cDNA合成采用的TAKARA反转录试剂盒(DRR037A),按照试剂盒说明书进行逆转录分别合成6个时期的cDNA。
1.2.2AGO6转录组分析在龙眼胚性愈伤转录组数据中搜索AGO6相关的基因,提取序列并在NCBI数据库与其它物种进行比对,以确定所选序列是同一条基因。
1.2.3引物设计根据龙眼体胚性愈伤转录组数据库中Unigene21308、Unigene29677、Unigene 33433、Unigene40534、Unigene49772、Unigene51602以及GenBack数据库中植物AGO基因相关核酸序列信息,采用DNAMAN6 软件设计克隆该基因的引物。同时根据所得的全长序列结合实时荧光定量PCR引物的设计原则设计荧光定量引物。本研究中使用的引物序列见表1,引物委托北京六合华大基因科技股份有限公司合成。
1.2.4目的片段的扩增以反转录第一链cDNA为模板,AGO-F1和AGO-R1为上下游引物,进行保守区域的RT-PCR扩增,以AGO-F2和AGO-R2为引物进行延伸的RT-PCR扩增,PCR扩增程序为94 ℃预变性3 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。
以3′RACE的cDNA为第一轮PCR扩增的模板,AGO-3R1和3P为引物进行第一轮的PCR扩增,将第一轮扩增产物作为模板,AGO-3R2和3NP为引物进行第二轮PCR扩增。
5′RACE采用的是由Invitrogen公司Gene RacerTM(RLM-RACE) kit,按照试剂盒说明书的步骤逆转录合成的cDNA为模板,以AGO-5RACE1和5P为引物进行第一轮PCR扩增。以第一轮产物稀释100倍为模板,AGO-5RACE2和5NP为引物进行第二轮PCR扩增。
将上述PCR扩增产物用10 g/L琼脂糖凝胶进行电泳检测,采用BIOMIGA公司DNA快速纯化回收试剂盒回收目的片段,连接到pMD-18T载体后转化到DH5α感受态细胞,阳性克隆鉴定后送测序。
1.2.5生物信息学分析利用以下工具对龙眼AGO6基因编码的蛋白质进行生物信息学分析:利用ExPASy Protparam预测编码蛋白质的基本理化性质(http://www.expasy.ch/ tools/protparam.htmL);SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)和PSORT软件(http://psort.nibb.ac.jp/)分别预测蛋白质信号肽及其断裂位点与亚细胞定位情况;EMBnet TMpred(http://www.ch.embnet.org/software/TMPRED_ form.html)预测蛋白质跨膜区段;NCBI-ProteinTools(http://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)预测蛋白质的保守区域;Coils(http://www.ch.embnet.org/software/COILS_form.html)预测蛋白质曲螺旋结构;磷酸位点预测使用NetPhos(http://www.cbs.dtu.dk/services/NetPhos/);Phyre2[11]软件进行预测二、三级结构,采用MEGA5.0[12]软件基于邻接法(Neighbor-Joining,NJ)构建系统进化树。
1.2.6qPCR的扩增实时荧光定量反应参照Lin和Lai[13]的步骤进行,Takara SYBR ExScript 试剂和罗氏LightCycler 480仪器,以龙眼体胚6个不同发育阶段稀释后的cDNA为模板,使用AGO-QF和AGO-QR上下游引物进行qPCR扩增.,反应体系和反应过程参照Lin和Lai[13]的实验,以6个不同模板的混合样5倍梯度系列稀释制作标准曲线。从扩增曲线图中得到各样品的Ct值,从而根据标准曲线获得不同阶段AGO6基因的mRNA相对含量,并通过Lin和Lai[13]建立的多基因内参体系的校正最终得到目的基因的相对表达量。

表1 基因克隆以及qPCR引物序列
2结果与分析
2.1龙眼胚性愈伤组织AGO基因cDNA全长序列的获得
以龙眼胚性愈伤组织cDNA为模板,AGO-F1和AGO-R1为上下游引物,进行PCR扩增,测序得到目的条带长度为1 858 bp,将该序列的核苷酸在GenBank上经BLAST比对,与数据库中已有的AGO的核苷酸序列同源性很高,以AGO-F2和AGO-R2为引物向3′端延伸获得647 bp;以AGO-3R1和3P为第一轮扩增引物,AGO-3R2和3NP为第二轮扩增引物进行3′RACEPCR扩增获得778 bp;以AGO-5RACE1和5P为第一轮扩增引物,AGO-5RACE2和5NP为第二轮扩增引物进行5′RACEPCR扩增获得580 bp。
将测序所得序列采用DNAMAN6进行拼接,得到AGO6基因cDNA的全长序列3 168 bp,并以AGO-F(C)和AGO-R(C)为引物进行ORF验证,起始密码子和终止密码子分别为ATG和TGA,开放阅读框(ORF)长为2 700 bp,编码900个氨基酸,与以AGO-F(C)和AGO-R(C)为引物PCR扩增获得的ORF一致;5′端非编码区(5′UTR)长为145 bp和3′非编码区(3′UTR)长为323 bp,含25个polyA。将该序列的核苷酸和推导的氨基酸序列分别在GenBank上BLAST和BLASTn,结果显示均与数据库中已有的拟南芥的AGO6核苷酸和氨基酸序列高度同源,因此推测该基因为龙眼胚性愈伤组织的AGO6基因,该序列在GeneBank中登陆,命名为DlAGO6,登陆号为KF819529。
2.2龙眼胚性愈伤组织AGO序列及理化性质与结构分析
利用生物信息学对龙眼胚性愈伤组织AGO6基因编码的氨基酸的理化性质和结构特征进行分析。ExPASy ProtParam 推测:蛋白质分子量为100.246 ku,分子式为C4426H7096N1262O1317S37,总原子数为14 138;由20种氨基酸组成,其中亮氨酸(Leu)和丝氨酸(Ser)含量丰富分别占9.0%和8.7%,色氨酸含量最少0.6%,N端末端为蛋氨酸(Met)。该蛋白的Grand average of hydropathicity(GRAVY)值为 -0.341,理论等电点为9.21,不稳定指数为38.55,故该蛋白是亲水、稳定的碱性蛋白。
利用TMpred工具,对AGO6蛋白进行跨膜结构的预测,结果显示,从第836个氨基酸到第857个氨基酸的之间有一个从内向外的跨膜螺旋结构,该跨膜螺旋得分为895;从第841个氨基酸到第859个氨基酸的之间也有一个从内向外的跨膜螺旋结构,跨膜螺旋得分为892,以上结果说明该蛋白为跨膜蛋白。亚细胞定位分析结果显示该蛋白存在于微体(过氧化氢酶)和细胞核中的可能性较大。SignalP 4.1 Server在线分析显示,不含有明显信号肽,由此可得该蛋白是一个非分泌蛋白。
采用NCBI-ProteinTools对蛋白质保守区域预测(图1),结果显示该蛋白含有PAZ和PIWI结构域,其中PAZ结构域与AGO结合RNA有关,PIWI区域具有RNaseH酶的活性,对mRNA具有切割的作用。

图1 DlAGO6蛋白功能结构域预测Fig.1 Functional domains forecast for DLAGO6 protein
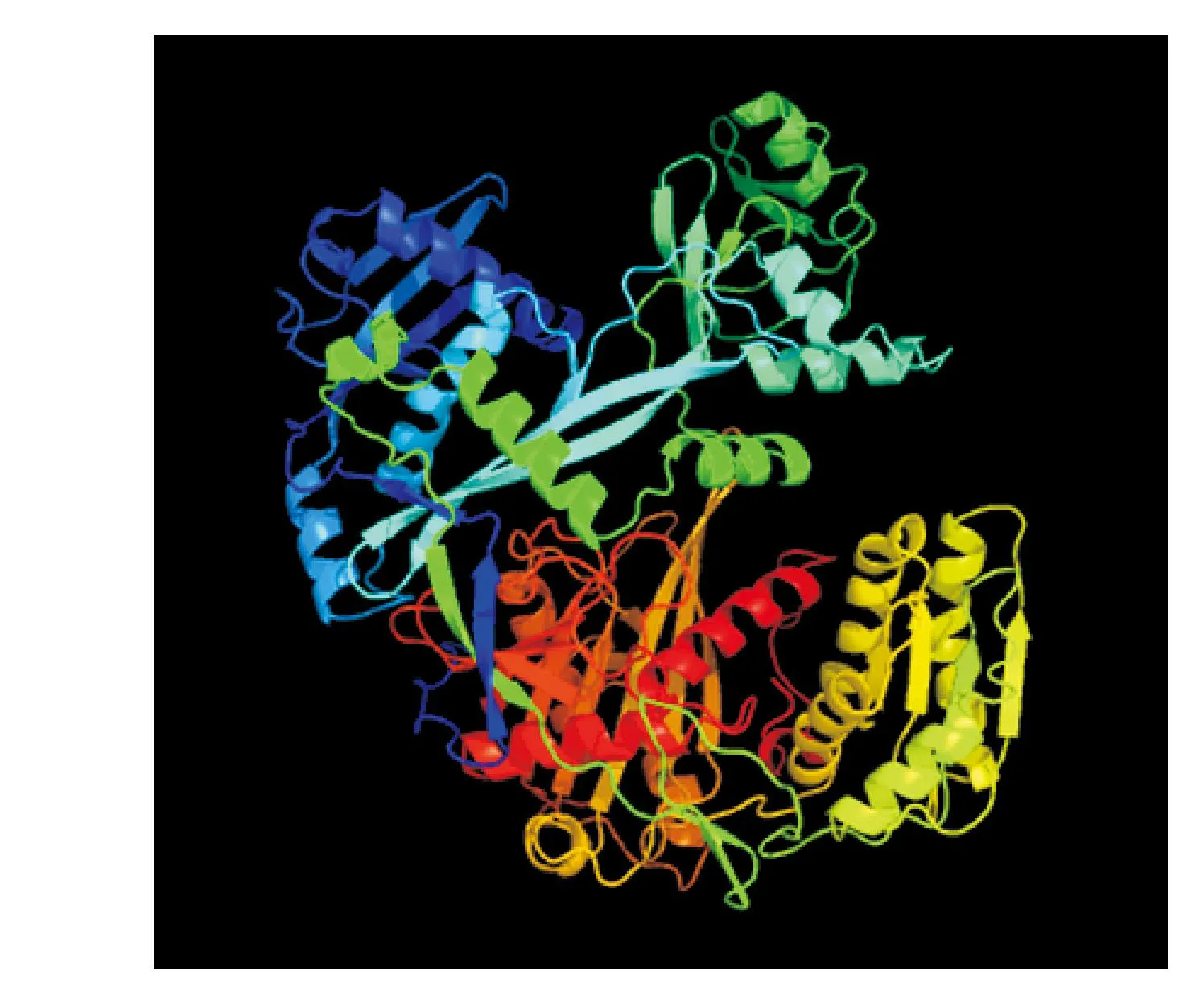
图2 DlAGO6蛋白三维结构预测Fig.2 Three-dimensional structural prediction for DLAGO6 protein
使用phyre 2在线分析软件分析蛋白的二三级结构,结果显示该蛋白含有α-螺旋和β-链,其中无规则卷曲、α-螺旋和β-链的含量分别占24%、28%和25%;蛋白质的三级结构整体近似一个球形(图2),其中也主要是α-螺旋和β折叠结构和无规则卷曲组成,它们相互缠绕。使用Coils对该蛋白质卷曲螺旋结构分析,分析结果表明该蛋白没有曲螺旋结构。
磷酸化位点预测显示,该蛋白丝氨酸的磷酸化位点最多,含29个,其次是苏氨酸含13个,酪氨酸的磷酸化位点最少为6个,该蛋白总共含有48个预测磷酸化位点,分布较为均匀。丝氨酸磷酸化的主要作用是变构蛋白质以激活蛋白质的活力,主要是指酶活力。而酪氨酸磷酸化除了在变构以及激活该蛋白的活力之外,更重要的功能是结核蛋白提供一个结构基因,以促进其和其他蛋白质相互作用从而形成多蛋白复合体。AGO蛋白的PIWI结构域具有RNA内切酶活性,而该蛋白丰富的丝氨酸磷酸化位点,可能为增加该蛋白与小RNA结合能力起着一定的作用。
2.3龙眼胚性愈伤组织AGO6蛋白系统进化树分析
采用MEGA5.05近邻相接法(Neighbor-Joining,NJ)将DlAGO6编码的氨基酸序列同拟南芥、水稻、葡萄的AGO家族的氨基酸序列构建进化树(如图3),进化树中数字代表bootstrap值,重复检测1 000次。由图可以看出,进化树分为三个分支,这三个分支与拟南芥的三个亚族的归属吻合,分别是AG01、AG07和AG04亚族

图3 DlAGO6与拟南芥、水稻、葡萄AGO蛋白家族系统进化树分析Fig.3 Phylogenetic tree analysis of DLAGO6,Arabidopsis,rice,and grapes AGO protein family
2.4AGO基因互作网络分析
采用在线软件Funcoup3.0(http://funcoup.sbc.su.se/search/)[15],以拟南芥作为参照模式植物,在Confidence threshold 0.2、Expansion depth 1、Nodes per expansion step 200的参数下,预测到AGO6(AT2G32940)可能的基因互作网络图如图4所示,互作网络的相关基因如图5所示。AGO6蛋白与AGO4(AT2G27040)、TUA4(AT5G11320)、TUB2(AT5G62690)、AT1G24360、AT5G09510、AT4G34555可能具有代谢上下游关系,与ULT1(AT4G28190)可能具有蛋白互作关系,与AT2G04390、HTB4(AT5G59910)、YUC4(AT1GO4820) 可能形成复合体物质,由此可见,AGO6在相关基因调控网络中起着重要的作用。
2.5龙眼体胚发生过程中AGO6基因的表达分析
MiRNA的负调控作用是通过与AGO蛋白诱导形成沉默复合体(RISC)进行的,因此对AGO基因表达的分析有助于了解miRNA调控的机制。本研究选用了体胚发生过程6个不同时期进行qPCR,内参基因采用EIF4α、EF-1α和FSD来校正数据。结果显示,在龙眼体胚发生不同时期该基因的表达水平变化活跃,在胚性愈伤时期的表达量最为丰富,是不完全胚性紧实时期的6倍左右;在球形胚发育到子叶形胚的过程中,在鱼雷形胚时期表达量下降到最低点,其他时期的表达量相对稳定,是不完全胚性紧实时期的3倍作用。说明DlAGO6在龙眼胚性发育过程中球形胚、心形胚、子叶形胚,尤其是胚性愈伤组织中起关键作用。DlAGO6在龙眼胚性愈伤时期大量表达,推测该阶段miRNA 的调控作用活跃,miRNA的表达量较多。

图4 AGO6的基因互作网络Fig.4 Gene interaction network map of AGO6
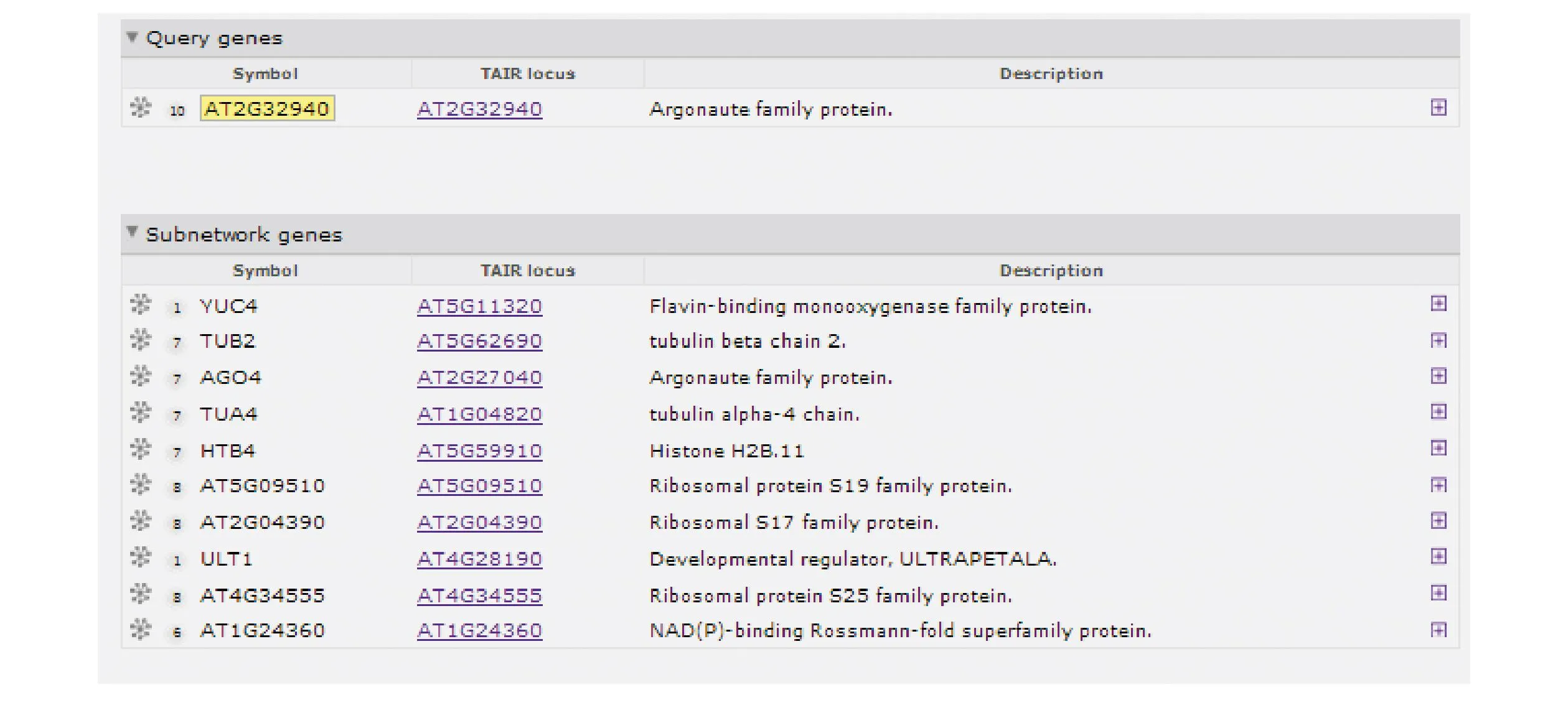
图5 AGO6互作网络的相关基因Fig.5 Related gene of AGO6 gene interaction network map

1:松散型的胚性愈伤组织(Stage 1);2:不完全胚性紧实结构(Stage 2);3:球形胚(Stage 3);4:心形胚(Stage 4);5:鱼雷形胚(Stage 5);6:子叶形胚(Stage 6)。1:The friable-embryogenic callus(Stage 1);2:Incomplete compact pro-embryogenic cultures(Stage 2);3:Globular embryos(Stage 3);4:Heart embryos(Stage 4);5:Topedo embryos(Stage 5);6:Cotyledonary embryos(Stage 6).EIF4α,EF-1α and FSD were as reference genes to balance the data of qRT-PCR.图6 龙眼体胚发生过程中DlAGO6 mRNA的相对转录水平Fig.6 Relative expressions of DlAGO6 at different stages of longan SE
3讨论
3.1龙眼胚性愈伤组织AGO6蛋白的结构及功能
由于miRNA相关研究有所突破,与miRNA沉默途径密切相关的AGO蛋白也逐渐成为一个研究热点,其在模式植物拟南芥和水稻中的研究相对深入,然而对于果树中的AGO蛋白却鲜见报道。本研究利用利用RACE和PCR技术,以龙眼胚性愈伤组织cDNA为模板,克隆得到DlAGO6基因cDNA全长序列,核酸序列和氨基酸序的比对结果显示同模式植物拟南芥的AGO6的核酸序列和蛋白质序列同源性很高。
生物信息学分析结果显示,该基因编码的氨基酸序列具有PAZ和PIWI结构域,是AGO蛋白的保守结构域,是识别和结合小RNA的重要元件[16]。PIWI是AGO形成沉默复合体(RISC)后主要的切割元件,其中PIWI区域中的保守的氨基酸残基为 2 个天冬氨酸和 1 个组氨酸(DDH),同RNA酶H的DDE催化模体对应[17]。Liu等[18]和 Rivas 等[16]的研究发现,人的AGO2的DDH突变株切割活性缺失,验证了这一推断。AGO基因在模式植物拟南芥中研究相对全面,拟南芥中的10个AGO蛋白都含有切割所必须的DDH或DDD残基。而对基因DlAGO6编码的氨基酸保守功能结构域进行分析,发现该基因中含DDH结构,由此推测龙眼AGO6基因具有切割mRNA功能,参与转录后水平基因沉默。
模式植物拟南芥AGO基因亚细胞定位研究显示,AtAGO4主要位于细胞核和少量的核小体中,AtAGO6主要位于细胞核和细胞质中[19-20],赵丽等[21]的研究结果显示,AtAGO1、AtAGO2、AtAGO3、AtAGO4和,AtAGO9中含有核定位信号肽。本研究获得的龙眼AGO6基因的亚细胞定位分析预测该蛋白存在微体(过氧化氢酶)和细胞核中的可能性较大。
3.2龙眼体胚发生过程中DLAGO6基因的差异表达
近期研究表明,小RNA与植物体胚发育密切相关,而小RNA与AGO蛋白形成沉默复合体对靶基因作用,从而推测AGO蛋白与体胚发育相关[22-24]。DlAGO6在龙眼体胚发生过程中不同时期的都有表达,相对表达量有所差异,说明它在龙眼体胚发生过程中起关键作用。细胞在体胚发生早期细胞分裂较快,研究表明,AGO6:GUS只在拟南芥芽和根的生长点以及连接这些组织的生长点表达[8],在本研究中,DLAGO6在龙眼胚性愈伤时期表达量高,分析其可能与细胞的分裂有关。AGO蛋白在植物体胚发生晚期,能够抑制顶端分生组织中细胞的分化,从而保证了分生组织内细胞的扩增[25]。DLAGO6的在子叶胚时期的表达量有所上升,说明在DLAGO6可能具有以上功能。虽然本研究表明DLAGO6在龙眼体胚发生过程中有重要作用,但其具体作用机制有待进一步研究。
参考文献:
[1]Mallory A,Vaucheret H.Form,function,and regulation of ARGONAUTE proteins[J].The Plant Cell Online,2010,22(12):3879-3889.
[2]Zheng X,Zhu J,Kapoor A,et al.Role ofArabidopsisAGO6 in siRNA accumulation,DNA methylation and transcriptional gene silencing[J].The EMBO Journal,2007,26(6):1691-1701.
[3]Neff U,Burns S,Mangini A,et al.Strong coherence between solar variability and the monsoon in Oman between 9 and 6 kyr ago[J].Nature,2001,411(6835):290-293.
[4]Hutvagner G,Simard M J.Argonaute proteins:Key players in RNA silencing[J].Nature Reviews Molecular Cell Biology,2008,9(1):22-32.
[5]Baulcombe D.RNA silencing in plants[J].Nature,2004,431(7006):356-363.
[6]胥猛,谢雯凡,潘惠新,等.杨树ARGONAUTE基因的克隆及序列分析[J].林业科学,2011,47(3):46-51.
[7]Vaucheret H.Plant argonautes[J].Trends in Plant Science,2008,13(7):350-358.
[8]Havecker E R,Wallbridge L M,Hardcastle T J,et al.The Arabidopsis RNA-directed DNA methylation argonautes functionally diverge based on their expression and interaction with target loci[J].The Plant Cell Online,2010,22(2):321-334.
[9]赖钟雄,潘良镇.龙眼胚性细胞系的建立与保持[J].福建农业大学学报,1997,26(2):160-167.
[10]方智振,赖钟雄.龙眼体胚发生中期发育同步化的初步调控[J].中国农学通报,2009,25(1):152-155.
[11]Kelley L A,Sternberg M J.Protein structure prediction on the Web:A case study using the Phyre server[J].Nature Protocols,2009,4(3):363-371.
[12]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionary genetics analysis using maximum likelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28(10):2731-2739.
[13]Lin Y,Lai Z.Reference gene selection for qPCR analysis during somatic embryogenesis in longan tree[J].Plant Science,2010,178(4):359-365.
[14]向娅,先志强,林冬波,等.番茄SlAGO7 基因的克隆及表达分析[J].热带作物学报,2013,34(4):641-647.
[15]Schmitt T,Ogris C,Sonnhammer E L.FunCoup 3.0:database of genome-wide functional coupling networks[J].Nucleic Acids Research,2014,42(1):380-388.
[16]Rivas F V,Tolia N H,Song J-J,et al.Purified Argonaute2 and an siRNA form recombinant human RISC[J].Nature Structural & Molecular Biology,2005,12(4):340-349.
[17]李超,杜志游,陈集双.解读 AGO 蛋白结构及其功能[J].中国生物化学与分子生物学报,2009,25(11):969-976.
[18]Liu J,Carmell M A,Rivas F V,et al.Argonaute2 is the catalytic engine of mammalian RNAi[J].Science,2004,305(5689):1437-1441.
[19]Li C F,Pontes O,El-Shami M,et al.AnARGONAUTE4-Containing Nuclear Processing Center Colocalized with Cajal Bodies inArabidopsisthaliana[J].Cell,2006,126(1):93-106.
[20]Li C F,Henderson I R,Song L,et al.Dynamic regulation ofARGONAUTE4 within multiple nuclear bodies inArabidopsisthaliana[J].PLoS genetics,2008,4(2):e27.
[21]赵丽,夏文强,蔡新忠.拟南芥 AGO2 的亚细胞定位分析[J].浙江大学学报:农业与生命科学版,2013(1):1-10.
[22]Takahata K.Isolation of carrot Argonaute1 from subtractive somatic embryogenesis cDNA library[J].Bioscience,biotechnology,and biochemistry,2008,72(3):900-904.
[23]Wu X M,Liu M Y,Ge X X,et al.Stage and tissue-specific modulation of ten conserved miRNAs and their targets during somatic embryogenesis of Valencia sweet orange[J].Planta,2011,233(3):495-505.
[24]Kawamura Y,Saito K,Kin T,et al.Drosophila endogenous small RNAs bind to Argonaute 2 in somatic cells[J].Nature,2008,453(7196):793-797.
[25]Tahir M,Law D A,Stasolla C.Molecular characterization ofPgAGO,a novel conifer gene of theARGONAUTEfamily expressed in apical cells and required for somatic embryo development in spruce[J].Tree Physiology,2006,26(10):1257-1270.

马艳弘,刘晨,张宏志,等.响应面法优化芦荟皮多糖的微波辅助提取工艺及抗氧化活性研究[J].江西农业大学学报,2015,37(1):149-156.
Cloning ofAGO6 from Embryogenic Callus and Its Expression Analysis
by qPCR during Somatic Embryogenesis inDimocarpuslonganLour.
YANG Man-man,LIN Yu-ling,WANG Tian-chi,LAI Zhong-xiong*
(Institute of Horticultural Biotechnology/Institute of Subtropical Fruit Trees,Fujian Agriculture and Forestry University,Fuzhou 350002,China)
Abstract:Based on the database of longan transcriptome sequences,the DlAG06 from longan embryogenic callus was isolated by using RACE and PCR.The results showed that the cloned full—length cDNA sequence of DlAGO6 was 3 168 bp in length(Genbank:KF819529),containing a 2 700 bp open reading frame(ORF) encoding 900 amino acids.Bioinformatics predicted that the deduced DlAGO6 protein with two conserved PAZ and PIWI domains had the typical characteristics of the AGO family,which had a high identity with the known Arabidopsis thaliana AGO6 protein.The qPCR analysis indicated that the expression level of DlAGO6 gene was the lowest at the stage of torpedo embryo and reached the maximum at the stage of the friable-embryogenic callus,which suggested that DlAGO6 may be associated with exuberant cell division.
Key words:Dimocarpus longan;somatic embryogenesis;AGO6;gene clonging;qPCR
作者简介:杨曼曼(1988—),女,硕士生,主要从事果树生物技术研究,E-mail:291194137@qq.com;* 通信作者:赖钟雄,研究员,博导,E-mail:Laizx01@163.com。
基金项目:国家自然科学基金项目(31272149、31201614)、福建省重大科技平台建设项目(2008N2001)和福建省自然科学基金青年项目(2012J05042)
收稿日期:2014-05-15修回日期:2014-06-23
中图分类号:S667.2
文献标志码:A
文章编号:1000-2286(2015)01-0141-08
