2型糖尿病合并非酒精性脂肪性肝病患者血清炎性因子水平的变化及意义
2015-02-20沈静雪刘宇张盈妍沈阳医学院附属中心医院沈阳110024
沈静雪,刘宇,张盈妍(沈阳医学院附属中心医院,沈阳110024)
2型糖尿病合并非酒精性脂肪性肝病患者血清炎性因子水平的变化及意义
沈静雪,刘宇,张盈妍
(沈阳医学院附属中心医院,沈阳110024)
摘要:目的探讨2型糖尿病(T2DM)合并非酒精性脂肪性肝病(NAFLD)患者血清炎性因子水平的变化及意义。方法选取169例T2DM患者,其中合并NAFLD者83例(NAFLD组),未合并NAFLD者86例(非NAFLD 组)。根据肝酶是否升高将NAFLD组又分为肝酶正常组、肝酶升高组。测量身高、体质量、腰围,检测肝酶、糖脂代谢指标,计算BMI以及胰岛素抵抗指数(HOMA-IR)。检测各组血清hs-CRP、TNF-α、IL-6、IL-10、TGF-β1水平,并进行比较。采用非条件Logistic回归分析方法进行相关分析。结果①与非NAFLD组比较,NAFLD组的体质量、BMI、腰围、GGT、ALT、AST、TC、TG、LDL-C均高(P均<0.01),而年龄、HDL-C低(P均<0.01)。②NAFLD组的空腹胰岛素(FINS)、餐后2 h胰岛素、HOMA-IR均较非NAFLD组升高(P均<0.01),而FPG、2 h PG、HbA1c与非NAFLD组比较差异无统计学意义(P均>0.05)。③与非NAFLD组比较,NAFLD组hs-CRP、TNF-α、IL-6水平升高,IL-10、TGF-β1水平降低(P均<0.01)。④与肝酶正常组比较,肝酶升高组hs-CRP、TNF-α、IL-6水平高,IL-10、TGF-β1水平低(P均<0.01)。⑤hs-CRP、TNF-α、IL-6与HOMA-IR、ALT、GGT、TG呈正相关(P均<0.01),IL-10、TGF-β1与HOMA-IR、ALT、GGT、TG呈负相关(P均<0.01)。结论T2DM合并NAFLD患者的血清hs-CRP、TNF-α、IL-6均升高,IL-10、TGF-β1降低,在肝酶升高的患者中也有类似改变,上述炎性因子水平可反映T2DM患者中是否合并NAFLD以及肝脏病变程度。
关键词:2型糖尿病;非酒精性脂肪性肝病;炎性因子
目前在中国,单独患有2型糖尿病(T2DM)或非酒精性脂肪性肝病(NAFLD)的患病率在10%以上,而T2DM患者中NAFLD的患病率则达42.6%,二者之间密切的关系已成为内分泌学领域和肝脏病学领域研究的重要课题。致炎因子在T2DM的发病机制中起重要作用。由于NAFLD在一定程度上存在着与T2DM相似并密切相关的发病机理,因此我们拟观察细胞因子在T2DM合并NAFLD患者中的变化及意义。
1 资料与方法
1.1临床资料选择2012~2013年在本院住院的169例T2DM患者,均符合WHO专家咨询报告与国际糖尿病联盟-西太区委员会1999年糖尿病分型标准。均排除慢性病毒性肝炎病史,否认自身免疫性、药物性及其他遗传性疾病所致的肝病,无大量饮酒史(乙醇摄入量:男性<140 g/周,女性<70 g/周)。根据彩超及临床资料,按照是否合并NAFLD分为两组: NAFLD组83例,男44例、女39例,年龄(54.3 ±10.2)岁;非NAFLD组86例,男42例、女44例,年龄(58.7±11.4)岁。NAFLD的诊断符合中华医学会肝脏病学分会脂肪肝和酒精性肝病学组《非酒精性脂肪性肝病诊疗指南》。按照肝酶是否升高,将NAFLD组分为肝酶正常组45例、肝酶升高组38例。
1.2人体参数的测量测量身高、体质量、腰围。体质量指数(BMI)=体质量(kg)/身高2(m2)。
1.3生化指标的测定禁食至少8 h后,于次日晨采集肘静脉血。采用葡萄糖氧化酶法测量空腹血糖(FPG)及餐后2 h血糖(2 h PG)。采用放射免疫法测定血清空腹胰岛素(FINS)及2 h FINS,胰岛素抵抗指数(HOMA-IR)=(FPG×FINS)/22.5。离子交换高压液相分离法测定糖化血红蛋白(HbA1c)。采用日本奥林巴斯AU5400全自动生化分析仪检测甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)。
1.4血清炎性因子的测定采用ELISA法检测血
清肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、白细胞介素10(IL-10)、转化生长因子β1(TGF-β1)、C反应蛋白(CRP),操作步骤均按ELISA试剂盒说明书进行。
2 结果
2.1两组年龄、体质量、BMI、腰围比较见表1。
表1 两组年龄、体质量、BMI、腰围比较()

表1 两组年龄、体质量、BMI、腰围比较()
注:与NAFLD组比较,bP<0.01。
组别 n 年龄(岁)体质量(kg)BMI(kg/m2)腰围(cm)NAFLD组83 54.3±10.2 72.5±9.8 26.7±3.2 93.1±8.5 非NAFLD组 86 58.7±11.4b66.4±10.7b23.6±3.3b85.7±8.0b
2.2两组血脂比较见表2。
表2 两组血脂比较(mmol/L,)
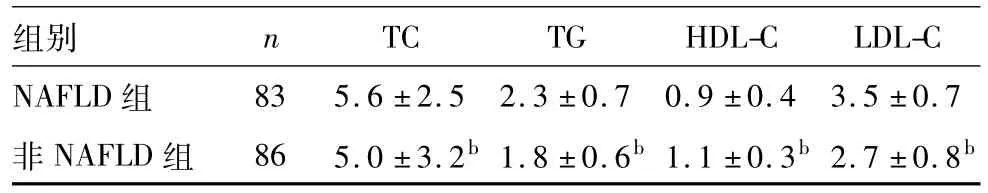
表2 两组血脂比较(mmol/L,)
注:与NAFLD组比较,bP<0.01。
组别 n TC TG HDL-C LDL-C NAFLD组83 5.6±2.5 2.3±0.7 0.9±0.4 3.5±0.7 非NAFLD组 86 5.0±3.2b1.8±0.6b1.1±0.3b2.7±0.8b
2.3两组肝功能指标比较见表3。
表3 两组肝功能指标比较(U/L,)

表3 两组肝功能指标比较(U/L,)
注:与NAFLD组比较,bP<0.01。
组别 n GGT ALT AST NAFLD组83 88±11 50±7 48±8 非NAFLD组 86 56±10b 33±5b 32±6b
2.4两组糖代谢指标及胰岛功能比较见表4。
2.5 NAFLD与非NAFLD组炎性因子水平比较见表5。
2.6肝酶正常组与肝酶升高组炎性因子水平比较见表6。
表4 两组糖代谢指标及胰岛功能比较()

表4 两组糖代谢指标及胰岛功能比较()
注:与NAFLD组比较,bP<0.01。
组别 n FPG(mg/L) 2 h PG(mmol/L) HbA1c(%) FINS(mU/L) 2 h INS(mU/L)HOMA-IR NAFLD组 83 10.3±2.1 15.4±3.2 8.4±1.2 15.6±6.4 53.8±9.3 7.6±3.9 非NAFLD组 86 9.9±2.6 16.0±2.9 8.2±1.1 12.1±5.9b 40.1±8.2b 3.9±2.6b
表5 NAFLD组与非NATLD组血清炎性因子水平比较()

表5 NAFLD组与非NATLD组血清炎性因子水平比较()
注:与NAFLD组比较,bP<0.01。
组别 n hs-CRP(mmol/L) TNF-α(pg/mL) IL-6(pg/mL) IL-10(pg/mL) TGF-β1(pg/mL)NAFLD组 83 2.76±0.76 3.21±0.54 2.62±0.73 4.53±1.22 3.79±0.56 非NAFLD组 86 1.46±0.45b 2.10±0.62b 1.86±0.62b 5.72±1.21b 4.28±0.71b
表6 肝酶正常组与肝酶升高组血清炎性因子水平比较()

表6 肝酶正常组与肝酶升高组血清炎性因子水平比较()
注:与肝酶正常组比较,bP<0.01。
组别 n hs-CRP(mmol/L) TNF-α(pg/mL) IL-6(pg/mL) IL-10(pg/mL) TGF-β1(pg/mL)肝酶正常组 45 2.21±0.52 2.68±0.72 3.18±0.23 7.01±0.66 5.89±0.65肝酶升高组 38 3.09±0.44b 4.12±0.69b 4.68±0.67b 6.30±0.89b 3.92±0.58b
2.7相关分析以是否合并NAFLD为因变量,以血糖、血脂、hs-CRP、BMI等26个可疑影响因素作为自变量,进入模型的TG、ALT、GGT、BMI与NAFLD的发生有关(TG OR = 2.156,95% CI 1.240~3.567; ALT OR =13.421,95% CI 1.628~110.051; GGT OR = 12.427,95% CI 1.147~111.548; BMI OR =2.559,95% CI 1.087~5.213)。hs-CRP、TNF-α、IL-6与HOMA-IR、ALT、GGT、TG呈正相关; IL-10、TGF-β1与HOMA-IR、ALT、GGT、TG呈负相关(P均<0.01)。
3 讨论
临床观察发现,T2DM患者常伴发NAFLD。据文献报道,50%~70%的T2DM患者伴有NAFLD,而40%~50%的NAFLD患者伴有不同程度的糖耐量异常[1,2]。本研究结果显示,与非NAFLD组相比,NAFLD组的患者发病年龄轻、腹型肥胖、TG升高、HDL-C降低、FINS及2 h INS水平高,且该组的HOMA-IR高,说明T2DM伴有NAFLD的患者有更严重的胰岛素抵抗。
NAFLD包括非酒精性单纯性脂肪肝、非酒精性脂肪性肝炎及其相关的肝硬化和肝细胞癌,多见于男性[3]。由于NAFLD患者往往同时伴有代谢综合征的多种组分,如肥胖、血脂异常、T2DM,因此NAFLD被认为是代谢综合征在肝脏的表现。
动物实验显示,高糖高脂喂养的大鼠发生肥胖后,内脏的脂肪细胞增生肥大,脂肪组织氧分压下降,血流量下降,毛细血管密度稀疏,致使脂肪组织缺氧而发生坏死和炎性浸润。浸润脂肪组织的巨噬细胞释放大量炎性介质,如TNF-α、CRP,引起慢性炎症反应[4~6]。另一方面,由于肥大的脂肪细胞对
脂质的缓冲容量变小,使许多脂质[主要为游离脂肪酸(FFA)]随循环在非脂肪组织,如肝胰等脏器蓄积,导致脂质异地蓄积。血液和肝脏中显著增多的FFA在早期可促进胰岛分泌胰岛素;但长期持续高FFA血症则致使周围组织对胰岛素的敏感性下降,抑制胰岛β细胞的胰岛素信号传导通路,从而导致胰岛素抵抗和胰岛素分泌障碍。本研究结果显示,NAFLD组的HOMA-IR高,CRP、TNF-α、IL-6、IL-10、TGF-β1均与HOMA-IR正相关,说明这些因子启动和参与了NAFLD慢性炎症反应,诱导胰岛素抵抗。
TNF-α、IL-6、CRP等细胞因子作为机体发生慢性炎症的早期标志物,在NAFLD、胰岛素抵抗和T2DM的相互关系中发挥着桥梁作用。如通过脂解作用,使FFA水平升高;改变脂因子的生成,使致炎因子增多,而抗炎因子生成减少;影响胰岛素信号传导系统,促使胰岛素抵抗形成;造成线粒体功能障碍,诱发氧化应激[7,8]。
当NAFLD由单纯性脂肪肝进展到脂肪性肝炎时,表现为肝细胞的变性坏死、炎症、纤维化。此时,肝功能检测多表现为肝酶的轻中度升高。目前认为,肝酶水平升高,其本质反映了肝脂肪变性和肝胰岛素抵抗。本研究结果显示,肝酶升高组的hs-CRP、TNF-α、IL-6水平高于肝酶正常组,而IL-10、TGF-β1的水平则低于肝酶正常组。这说明不同类型的炎性因子在NAFLD病变进展中发挥着不同的作用。国外研究报道,由于TNF-α在血液及肝组织的浓度升高,推测TNF-α可能触发肝纤维化的开始,使病变由单纯性脂肪肝向脂肪性肝炎转变。予以TNF-α抑制剂可明显改善脂肪性肝炎的病变程度[9,10]。IL-6和CRP在肝酶升高组也明显升高,说明二者也是引起NAFLD进展的独立危险因素。但Yoneda等[11~13]的研究报告显示,糖尿病伴有单纯性脂肪肝组IL-6水平和脂肪性肝炎组相比无统计学差异;在脂肪性肝炎及严重肝纤维化的患者中可见CRP水平明显升高,本研究的结论与此不完全一致,考虑与不同人种、实验方法不同有关。IL-10、TGF-β1也是与肝脏病变密切相关的细胞因子[14,15],二者在肝酶升高组水平下降,说明二者具有抗肝纤维化的作用。
肝穿刺活组织检查目前被认为是诊断NAFLD、判断病变程度的金标准[7],然而由于其费用昂贵,有创性、病理标本结果判断时受人为主观因素影响,限制了其在临床的广泛应用。本研究证实,在T2DM合并NAFLD患者中,hs-CRP、TNF-α、IL-6、IL-10、TGF-β1等炎性细胞因子随着肝功能肝脏病变的进展而发生改变,检测这些炎性因子水平可用来判断T2DM是否合并NAFLD,以及其肝脏病变程度。
参考文献:
[1]Howard C,Masuoka,Naga C,et al.Nonalcoholic fatty liverdisease: an emerging threat to obese anddiabetic individuals[J].Ann N Y Acad Sci,2013,28(5): 1-17.
[2]Fan JG,Li F,Cai XB,et al.Effects of nonalcoholic fatty liverdisease on thedevelopment ofmetabolicdisorders[J].J Gastroenterol Hepatol,2007,22(7): 1086-1091.
[3]毕宇芳,刘宇.非酒精性脂肪性肝病与2型糖尿病:关系及研究进展[J].内科理论与实践,2011,4(6): 265-269.
[4]赵玲,杜鹃,徐勉,等.2型糖尿病合并非酒精性脂肪性肝病与胰岛素抵抗及血脂代谢紊乱的关系[J].中华内分泌代谢杂志,2012,28(1):16-20.
[5]Pasaricam,Sereda OR,Redman LM,et al.Reduced adipose tissue oxygenation in human obesity: evidence for rarefaction,macrophage chemotaxis,and inflammation without an angiogenic response[J].Diabetes,2009,58(3): 718-725.
[6]Neuschwancler-Tetri BA.Hepatic Lipotoxicity and the pathogenesis of nonalcoholic steatohepatitis: the central role of nontriglyceride fatty acidmetabolites[J].Hepatology,2010,52(2): 774-788.
[7]Leite NC,Salles GF,Cardoso CR,et al.Serum biomarkers in type 2diabetic patients with non-alcoholic steatohepatitis and advanced fibrosis[J].Hepatol Res,2013,43(5): 508-515.
[8]Rabelo F,Oliveira CP,Faintuch J,et al.Pro-and anti-inflammatory cytokines in steatosis and steatohepatitis[J].Obes Surg,2010,20(7): 906-912.
[9]Satapahty SK,Garg S,Chauhan R,et al.Beneficial effects of tumor necrosis factor-alpha inhibition by pentoxifyline on the clinical,biochemical,andmetabolic parameters of patients with nonalcoholic steatohepatitis[J].Am J Gastroenterol,2004,99(10): 1946-1952.
[10]Lee YM,SutediadS,Wai CT,et al.A randomized controlled pilot study of Pentoxifylline in patients with non-alcoholic steatohepatitis(NASH)[J].Hepatol Int,2008,2(2): 196-201.
[11]Yonedam,Mawatari H,Fujita K,et al.High-sensitivity C-reactive protein is an independent clinical feature of nonalcoholic steatohepatitis(NASH)and also of the severity of fibrosis in NASH [J].J Gastroenterol,2007,42(7): 573-582.
[12]Park SH,Kim BI,Yun JW,et al.Insulin resistance and C-reactive protein as independent risk factors for non-alcoholic fatty liverdisease in non-obese Asianmen[J].J Gastroenterol Hepatol,2004,19(6): 694-698.
[13]Hanley AJ,Williams K,Festa A,et al.Livermarkers anddevelopment of themetabolic syndrome: the insulin resistance atherosclerosis study[J].Diabetes,2005,54(1): 3140-3147.
[14]Peng XD,Dai LL,Huang CQ,et al.Relationship between anti-fibrotic effect of Panax notoginseng saponins and serum cytokines in rat hepatic fibrosis[J].Biochem Biophys Res Commun,2009,388(1): 31-34.
[15]Rallon NI,Barreiro P,Soriano V,et al.Elevated TGF-β1levelsmight protect HCV/HIV-coinfected patients from liver fibrosis[J].Eur J Clin Invest,2011,41(1): 70-76.
收稿日期:( 2015-07-04)
基金项目:沈阳市科技计划项目(F14-158-9-29)。
文章编号:1002-266X(2015)37-0034-03
文献标志码:B
中图分类号:R587.1
doi:10.3969/j.issn.1002-266X.2015.37.011
