蛛网膜下腔出血后内皮素受体(ETA/ ETB) 不平衡表达在大鼠基底动脉痉挛中的作用
2015-02-18孙雷涛宋锦宁杜洪澎王晓红李泽福
孙雷涛,宋锦宁,杜洪澎,王晓红,李 勐,李泽福
(1.滨州医学院附属医院神经外科、实验中心,山东滨州 256600;2.西安交通大学医学部第一附属医院神经外科,陕西西安 710061)
迟 发 性 脑 血 管 痉 挛 (delayed cerebral vasospasm,DCVS)由ECKER首次提出以来,DCVS引起的缺血性脑损伤是影响SAH患者预后的主要因素之一[1-2]。目前,大量研究表明,DCVS与内皮素-1(endothelin-1,ET-1)有 关[3-4]。ET-1 通 过 ETA/ETB两种不同受体动态地调节着血管紧张度[5]。本研究通过建立SAH后脑血管痉挛(cerebral vasospasm,CVS)模型,动态观察了ETA/ETB两种不同受体与CVS发生的关系,旨在阐明内皮素受体不平衡表达在CVS中的作用。
1 材料与方法
1.1 实验动物及分组 健康雄性SD大鼠60只(西安交通大学实验动物中心),体质量240~260g,在标准环境饲养,室温(24±2)℃,24h昼夜循环光照,术前术后自由摄食饮水。动物随机分为SAH模型组、盐水对照组、假手术对照组(6只)、正常对照组(6只)。SAH模型组、盐水对照组根据建立模型后的不同时间段分为4个亚组,分别是:建模后的2d组、3d组、7d组和14d组。每个亚组6只动物。
1.2 大鼠SAH模型制作及标本取材 大鼠自体血二次注入枕大池SAH模型制作参照PRUNELL等[6]实验方法,应用100g/L水合氯醛(3.5mL/kg)腹腔麻醉后取俯卧头低位,在手术显微镜下暴露寰枕筋膜,尾动脉取血0.4mL,用4号头皮针缓慢进针刺破寰枕筋膜,至清亮脑脊液(CSF)流出,将未抗凝自体血0.3mL缓慢注入(用时20min)枕大池,注射后穿刺点压迫5min,耳脑胶封闭穿刺点并保持头低位30min以上。48h后依上法二次操作,建立SAH的DCVS模型。正常对照组不进行任何手术操作。盐水对照组建立方法同SAH组,但注入等量的37℃生理盐水。穿刺对照组仅行枕大池穿刺并见到CSF流出,48h后进行第二次穿刺。时间按第2次注血造模成功后开始计算。
各组动物达到预定时间后取材,动物麻醉后,37℃、250mL的生理盐水重力作用下沿大鼠体循环快速灌注,而后用40g/L多聚甲醛溶液400mL进行免疫荧光行灌注固定。迅速断头取脑,在桥脑中央处横断,取保留基底动脉上段的脑片。行常规固定、脱水、透明、浸蜡、包埋后冠状切片,片厚约7μm,每个标本常规切7层,两层用于染色,剩余应用于血管截面积计算。
1.3 形态学观察 切片在常规HE染色后,在光学显微镜下观察基底动脉形态学变化,并应用图像采集与分析系统(Q550W,Leica公司,德国)收集数据。计算每只动物基底动脉3层切片截面积,求均值。
1.4 免疫荧光染色 应用兔抗鼠ETA/ETB受体(ETAR/ETBR)单克隆一抗及羊抗兔荧光二抗(博士德公司)行免疫荧光染色。切片置于OLYMPUS(IX71-A21PH,日本)荧光显微镜400倍下照相并应用Image-ProPlus图像分析软件进行转化灰度分析。
1.5 数据分析 用SPSS 13.0统计软件对实验数据进行统计分析。先行方差齐性检验,方差齐的指标采用One-way ANOVA检验的方差分析,并行LSD法进行组间两两比较,方差不齐的指标则用Kruskal-Wallis法行秩和检验。计量资料的结果采用Mean+SEM表示,P<0.05为差异具有统计学意义。
2 结 果
2.1 基底动脉的形态学观察结果 SAH实验组造模后2d血管内皮细胞即出现褶皱,血管平滑肌收缩,血管平滑肌层厚度增大,基底动脉截面积较盐水对照组出现显著下降(P<0.05),3d时狭窄到达最高峰,在7d以后直到14d时血管直径逐渐恢复正常。在注血手术后,大鼠基底动脉出现了明显规律性脑血管收缩(图1)。

图1 大鼠造模后基底动脉面积的动态变化Fig.1 Dynamic changes of the area of the basilar artery after CVS
2.2 SAH后基底动脉ETA/ETB受体免疫荧光染色及半定量分析 免疫荧光染色结果显示,正常、假手术组、盐水对照组可见ETA/ETB受体蛋白较弱表达。SAH后2d基底动脉ETA受体已有增强,3d达高峰,此后逐渐减弱,主要集中在血管内皮层;而ETBR在7d达高峰,此后荧光强度逐渐减弱,3d时在内皮细胞层荧光强度升高表现的更加明显,而7、14d时血管平滑肌中荧光强度升高较明显(图2)。荧光灰度分析显示总荧光强度ETAR最高峰出现在第3天,而ETBR出现在第7天。SAH后2、3、7、14d时ET受体表达与正常对照组相应时间点比较差异有统计学意义(P<0.05)。ETB受体在SAH实验组中2~3d时在内皮细胞层中表达增强更明显,而在7d时平滑肌细胞层中的表达增强更明显(图3)。
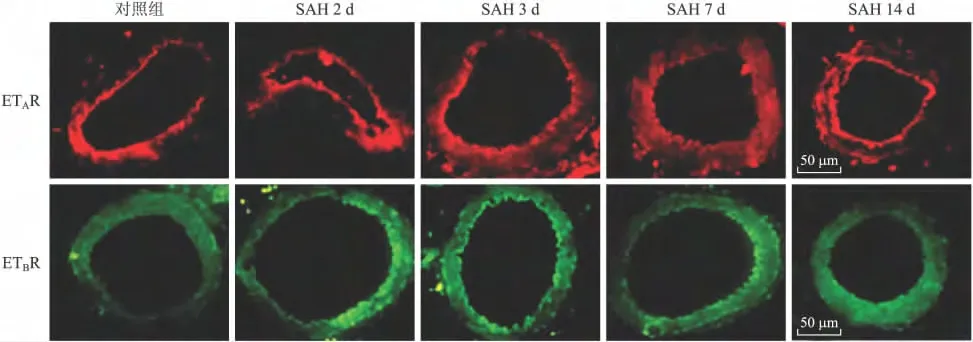
图2 大鼠基底动脉ET受体免疫荧光染色结果Fig.2 Immunofluorescence staining results of ET receptor in the rat basilar artery

图3 大鼠基底动脉内皮细胞层与平滑肌细胞层中ETBR受体免疫荧光灰度值的表达变化Fig.3 Changes of immunofluorescence gray value of ETBR in the endothelial and smooth muscle cells of rat basilar artery
3 讨 论
30年来对DCVS的研究,比较公认可能是多种因素共同作用的结果,血管舒缩因子的不平衡在其中起重要作用[7-8]。ET-1与ETA受体结合后会激活磷脂酶C,进而使Ca2+内流和PKC激活,此时磷脂酶A2和D也被激活使甘油二脂(DAG)持续升高,后者又是PKC的内源性激动剂。与存在于血管内皮细胞的ETB1受体结合,发挥血管依赖性松弛作用,而与存在于血管平滑肌细胞的ETB2受体结合,发挥与ETA受体相同的缩血管效应。但对于ET-1的血管收缩信号机制仍不十分清楚[9]。
本研究在公认的Delgado法大鼠枕大池穿刺二次注血法建立大鼠的CVS模型基础上,改进传统的股动脉或股静脉血注入。选用大鼠尾动脉血注入,以最大限度减少手术并发症及动物死亡率[10-11]。从基底动脉形态学观察可以看出造模后在3~7d时发生了明显的血管痉挛,与临床发生DCVS的时程一致。此方法可以定量、定时、定部位的注血并良好模拟了DCVS的病理过程。同时,本研究中取材采用了37℃生理盐水心脏灌注及快速取脑液氮保存的方法,使得脑灌注压尽量保持与正常血压一致,而且很好阻滞了脑血管发生快速血压调节引起的细胞内信号转换。但是,目前的实验技术及生化试剂限制,仍存在不能很好区分ETB受体的亚型表达改变、表达部位的准确定位、很难对表达蛋白进行定量检测等问题。
本实验结果显示大鼠SAH后DCVS模型中基底动脉内皮细胞中ETA/ETB受体均有表达升高,而更为重要的是在SAH后7d时血管平滑肌中ETB受体的表达达到高峰。分析其原因可能与SAH后CVS的缓解有关,而内皮细胞的ETB受体短暂表达上调,可能与ETA受体共同参与了DCVS的过程。HANSEN等[12]研究发现SAH后大脑中动脉、基底动脉ETB受体表达升高而ETA受体没有变化,后交通动脉两者均无变化。而ANSAR等[13]研究了不同血管对ET-1反应性,发现在离体培养条件下仅有ETB受体的表达上调。而也有类似研究发现DCVS时ETB受体的表达下调,并提出应用ETB受体阻滞剂不能很好缓解脑血管收缩[14-15]。分析这种ET受体表达的不同结果,我们认为可能是由于离体条件下血管灌注压的瞬时改变,引起了血管收缩性受体的表达调节变化以及与脑血管取材方法、取材时间有关。因此,对于ET受体表达的研究应该更加注重体内研究以及取材前的脑灌注压维持。本实验结果显示,SAH后3~7d时发生了明显基底动脉的血管收缩;ET受体的蛋白及mRNA水平的表达表现一致。内皮细胞中ETA受体与ETB受体3d时表达显著升高可能参与了DCVS的发生,而血管平滑肌中ETB受体7d时的表达升高,可能与7d后DCVS的缓解有关联;ETB受体两种亚型的差异性表达可能是DCVS中的原因。
ET-1在DCVS的作用机制复杂。本研究结果表明两种ETA/ETB受体的差异性表达在SAH后CVS中起重要作用。ETB受体亚型在脑血管各层中具体表达差异有待进一步研究。但本研究结果提示,深入研究CVS中ET受体下游调控的具体分子机制和有关下游各种蛋白激酶表达变化,及其与ET受体表达上调的关系,可以采用活体免疫荧光自显影、基因干扰或敲除、高特异性单克隆抗体等蛋白工程与基因工程技术进一步探讨。
[1]ECKER A,RIEMENSCHNEIDER PA.Arteriographic demonstration of spasm of the intracranial arteries.With special reference to saccular arteial aneurisms[J].Neurosurgery,1951,8(6):660-667.
[2]HANSEN-SCHWARTZ J,VAJKOCZY P,MACDONALD RL,et al.Cerebral vasospasm:looking beyond vasoconstriction[J].Trends Pharmacol Sci,2007,28(6):252-256.
[3]MA J,HUANG S,MA L,et al.Endothelin-receptor antagonists for aneurysmal subarachnoid hemorrhage:an updated meta-analysis of randomized controlled trials[J].Crit Care,2012,16(5):198.
[4]EDVINSSON LI,POVLSEN GK.Vascular plasticity in cerebrovascular disorders[J].J Cereb Blood Flow Metab,2011,31(7):1554-1571.
[5]KASTNER S,OERTEL MF,SCHARBRODT W,et al.Endothelin-1 in plasma,cisternal CSF and microdialysate following aneurysmal SAH[J].Acta Neurochir(Wien),2005,147(12):1271-1279.
[6]EICKER SO,HOPPE M,ETMINAN N,et al.The impact of experimental preconditioning using vascular endothelial growth factor in stroke and subarachnoid hemorrhage[J].Stroke Res Treat,2013,2013:948783
[7]KEYROUZ SG,DIRINGER MN.Clinical review:Prevention and therapy of vasospasm in subarachnoid hemorrhage[J].Crit Care,2007,11(4):220.
[8]XIE A,AIHARA Y,BOURYI VA,et al.Novel mechanism of endothelin-1-induced vasospasm after subarachnoid hemorrhage[J].J Cereb Blood Flow Metab,2007,7(10):1692-1701.
[9]VERGOUWEN MD.Effect of endothelin-receptor antagonists on delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage remains unclear[J].Stroke,2009,40(12):714-716.
[10]DELGADO TJ,BRISMAR J,SVENDGGARD NA.Subarachnoid hemorrhage in the rat.Angiography and fluorescence microscopy of the major cerebral arteries[J].Stroke,1985,16(4):595-602.
[11]LIN CL,CALISANELLER T,UKITA N,et al.A murine model of subarachnoid hemorrhage induced cerebral vasospasm[J].Neurosci Methods,2003,123(1):89-97.
[12]CAO L,CAO YX,XU CB,et al.Altered endothelin receptor expression and affinity in spontaneously hypertensive rat cerebral and coronary arteries[J].PLoS One,2013,8(9):e73761.
[13]ANSAR S,EDVINSSON L.Subtype activation and interaction of protein kinase C and mitogen-activated protein kinase controlling receptor expression in cerebral arteries and microvessels after subarachnoid hemorrhage[J].Stroke,2008,39(1):185-90.
[14]KONCZALLA J,VATTER H,WEIDAUER S,et al.Alteration of the cerebrovascular function of endothelin B receptor after subarachnoidal hemorrhage in the rat[J].Exp Biol Med(Maywood),2006,231(6):1064-1068.
[15]VATTER H,KONCZALLA J,WEIDAUER S,et al.Characterization of the endothelin-B receptor expression and vasomotor function during experimental cerebral vasospasm[J].Neurosurgery,2007,60(6):1100-1109.
