非平衡负离子方法还原CO2合成乙醇
2015-02-17晋杜娟马晓迅徐惠芳夏亚沈
晋杜娟,伍 星,马晓迅,郭 利,徐惠芳,夏亚沈
(1.西北大学 化工学院/陕北能源先进化工利用技术教育部工程研究中心/陕西省洁净煤转化工程技术研究中心,陕西 西安 710069;2.HyChar 研究所,美国麻州牛顿 02466)
·化学与化学工程·
非平衡负离子方法还原CO2合成乙醇
晋杜娟1,伍 星1,马晓迅1,郭 利1,徐惠芳1,夏亚沈2
(1.西北大学 化工学院/陕北能源先进化工利用技术教育部工程研究中心/陕西省洁净煤转化工程技术研究中心,陕西 西安 710069;2.HyChar 研究所,美国麻州牛顿 02466)
常压下,利用直流负电晕放电技术使CO2和水蒸汽合成燃料。 结果表明:在反应温度105oC、气速0.05 L/min、放电频率10.245 kHz、水的进料流速3.43 mL/min时, CO2的转化率为15.9%,乙醇和甲醇的产率分别为3.21%和2.23%。此外,探讨了磁场对反应的影响并对CO2和水蒸汽合成乙醇的反应机理进行了初步的研究。
负电晕放电;CO2资源化利用;非平衡负离子;乙醇
CO2作为最主要的温室气体之一,同时也是最为丰富的C1资源。目前的研究倾向于将CO2看作廉价的碳资源,采用化学方法将其转化为大宗化工原料。这不仅可以固定CO2,还可以获得多种高附加值的化工产品。CO2资源化利用正成为21世纪环境和能源问题领域最有希望和备受关注的方向之一[1-3]。
然而,CO2分子非常稳定[4],将其活化转化还需借助催化剂、气体分离膜等技术及需要输入光、电等能量,操作条件苛刻,对反应设备的要求较高,能耗严重且分解效果差[5-10]。
虽然传统的非平衡等离子技术[11-14]可能驱动CO2的分解,有益于CO2在低温等离子环境下的转化,但产物的低选择性和高能耗牵制了该技术的工业化应用。 本研究提出了负电晕气相反应方法,以期最为有效地还原CO2。负电性离子或气体易于黏附自由电子形成负离子进行化学反应的性质,已经引起了众多研究者的关注[15-18]。负电性气体分子,包括NH3-, I-和H2O-,由于其电子亲合力,这种电负性气体具有强电子亲和力和捕获电子后形成长寿命负离子的特点。这些气体一旦带电就可能有助于反应快速进行[19-22]。CO2是一种典型的电负性气体,在电子放电作用下,一方面,它可以黏附多余的电子形成稳定的负离子或电负性气体;另一方面,CO2可被其他黏附电子的气体或阴离子气体,诸如H2O-,在负电晕环境下还原。
本研究采用负电晕放电处理CO2,经过负电晕技术,将其还原的过程。本文重点研究了CO2和水蒸汽经过负电晕放电合成乙醇和少量甲醇的过程,以及相关的影响因素,并对反应的机理进行了初步的探讨。
1 实验部分
1.1 实验装置及流程图
如图1所示,先用N2(99.99%,体积分数)吹扫整个气路15min,保证整个反应体系气密性良好且排尽气路的空气,以免在测量过程中对实验结果造成影响。然后关闭N2,打开CO2(99.99%,体积分数)气瓶,气体流经质量流量计后进入反应区,与此同时,储水罐中的水经过泵定量、蒸汽发生器加热、完全汽化后进入反应区。最后,CO2和水蒸汽在放电区发生氧化还原反应,放电后产生的气体、液体和未反应的组分一起通过冷阱冷凝,收集液体产品。对气相产物通过质谱和色谱进行在线定性、定量分析,液体产物收集后采用气相色谱-质谱(GC-MS)进行分析。

图1 CO2/H2O实验装置图Fig.1 Diagram of the experimental setup CO2/H2O
1.2 实验设备及试剂
SJ-2000E型高压电源(广东佛山顺德佳富塑料制品有限公司),其最高负电压为-15kV (3kW)。本研究于高压输出端连接一套半波整流硅堆,使其能够稳定的产生直流负高压。实验所用仪器设备还包括BT100N(MC Series)水蒸汽发生器(苏州淳元环境技术有限公司)、美国AIC1000型负离子浓度检测仪、北京中兴伟业SXKV型数显控温电加热套、德国布鲁克公司的TGA-IR红外光谱分析仪及日本岛津QP2010 GC/MS仪。
液相产品的分析
1.3 气相色谱质谱联用(GC-MS)分析
由图2可知,CO2和水蒸汽经过放电后主要生成两种物质,在保留时间为1.53min和1.65min时出峰,根据谱图库检索NIST08.LIB和NIST08s.LIB,可以得出1.53min处为CH3OH,1.65min处为CH3CH2OH。

图2 液相产物的色谱图Fig.2 Chromatogram of liquid products
1.4 反应效果的评价
通过质谱的在线定性、半定量分析和液相产物的GC-MS分析,得出CO2和水蒸汽放电后的气相产物主要是一氧化碳和氢气,液相产物主要是甲醇和乙醇。
CO2的转化率:
XCO2=

(1)
产物的选择性:
Si=
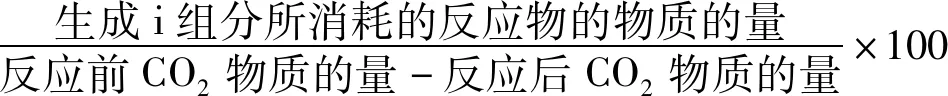
(2)
产物收率:
Y(含碳原子组分=S(含碳原子的组分)×XCO2,
(3)
YH2=SH2×XH2O。
(4)
2 不同因素对CO2转化率的影响
2.1 不同流速和水蒸汽含量的影响
实验过程中控制直流电晕放电的频率为10.245kHz,反应器的温度为105℃,其他条件保持不变。考察放电区混合气中CO2转化率随着水的进料速率的变化,如图3所示。
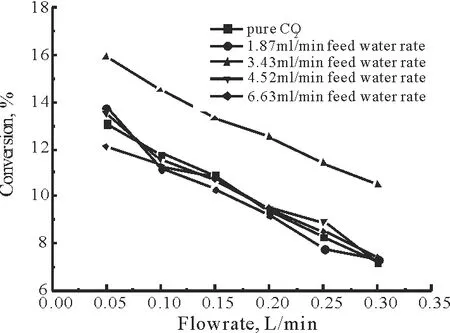
图3 气体流速对CO2转化率的影响Fig.3 Effect of gas flow on CO2 conversion
由图3可以看出,无论是纯CO2还是加入不同含量水蒸汽的CO2进行放电,CO2的转化率随着气体体积流率的不断增大持续降低。这可能是因为,在一定的输入功率下,高能电子的数目不变,随着气体流量的增大,CO2在反应体系中的停留时间减少,进而CO2与高能电子作用的机率减少,被活化CO2分子的比例降低,导致CO2的转化率降低。此外,从图3还可以看出,不同水蒸汽含量对CO2的转化率略有影响。但是,规律不太显著,水蒸汽在放电过程中可以生成自由基OH·,这种活性组分可以促进CO2的活化,随着水蒸汽含量的升高,进入反应系统的水蒸汽的流速增大,使得反应组分的停留时间缩短,反过来阻碍CO2的转化。因此,水进料速率为3.43 mL/min时,CO2的转化率最高。
当水蒸汽含量分别为1.87,3.43,4.52及6.63(mL/min)时,放电后产物的选择性随着CO2流速的变化,见图4-7所示。由图4-7可以看出,CO、甲醇以及乙醇的选择性随着CO2流量的增加而减少。原因可能是,①由于随着流量的增加,CO2的转化率降低,导致产生的CO减少且部分CO参与化学反应生成醇类,故CO在气体流速为0.05~0.3L/min范围内减少;②H2,CH3OH以及CH3CH2OH的选择性主要由水蒸汽量和CO2流量两方面因素共同决定,随着流量的增加,负离子化的水蒸汽量减少。故而,导致由水蒸汽参与反应得到产物的选择性降低[23]。

图4 水的流速为1.87 mL/min时,产品选择性的变化规律Fig.4 The effect of flow rate (1.87 ml/min) on product selectivity

图5 水的流速为3.43 mL/min时,产品选择性的变化规律Fig.5 The effect of flow rate (3.43 ml/min) on product selectivity

图6 水的流速为4.52 mL/min时,产品选择性的变化规律Fig.6 The effect of flow rate (4.52 ml/min) on product selectivity
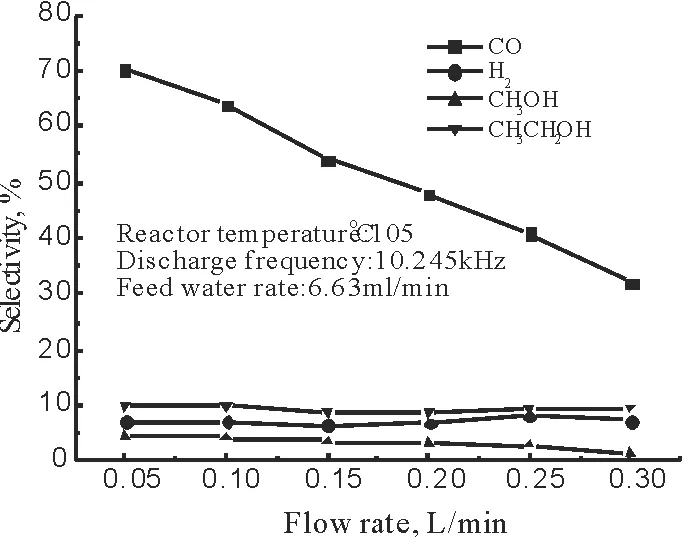
图7 水的流量为6.63 mL/min时,产品选择性的变化规律Fig.7 The effect of flow rate (6.63 ml/min) on product selectivity
2.2 不同填料和流速对CO2转化率的影响
实验采用无极性的玻璃填料和磁子填料,考察不同流速0.05~0.3 L/min对CO2转化率的影响,如图8所示。

图8 流量和填料对CO2转化率的影响Fig.8 Effects of flow rate and packing on the conversion of CO2
在考察范围内,CO2的转化率随着流速的增加而减少,原因可能是CO2在反应体系中的滞留时间缩短,导致大量的气体来不及与高能电子相互作用而未负离子化参与反应便离开反应器。此外,在一定程度上使用填料可以提高CO2的转化率,且有极性的磁子填料相比于无极性的玻璃填料而言,更有利于CO2的转化。由此可见,填料可以延长组分在反应器的停留时间,强化组分与高能电子的相互作用。
不同填料和流量对CO2转化为产物CO的产率的影响,如图9所示。
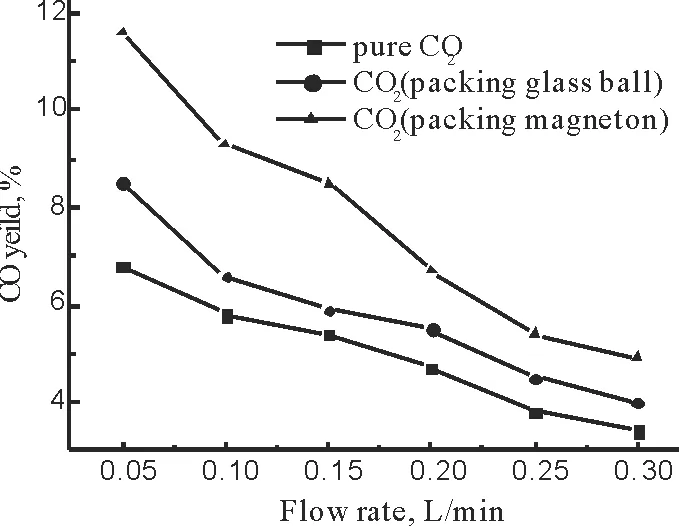
图9 流量和填料对CO产率的影响Fig.9 Effects of flow rate and packing on CO yield
由图9可以得出,产物中CO的选择性顺序由小到大的顺序依次为:纯CO2<无极性的玻璃填料<有极性的磁子填料。这可能是由于当气体通过反应系统流经放电区后继续向前流动穿过磁子填料区,磁力线的束缚作用促使放电区集中了更高浓度的分子、电子、带电等物种。这些物种在高密度的空间内增强了彼此间的相互碰撞的机率,加强还原环境中各种组分的充分反应,使得反应物的转化率得以提高,产物的产率也相应提高[24]。
2.3 不同放电频率对CO2转化率的影响
当反应温度为100℃,流量为0.05L/min,水进料速量为3.43 mL/min,其他条件保持不变,考察不同放电频率对CO2的转化率、产物的产率以及产物选择性的影响,如图10所示。

图10 放电频率对CO2转化率的影响Fig.10 Effect of discharge frequencies on the conversion of CO2
由图10可以看出,随着放电频率不断的增加,CO2的转化率也随着增加,当放电频率在所考察的范围内达到最大10.245 kHz时,CO2的转化率可以达到15.9%。出现上述现象的原因可能是由于随着放电频率的不断增高,单位时间、单位体积内由放电针尖释放的电子数目更多,使得反应器空间中更多的气体分子被电离、黏附形成活化分子,导致反应区负离子浓度很高,负离子化的水蒸汽分子也越多,越有助于CO2分子与负离子化的水蒸汽发生氧化还原反应,故CO2的转化率不断增高。此外,在不同放电频率时,添加水蒸汽比纯CO2的转化率要高,这主要是添加水蒸汽后,水蒸汽可以负离子化,负离子化的水蒸汽携带了高能电子能够使CO2分子加速,从而促进CO2的转化。放电频率对产物选择性的影响如图11所示。
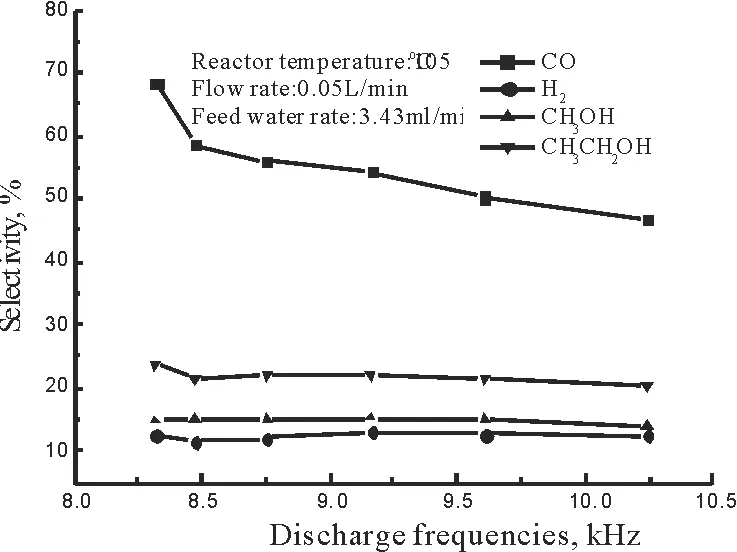
图11 放电频率对产物选择性的影响Fig.11 Effect of discharge frequencies on product selectivity
由此可知,CO的选择性在实验范围内,随着放电频率的增加而减小,H2,CH3OH和CH3CH2OH的选择性略有增加。分析原因可能是因为随着放电频率的增加,放电区集聚的带电粒子数增多,进而导致与CO发生碰撞的机率增大,这样在一定程度上发生化学反应的概率增大,更有利于选择性醇类物质的生成,故CO的转化率会呈现出下降的趋势[25]。
2.4 反应机理的初步探讨
CO2是一种典型的电负性气体,将其置于高能电子的强还原环境中时,会发生如下反应:
CO2+e-→CO+1/2O2+e-
(5)
(6)
H2O分子是一种极性分子,常温常压下十分稳定,在负电晕放电下由于产生高能电子,电子可以黏附水蒸汽分子,形成带负电的离子。其电负性活性组分的形成及与CO2作用生成产物的可能机理如下所示:
H2O+e-→H2O-
(7)
3H2O-+2CO2→CH3CH2OH+3O2+3e-
(8)
(9)
3H2O-+2CO→CH3CH2OH+2O2+3e-
(10)
C2H5OH+H2O-→4H2+2CO
(11)
2H2+CO+e-→CH3OH-
(12)
由于针尖放电区构造的强还原电子结构使能量为4~5eV的高能电子黏附于低速运动的分子上,促使电中性分子的动能增加形成电负性分子。这种带电的分子由于动能的增加,在反应系统中增加了与其他组分碰撞的概率,使得反应(7)~(12)得以发生,较高能量的分子因为发生了化学反应失去多余的电子,从高能态组分变为低能态组分释放多余的能量,最终反应系统达到一种动态的能量平衡状态。
另外,水分子中O—H的键能高达497 kJ/mol(约5.15 eV), 而乙醇分子中的O—H,C—H,C—O和C-—C键能依次为4.54 eV,4.33 eV,4.05 eV 以及3.78 eV。大多数金属针尖放电可以输出的最大能量是5 eV,这不足以使水分子分解,只能是针尖释放的电子黏附于水分子。另外,根据乙醇分子中不同原子间键能均小于5 eV,可以推断出CO2和水蒸汽分子经过放电后生成的乙醇很有可能再次被解离,这可能也是造成乙醇收率较低的原因之一。因此,生成氢气可能原因是,乙醇遇到自由电子轰击而解离。游离的自由电子越多,产生的氢气可能越多。氢气和一氧化碳可能形成甲醇,也可以与氧气化合形成热力学上更为稳定的水。
另一方面,鉴于乙醇和甲醇液体燃料可以通过这样的负电晕方法合成,说明通过有效地利用大量的分散再生电力,如太阳能,将排放的CO2还原合成乙醇,从而将电能转化为燃料存储起来。这种方法可以允许使用废弃的低谷电力或再生的分散电力,例如,太阳能或风力发电产生负电晕,把排放的CO2和水蒸汽混合,转换成交通燃料,从而建立碳中性绿色系统。
3 结 论
1)利用负高压电晕放电非平衡反应技术,可以使极性的水蒸汽和CO2带电,产生水和CO2负离子,构成非平衡反应环境,直接将CO2还原成乙醇和少量甲醇。而且,CO2的转化率在100℃达到了15.9%, 乙醇收率可达到3.21%,甲醇的产率达到2.23%。
2)电晕脉冲放电频率、不同填料和气体流率等因素对CO2的转化都有影响。随着进料中气体流速的增加,CO2的转化率呈下降趋势;放电频率越高,CO2转化率越大。
3)有极性的磁铁填料要比无极性的玻璃填料效果更好,增加负离子与气体分子之间碰撞的机率。未来的工作将是进一步改进反应器结构,从而提高主要产品乙醇的收率。
同时,实验表明, CO2和水蒸汽在负电晕条件下可以还原合成乙醇燃料,使利用排放的CO2将大规模分散电力储存在交通燃料中的这一设想成为可能。
[1] 王晓刚,李立清,唐琳,等. CO2资源化利用的现状及前景[J].化工环保, 2006, 26(3): 198-203.
[2] 高健,苗成霞,汪靖伦,等. 二氧化碳资源化利用的研究进展[J].石油化工, 2010, 39(5): 465-475.
[3] 王文珍,张生琦,倪炳华,等. CO2的绿色利用技术研究进展[J].化工进展, 2013, 32(6):1415-1422.
[4] 郑小明,楼辉,费金华,等. 低“化学势”物质CO2的资源化转化[J].化学通报, 2004, 3: 192-197.
[5] WISE M A,DOOLEY J J. The value of post-combustion carbon dioxide capture and storage technologies in a world with uncertain greenhouse gas emissions constraints[J]. International Journal of Greenhouse Gas Control, 2009, 3(1): 39- 48.
[6] OHASHI Y, OGAWA T, EGAMI N. Development of carbon dioxide removal system from the flue gas of coal fired power plant[J].Energy Procedia,2011,4:29-34.
[7] NIKOO M K, AMIN N A S. Thermodynamic analysis of carbon dioxide reforming of methane in view of solid carbon formation[J]. Fuel Processing Technology, 2011, 2(3): 678-691.
[8] KATO Y,LIU C Y,OTSUKA K,et al.Carbon dioxide zero-emission hydrogen system based on nuclear power[J].Progress in Nuclear Energy,2005,47(1-4):504-511.
[9] DARENSHOURG D, HOLTCAMP M W. Catalysts for the reactions of epoxides and carbon dioxide[J]. Coordination Chemistry Reviews, 1996, 153:155-174.
[10] BOON J, COBDEN PD, DIJK H A J, et al. Isotherm model for high-temperature, high-pressure adsorption of CO2and H2O on K-promoted hydrotalcite[J]. Chemical Engineering Journal, 2014, 248: 406-414.
[11] DAS S, WAN D W M A. Photocatalytic CO2transformation into fuel: A review on advances in photocatalyst and photoreactor[J]. Renewable and Sustainable Energy Reviews, 2014, 39: 765-805.
[12] lHARA T, OURO T, OCHIAI T, et al. Formation of methanol by microwave plasma reduction of CO2with H2O[J]. Bulletin of the Chemical Society of Japan, 1996, 69(1): 241-244.
[13] SUPAT K, KRUAPONG A, CHAVADEJ S. Synthesis Gas Production from Partial Oxidation of Methane with Air in AC Electric Gas Discharge[J]. Energy & Fuels, 2003, 17(2): 474-481.
[14] HEINTZE M, PIETRUSZKA B. Plasma catalytic conversion of methane into syngas: the combined effect of discharge activation and catalysis[J].Catalysis Today, 2004, 89(1-2): 21-25.
[15] STOFFELS E, STOFFELS W W, KROESEN G M W. Plasma chemistry and surface processes of negative ions[J]. Plasma Sources Science and Technology, 2001, 10(2): 311-317.
[16] CHRISTOPHOROU L G, ZARAS A, PAPAGIANNAKOPOULOS P. Environmental applications of electron-molecule interactions[J]. International Journal of Mass Spectrometry, 2008, 277(1-3): 26-30.
[17] XIANG X F, GUO L, WU X, et al. Urea formation from carbon dioxide and ammonia at atmospheric pressure[J]. Environment Chemistry Letters, 2012, 10 (3): 295-300.
[18] CHEN J H, DAVIDSON J H. Model of the negative DC corona plasma: Comparison to the positive DC corona plasma[J]. Plasma Chemistry and Plasma Processing, 2003 23:83-102.
[19] GRAVES C, EBBESEN S D, MOGENSEN M, et al. Sustainable hydrocarbon fuels by recycling CO2and H2O with renewable or nuclear energy[J]. Renewable and Sustainable Energy Reviews,2011,15(1):1-23.
[20] BUDZIANOWSKI W M. Negative carbon intensity of renewable energy technologies involving biomass or carbon dioxide as inputs[J]. Renewable and Sustainable Energy Reviews, 2012, 16(9): 6507-6521.
[21] ALVAREZ-GUERRA M, QUINTANILLA S, IRABIEN A. Conversion of carbon dioxide into formate using a continuous electrochemical reduction process in a lead cathode[J]. Chemical Engineering Journal, 2012, 207-208: 278-284.
[22] BORETTI A. Renewable hydrogen to recycle CO2to methanol[J]. International Journal of Hydrogen Energy, 2013, 38(4): 1806-1812.
[23] 刘永卫. 甲烷和水蒸汽介质阻挡放电转化研究[D].天津:天津大学, 2008.
[24] XIANG X, WU X, GUO L, et al. Patterns of electronegative ions past a cylinder[J]. Plasma Sources Science and Technology, 2012, 21(5): 055004.
[25] 代斌,宫为民,张秀玲,等. 脉冲电晕等离子体活化纯CO2的反应[J].中国环境科学, 1999, 19(5): 410-412.
(编 辑陈镱文)
CO2reduction by non-equilibrium negative ion for synthesizing ethanol
JIN Duan-juan1, WU Xing1, MA Xiao-xun1, GUO Li1, XU Hui-fang1, XIA Ya-shen2
(1.School of Chemical Engineering/Chemical Engineering Research Center of the Ministry of Education for Advanced Use Technology of Shanbei Energy/Shaanxi Research Center of Engineering Technology for Clean Coal Conversion,Northwest University,Xi′an 710069, China; 2.HyChar Energy, LLC, Newton, MA 02456, USA)
By using the direct current (DC) negative corona discharge, CO2is reduced with steam synthesis of fuel products at normal atmosphere. The results showed that at 105oC, gas flow rate 0.05 L/min, the discharge frequency of 10.245 kHz, the feed water rate of 3.43 mL/min, the conversion of CO2could reach 15.9% and the yields of ethanol and methanol were 3.21% and 2.23%, respectively. Furthermore, the effect of magnetic field on the reaction was discussed, and the mechanism of synthesis of ethanol by CO2and stream was studied.
negative corona discharge; CO2resource utilization; non-equilibrium negative ion; ethanol
2014-03-11
国家自然科学基金联合基金资助项目(51174281);高等学校博士学科点专项科研基金资助项目(20116101110019);国际科技合作计划项目子课题基金资助项目(2013DFB60140-04)
晋杜娟,女,甘肃天水人,从事能源化工方向及C1化学品的资源化利用的研究。
伍星,男,西北大学副教授,从事化工机械、能源化工设备、化工自动化控制等方面的研究。
X781.6
:ADOI:10.16152/j.cnki.xdxbzr.2015-02-015
