氧化锌工艺浸取过程氧化锌-氨-碳酸氢铵-水体系热力学分析*
2015-02-07刘继东苏佳林吕建华郑松章刘国成
刘继东,苏佳林,吕建华,郑松章,刘国成
(1.河北工业大学化工学院,天津300130;2.天津市昊永化工工程有限公司)
氧化锌工艺浸取过程氧化锌-氨-碳酸氢铵-水体系热力学分析*
刘继东1,苏佳林1,吕建华1,郑松章2,刘国成1
(1.河北工业大学化工学院,天津300130;2.天津市昊永化工工程有限公司)
对氧化锌生产工艺浸取过程的配合平衡进行了热力学分析。建立了氧化锌-氨-碳酸氢铵-水体系热力学模型。研究了不同温度下的氨浓度、pH对氧化锌溶解度的影响。分析了适宜的氨浓度、pH及温度范围,并对298 K及333 K下的计算结果进行了实验验证,计算值与实验值相对误差的平均值分别为9.39%和11.88%,证明了模型是正确的。
氧化锌;热力学;平衡;锌氨配合物;溶解性
氧化锌作为一种重要的化工原料,在橡胶、医药、化妆品、纺织、电子等行业都有着重要的应用。氧化锌的生产方法有直接法、间接法和湿法[1],其中湿法工艺中的氨法工艺,因具有流程短、成本低、氨及废水可回收利用等优点而受到工厂的青睐。许多研究者对298 K、NH3-NH4Cl-H2O作为浸取剂的锌的氨法处理工艺进行了一系列研究[2-5]。
本研究是基于一种氨法氧化锌生产与废水回收再利用的生产方法[6]。该工艺主要特点在于,在利用蒸氨塔对溶解工序锌氨液蒸馏处理得到高纯氧化锌的同时,充分回收锌氨液中的氨,从而实现工艺中氨的回收再利用。溶解过程使用NH3-NH4HCO3-H2O混合液作为浸取剂、NH4HCO3作为缓冲剂,保证了浸取液的氨含量和pH的稳定,相对于使用NH4Cl,本工艺没有引入多余的离子,适用于本工艺的操作条件。溶解过程和蒸氨过程发生的主要反应:

笔者从不同温度下的氨含量、pH方面对溶解工序浸取氧化锌过程进行热力学分析,找到影响氧化锌溶解度的主要因素,为氧化锌氨法处理的浸取过程提供了理论依据。
1 热力学分析
锌氨液是复杂的配位络合离子体系,含有多种离子。在锌氨溶液中存在着配位平衡、解离平衡和气液平衡。工艺涉及ZnO-NH3-NH4HCO3-H2O体系,为简化计算,现不考虑气相,液相出现的不溶性物质只考虑ZnO。液相的可溶性物质有Zn(NH3)i2+(i=1~4)、Zn(OH)j2-j(j=1~4)、Zn2+、HZnO2-、ZnO22-、Zn(HCO3)+、Zn(HCO3)2(aq)、NH4HCO3(aq)、(NH4)2CO3(aq)、NH3(aq)、NH4+、H2CO3(aq)、HCO3-、CO32-、H+、OH-。其中Zn(HCO3)+、Zn(HCO3)2(aq)属于锌的不稳定配合物,并且Zn(HCO3)2(aq)含量很低。由文献[7]可知,Zn(HCO3)+存在的pH范围为6.5~9。在本研究体系中有锌氨配合物生成,而锌氨配合物的稳定性远大于Zn(HCO3)+。因此上述两种配合物忽略不计。建立热力学模型需要的热力学数据如表1、表2所示,不同温度下锌配合物累积稳定平衡常数[8-9]列于表1,其他相关化合物及离子标准热力学数据[10-11]列于表2。
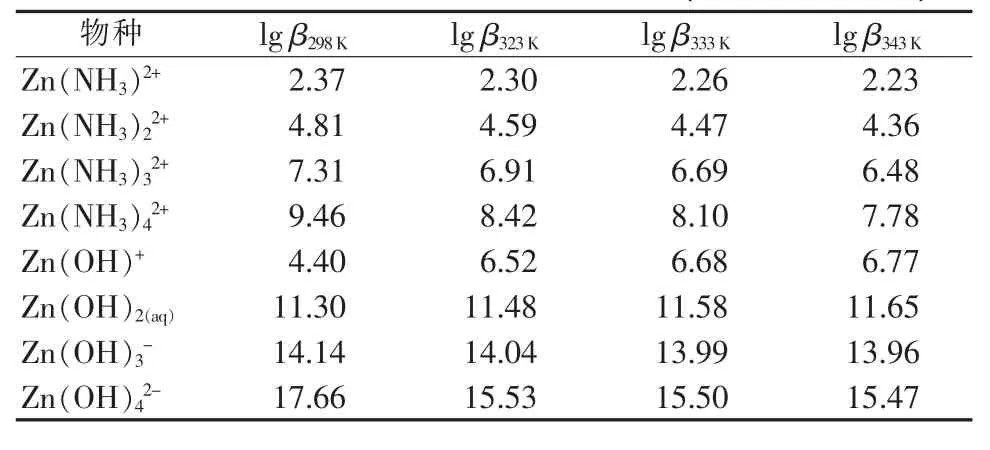
表1 不同温度锌配合物累积稳定常数(T=298~343 K)
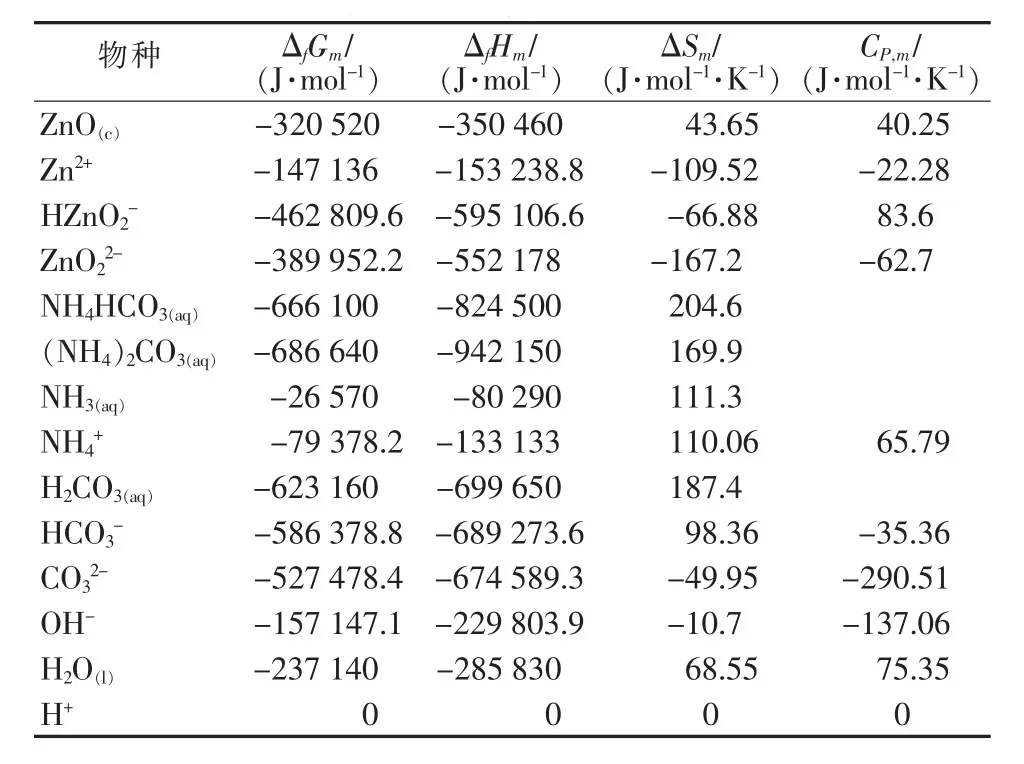
表2 相关化合物及离子标准热力学数据
当体系达到平衡时,锌配合物的平衡关系如式(4)所示:
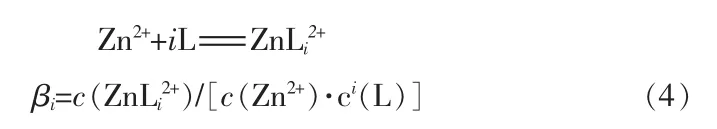
式中:L为配体;i为配位数;βi为累积稳定常数。
通过式(4),达到平衡时锌配合物的含量可表示为式(5),即:

体系中的其他化合物用氧化锌及相应物质的水解平衡反应表示,根据最小自由能算法,平衡时各物质含量可以用反应平衡常数表示。
温度T时,物质的吉布斯自由能可由式(6)计算:

由文献[12]可知,在298~473 K时,离子的热容变化很小,因此为了计算温度对热力学平衡的影响,认为热容与温度无关,则式(6)可简化为:

2 模型建立
根据以上热力学分析,建立锌氨溶液热力学模型。
由同时平衡原理[13],即质量守恒和电荷守恒,温度为T时,根据总溶解锌浓度、总氨浓度、总碳酸根浓度质量守恒得式(8)~(10):
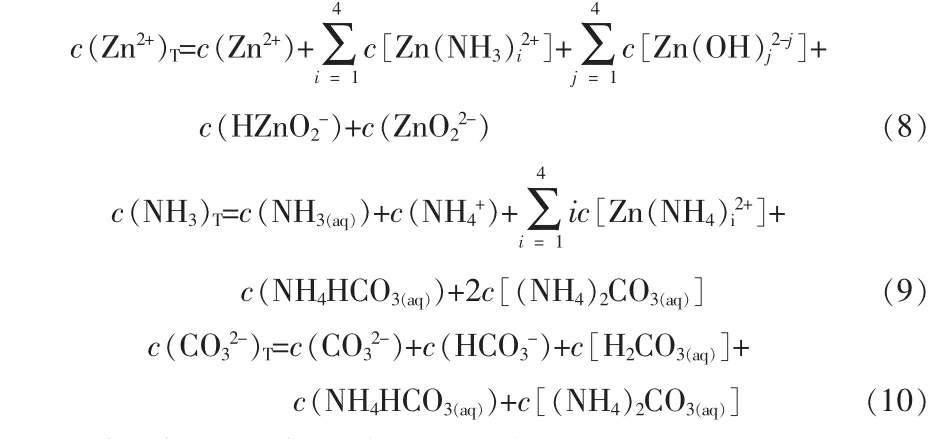
根据溶液电荷守恒可得式(11):
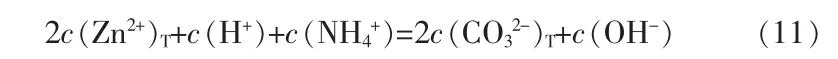
式中:c(Zn2+)T、c(NH3)T、c(CO32-)T分别为溶液中总锌离子浓度、总氨浓度、总碳酸根浓度;c(Zn2+)、c(NH3(aq))、c(CO32-)分别为溶液中游离锌离子浓度、游离氨浓度、游离碳酸根浓度;i、j分别为锌氨、锌羟基配合物的配位数。
以上共有(8)~(11)4个方程,有c(Zn2+)T、c(NH3)T、c(CO32-)T、pH、c(NH3(aq))、c(CO32-)6个未知数,为分析平衡时溶液中氨浓度及pH对体系的影响,令氨浓度在0~2 mol/L、pH在7~14变化,利用MATLAB编程[14]计算出其他未知浓度。
在实际操作中,由于加入的浸取剂为NH3-NH4HCO3,因此有以下关系存在:

式中:c(NH3)、c(NH4HCO3)为加入的氨水和碳酸氢铵的浓度。由式(8)~(13)就可以根据加入浸取剂NH3和NH4HCO3的浓度,求出其他未知浓度及pH。
3 结果讨论
图1为298 K时氧化锌的溶解量与溶液pH的关系曲线。在没有氨存在时,氧化锌的溶解量很小,而且随着pH的增大溶解量先减小后增大。这是由于氧化锌是典型的两性氧化物,在低pH及高pH时溶解量增大,此时的计算值与文献[15]十分吻合。在有氨加入时,不同氨浓度下氧化锌的溶解度变化趋势相似,氧化锌溶解量在pH为7~12时有很大提高,在pH为9.5时出现极大值。这是由于氨与锌形成了可溶性的配合物,这也是采用氨法浸取氧化锌的主要原因。由图1也可以看出,氧化锌的溶解量随着氨浓度的增大而增大,但是溶解量增长趋势逐渐变缓。因此一味地增加氨量并不能改善氧化锌的溶解量,否则不仅造成氨的浪费,并且为后续氨的回收增加了难度。氨浓度为1~2 mol/L较适宜。
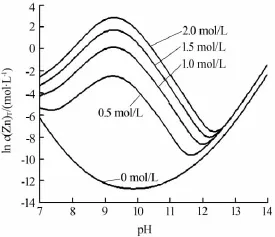
图1 298 K时不同氨浓度下氧化锌溶解度与溶液pH关系曲线
图2为不同温度(298~343 K)、氨浓度为1 mol/L条件下,氧化锌溶解度与pH关系曲线。由图2可知,不同温度下氧化锌溶解量变化趋势相似,在低碱度时出现极大值,此时锌氨形成了配合物,极大值随温度升高逐渐降低,而且此极值出现的pH降低。因此温度升高不利于氧化锌在浸取剂中的溶解,但是低温时会增加反应的时间。因此温度介于308~333 K较合适。

图2 不同温度(298~343 K)下氧化锌溶解度与pH关系曲线(氨浓度为1 mol/L)
图 3、图 4分别为 298、333 K下,氨浓度为1 mol/L时,锌配合物种类及其物质的量分数与pH关系曲线。由图3、4可知,随着pH增大锌氨配合物和锌羟基配合物相继出现。在298 K下,在pH=9~11.5时,Zn(NH3)42+为溶液中锌配合物主要成分,这是图1中氧化锌溶解度在此pH范围增大的原因;在pH=12.5~14时,氧化锌溶解度出现极值是因为形成了锌的羟基配合物。在333 K下,pH=8~11时,Zn(NH3)42+为溶液中锌配合物主要成分,因此温度升高使得Zn(NH3)42+出现的pH降低。由以上分析可知,氨加入使氧化锌溶解量升高,主要是生成了Zn(NH3)42+,温度升高使得锌氨配合物出现的pH降低。
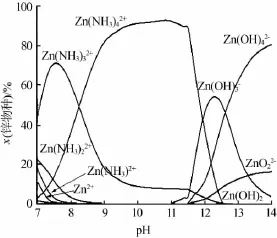
图3 298 K下锌配合物种类及与pH关系曲线(氨浓度为1 mol/L)
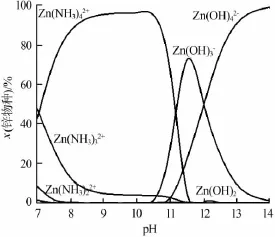
图4 333 K下锌配合物种类及与pH关系曲线(氨浓度为1 mol/L)
图 5、图 6分别为 298、333 K下,氨浓度为1 mol/L时,氨在溶液中的存在形式及与pH关系曲线。由图5、6可知,随着pH增加,NH4+转化为游离氨与锌离子发生配合反应,随后转化为游离氨,此时由图3、4可知锌与羟基形成配合物,因此当溶液为中性和强碱性时不利于锌氨形成配合物。由图5、6也可以看出,随着温度的升高,锌氨配合物的含量下降,可知温度升高使得锌与氨的配合能力下降,这是因为锌氨的配合属于放热反应,因此锌氨稳定常数随着温度的升高而降低,不利于锌氨配合物的形成。

图5 298 K下氨存在形式及与pH关系曲线(氨浓度为1 mol/L)

图6 333 K下氨存在形式及与pH关系曲线(氨浓度为1 mol/L)
4 实验验证
在298 K和333 K下,在已知浓度的氨水和碳酸氢铵混合溶液中,加入过量的分析纯氧化锌充分混合,利用恒温水浴箱保持温度恒定,为防止氨的挥发,在密闭容器中反应至平衡,将固液分离,用EDTA标准溶液滴定,确定溶液中溶解锌的浓度。实验值与理论计算值列于表3。从表3可以看出,不同NH4HCO3、NH3浓度下,298 K及333 K时,溶液中锌平衡浓度实验值与计算值相对误差的平均值分别为9.39%和11.88%,说明建立的热力学模型是正确的,选择的热力学数据准确性较好。分析产生误差的原因,主要是由于用物质的量浓度代替了活度表示平衡常数,而且氨易挥发,使得测量存在误差;随着温度的升高,压力对系统的影响也变得明显。

表3 不同NH4HCO3、NH3浓度下溶液中锌总浓度计算值与实验值
5 结论
根据同时平衡原理,建立了不同温度下的ZnONH3-NH4HCO3-H2O体系的热力学模型,绘制了氨浓度、pH、温度与氧化锌溶解量的热力学关系曲线,并对298 K及333 K下的计算值进行了实验验证。分析表明,浸取液的pH应控制在9.0~9.5,此时氧化锌的溶解量较大,这是由于生成了锌氨配合物Zn(NH3)42+;平衡氨浓度控制在1~2 mol/L,氧化锌溶解量在高氨浓度时增加不明显,而且为后续氨的回收利用增加了难度;浸取温度应控制在303~333 K,这是由于在合适的pH下,温度升高会使得氧化锌的溶解量下降,而过低的温度会使得反应的时间延长。
[1] 商连弟,武换荣.氧化锌生产方法及研究进展[J].无机盐工业,2008,40(3):4-7.
[2] Limpo J L,Luis A.Solubility of zinc chloride in ammoniacal ammonium chloride solutions[J].Hydrometallurgy,1993,32:247-260.
[3] Yang Shenghai.Theory and application studies on preparing high purity zinc in the system of Zn(Ⅱ)-NH3-NH4Cl-H2O[D].Changsha:Central South University,2003.
[4] 王瑞祥,唐谟堂,杨建广,等.Zn(Ⅱ)-NH3-Cl--CO32--H2O体系中Zn(Ⅱ)配合平衡[J].中国有色金属学报,2008,18(专辑1): 192-198.
[5] Ding Zhiying,Chen Qiyuan,Yin Zhoulan,et al.Predominance diagrams for Zn(Ⅱ)-NH3-Cl--H2O system[J].Transactions of Nonferrous Metals Society of China,2013,23:832-840.
[6] 朱正清.一种氨法氧化锌生产与废水综合回收再利用的生产方法:中国,102515253A[P].2012-06-27.
[7] Vega M,Pardo R,Herguedas M M,et al.Pseudopolarographic determination of stability constants of labile zinc complexes in fresh water[J].Analytica Chimica Acta,1995,310(1):131-138.
[8] Hubert C,Naghavi N,Canava B,et al.Thermodynamic and experi mental study of chemical bath deposition of Zn(S,O,OH)buffer layers in basic aqueous ammonia solutions.Cell results with electrodeposited CuIn(S,Se)2absorbers[J].Thin Solid Films,2007,515(15):6032-6035.
[9] Reichle R A,Mccurdy K G,Hepler L G.Zinc hydroxide:Solubility product and hydroxy-complex stability constants from 12.5~75℃[J].Canadian Journal of Chemistry,1975,53(24):3841-3845.
[10] Speight J G.Lange’s handbook of chemistry[M].16th ed.New York: RR Donnelley Press,2005:237-279.
[11] Shock E L,Sassani D C,Willis M,et al.Inorganic species in geologic fluids:Correlations among standard molal thermodynamic properties of aqueous ions and hydroxide complexes[J].Geochimica et Cosmochimica Acta,1997,61(5):907-950.
[12] Criss C M,Cobble J W.The thermodynamic properties of high temperature aqueous solutions.V.The calculation of ionic heat capacities up to 200℃.Entropies and heat capacities above 200℃[J]. J.Am.Chem.Soc.,1964,86:5385-5393.
[13] 唐谟堂,杨天足.配合物冶金理论与技术[M].长沙:中南大学出版社,2011:11-81.
[14] 巨少华,唐谟堂,杨声海.用MATLAB编程求解Zn(Ⅱ)-NH4Cl-NH3-H2O体系热力学模型[J].中南大学学报:自然科学版,2005,36(5):821-827.
[15] Baes C F,Mesmer R E.The hydrolysis of cations[M].New York: John Wiley&Sons Inc,1976:287-295.
Thermodynamic analysis on system of ZnO-NH3-NH4HCO3-H2O in process of zinc oxide leaching
Liu Jidong1,Su Jialin1,Lü Jianhua1,Zheng Songzhang2,Liu Guocheng1
(1.School of Chemical Engineering,Hebei University of Technology,Tianjin 300130,China;2.Tianjin Haoyong Chemical Engineering Technology Co.,Ltd.)
Thermodynamics analysis was conducted for the complex equilibrium about the leaching section of a type of zinc oxide production process,meanwhile,the thermodynamic model of ZnO-NH3-NH4HCO3-H2O system was developed.The effects of ammonia concentrations and pH with different temperatures on the solubility of zinc oxide were studied and the suitable conditions for zinc oxide leaching were analyzed.Results of theoretic calculations at 298 K and 333 K were verified by experiments.Results showed that the relative average error between the theoretic calculations and the experimental values were 9.39%and 11.88%,which proofed the thermodynamic model was reliable.
zinc oxide;thermodynamics;equilibrium;zinc ammonia complex;solubility
TQ132.41
A
1006-4990(2015)06-0030-04
2015-01-24
刘继东(1972— ),男,博士,教授。
天津市科技计划项目(13ZXCXSF12300)。
联系方式:lljjdd@163.com
