恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎疗效的Meta分析
2015-02-07渠亚超鲍旭丽吕艳伟
渠亚超,田 洲,鲍旭丽,吕艳伟,闾 军
(1.首都医科大学附属北京佑安医院,北京 100069;2.北京市创伤骨科研究所,北京 100035)
论 著
恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎疗效的Meta分析
渠亚超1,田 洲1,鲍旭丽1,吕艳伟2,闾 军1
(1.首都医科大学附属北京佑安医院,北京 100069;2.北京市创伤骨科研究所,北京 100035)

目的 评价恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎的疗效。方法 检索2005—2014年4月PubMed、Cochrane Library、OVID、SpringerLink、中国知网、中国生物医学文献数据库、万方数据医学网及维普网,根据纳入标准、排除标准,对入选的10篇随机对照试验(RCT)的研究结果采用RevMan5.2软件进行分析。结果 与对照组相比,实验组能更显著地提高ALT复常率、HBV DNA转阴率、HBeAg转阴率和HBeAg血清转换率,相对危险度(RR)分别为1.13[95%CI(1.06,1.21),Z=3.61,P=0.000 3],1.19[95%CI(1.09,1.30),Z=3.83,P=0.000 1]、2.25[95%CI(1.52,3.33),Z=4.04,P<0.0001]和2.31[95% CI (1.83,2.92),Z=7.06,P<0.000 01];且无明显不良反应。结论 恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎能有效增加恩替卡韦单药抗病毒疗效,但确切疗效尚需更多临床研究加以证实。
慢性乙型肝炎;恩替卡韦;胸腺肽α1; Meta分析
慢性乙型肝炎(慢乙肝)是目前全世界范围内的难治疾病之一。目前使用任何一种药物都无法控制或消灭慢性乙型肝炎病毒(HBV)感染,治疗目的主要是防止或减少肝硬化、肝细胞癌及肝脏相关性死亡的发生。近年研究表明,抑制病毒的持续复制可使疾病进展的危险性减小[1-2],但长期单独口服抗病毒药物所引发的耐药问题逐渐引起人们重视。将不同核苷(酸)类似物联合应用可以降低耐药的发生,但是早期相关研究结果并不令人满意[3]。由于HBV感染所造成的损害由免疫反应引起,人们逐渐选择将抗病毒药物与免疫调节剂联合应用来改善慢乙肝的临床治疗终点。有研究证实,将口服抗病毒药与干扰素α(IFN-α)联用可导致更高的HBeAg血清学转换率,且可达到更持久的HBV-DNA抑制效果[4]。但INF注射面临患者耐受性差及肝硬化失代偿患者不适用等局限性[5]。胸腺肽α1是一种从胸腺组织中提取的28个氨基酸的多肽[6],是一种重要的免疫递质,可以提高HBV病毒清除率。体外实验证实,胸腺肽α1可以影响T细胞的成熟和抗原识别,可以刺激IFN和细胞内因子的生成,影响自然杀伤细胞介导的毒性细胞的活性[7-8]。目前涉及胸腺肽α1的临床随机对照实验常样本量较小,且结果不总是一致。虽然与IFN相比,胸腺肽的不良反应要温和,但它的临床效果仍然无法确定[9-10]。目前已有IFN联合核苷类似物与单独使用胸腺肽α1的疗效报道。然而,将恩替卡韦与胸腺肽α1联用的报道数据较少,因此,联用比单独使用恩替卡韦是否有更佳的治疗效果值得研究。本研究收集当前使用恩替卡韦的上述随机对照试验,旨在客观评价2种治疗方案的临床疗效及应用价值。
1 研究资料
1.1 检索策略 搜集所有采用恩替卡韦联合胸腺肽α1与恩替卡韦对照治疗慢乙肝的随机对照试验(randomized controlled trial,RCT)资料,2位评价者单独检索并交叉核对。检索PubMed、Cochrane Library、OVID、SpringerLink、中国知网、中国生物医学文献数据库(CBM-disk)、万方数据医学网及维普网, 时间控制在2005年恩替卡韦上市至2014年4月, 检索词为“HBV、hepatitis B、CHB、entecavir、ETV、thymosin、恩替卡韦、胸腺肽α1、病毒性肝炎、随机对照试验”。查阅所有检出文献的参考文献作为补充。
1.2 纳入标准 ①研究类型: RCT,无论是否采用盲法。②研究对象: HBeAg 阳性或HBeAg阴性且未应用过核苷类似物治疗的慢乙肝患者,诊断符合《慢性乙型肝炎防治指南》[11]标准。男女不限,年龄16~70岁。筛选前HBsAg阳性至少6个月,筛选时ALT水平升高(≥1.3~10倍ULN),TBil≤42.75 μmol/L,HBV DNA≥104拷贝/mL。③干预措施:实验组接受恩替卡韦 0.5 mg,1次/d口服,胸腺肽α1 1.6 mg,皮下注射,每周2次,治疗48周;对照组单用恩替卡韦治疗48周。④观察指标:血清ALT复常率、HBV DNA阴转率、HBeAg阴转率、血清HBeAg/抗-HBe转换率、纤维化指标、不良反应发生率。
1.3 排除标准 ①同时感染HIV、HCV、HDV者;②其他肝病, 如酒精性、自身免疫性、胆汁淤积性肝病或肝癌患者。
1.4 文献筛选、资料提取和质量评价 2名作者独立进行文献筛选、数据提取、质量评价,如遇分歧讨论决定或请第3位研究者裁决。文献质量评价参照Jadad 量表,主要从受试者分组是否真正随机、研究过程中是否使用盲法、对失访者是否记录等对入选文献进行质量评价。Jadad积分≥3分为高质量研究。
1.5 统计学方法 对所有收集的资料采用Cochrane协作网RevMan 5.2软件进行Meta分析。计数资料采用相对危险度(RR)为疗效分析统计量;各效应量均以95%CI表示。为判断联合各试验进行分析的合理性,采用卡方检验进行各试验间的异质性检验。如同质性好(P>0.10,I2≤50%)则采用固定效应模型进行Meta分析;若同质性不好(P≤0.10,I2>50%)则分析产生异质性的原因,确定是否能采用随机效应模型进行Meta分析。异质性可能源于低质量研究,进一步做敏感性分析。采用漏斗图分析可能的发表偏倚。P<0.05为差异有统计学意义。
2 结 果
2.1 文献检索结果及纳入研究特征 初检共获得93篇文献,其中中国知网28篇、CBM 20篇、万方26篇、维普网19篇。阅读文题排除相同和无关的文献后,初筛出15篇。进一步阅读摘要和全文,排除5篇,最终纳入10篇文献[12-21],其中1篇[18]Jadad积分为5分,1篇[16]Jadad积分为3分,8篇[12-15,17-18,20-21]Jadad积分为2分。共计1 026例患者,其中实验组503例,对照组523例。具体检索策略见图1,各纳入研究的基本特征见表1。
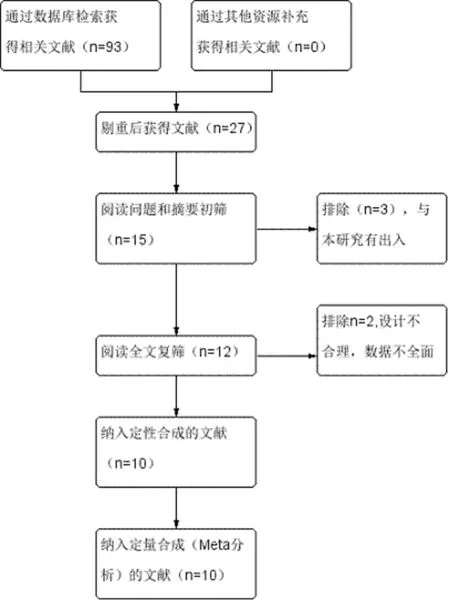
图1 文献筛选流程及结果

表1 纳入研究的一般特征
注:①为血清ALT复常率;②为血清HBV DNA阴转率;③为血清HBeAg阴转率;④为血清HBeAg/抗-HBe血清学转换率;⑤为不良反应;⑥为纤维化指标。
2.2 各观察指标结果
2.2.1 血清ALT复常率 有8个研究[12-14,17-21]报道了治疗48周时血清ALT复常率。研究结束时,实现ALT复常的共619例,其中实验组321例,对照组298例。各研究间无统计学异质性(P=0.33,I2=13%),故采用固定效应模型进行合并分析,结果表明2组差异有统计学意义[RR=1.13,95% CI(1.06,1.21),Z=3.61,P=0.000 3],见图2。倒漏斗图显示8项研究之间无明显发表偏倚,见图3。

图2 2组血清ALT复常率比较的Meta分析
图3 2组血清ALT复常率比较的漏斗图
2.2.2 HBV DNA阴转率 有10个研究[12-21]报道了治疗48周时HBV DNA阴转率。治疗结束时实现HBV DNA转阴(血清PCR法检测HBV DNA<500拷贝/mL)共792例,其中实验组428例,对照组364例。各研究间有统计学异质性(P=0.05,I2=48%),采用随机效应模型进行合并分析,结果表明实验组HBV DNA阴转率明显高于对照组[RR=1.19,95%CI(1.09, 1.30),Z=3.83,P=0.000 1],见图4。去除1篇[17]进行敏感性分析,结果显示2组HBV DNA阴转率仍然有统计学意义[RR=1.17,95%CI(1.07,1.27)P=0.000 3],说明该组分析稳定性较好。
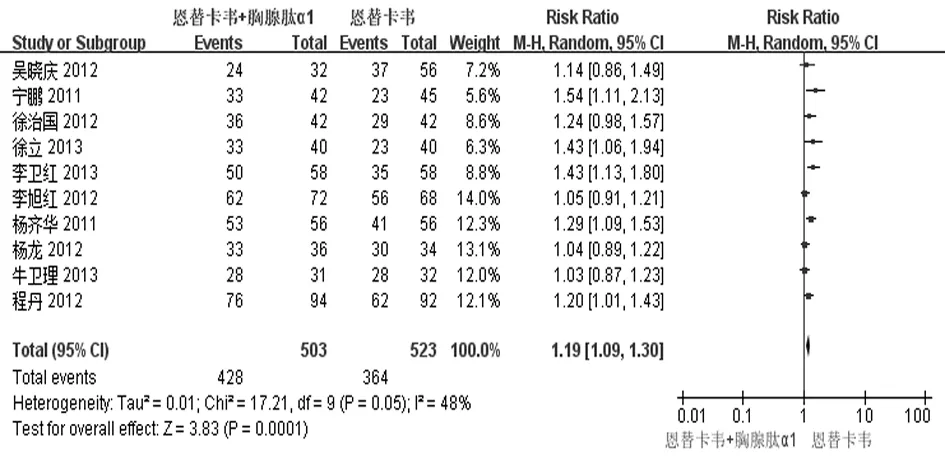
图4 2组血清HBV DNA阴转率比较的Meta分析
2.2.3 血清HBeAg阴转率 有6个研究[13-15,18-19,21]报道了治疗48周时血清HBeAg阴转率。治疗结束时实现血清HBeAg阴转的共238例,其中实验组166例,对照组72例。各研究间存在异质性(P=0.03,I2=59%),故采用随机效应模型进行合并分析,结果表明2组差异有统计学意义[RR=2.25,95%CI(1.52,3.33),Z=4.04,P<0.000 1],见图5。去除1篇[19]进行敏感性分析,结果显示2组血清HBeAg阴转率仍然有统计学意义[RR=1.95,95%CI(1.54,2.46),P<0.00001],说明该组分析稳定性较好,见图6。倒漏斗图显示5项研究之间无明显发表偏倚,见图7。
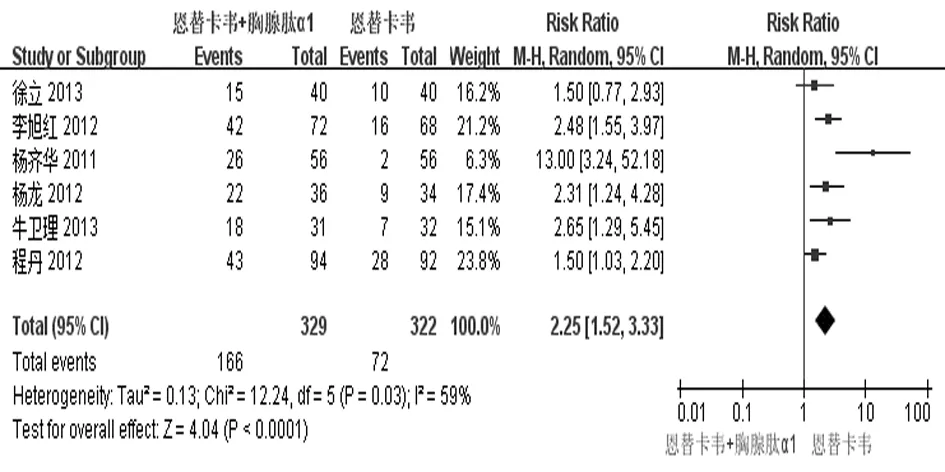
图5 2组血清HBeAg阴转率比较的Meta分析

图6 2组血清HBeAg阴转率比较敏感性分析

图7 2组血清HBeAg阴转率比较漏斗图
2.2.4 血清HBeAg/抗-HBe转换率 有10个研究[12-21]报道了治疗48周时血清HBeAg/抗-HBe转换率。治疗结束时,实现血清HBeAg/抗-HBe转换的共261例,其中实验组180例,对照组81例。各研究间无统计学异质性(P=0.42,I2=2%),故采用固定效应模型进行合并分析,结果表明2组差异有统计学意义[RR=2.31,95% CI(1.83,2.92),Z=7.06,P<0.000 01],见图8。倒漏斗图显示10项研究之间无明显发表偏倚,见图9。
2.2.5 不良反应发生率 仅有3项研究[12-13,18]报道治疗过程中出现头痛、疲劳、眩晕、恶心等不良反应,发生率均<6%,2组间比较均无统计学意义。由于发生率低,无法统计2组之间差异。
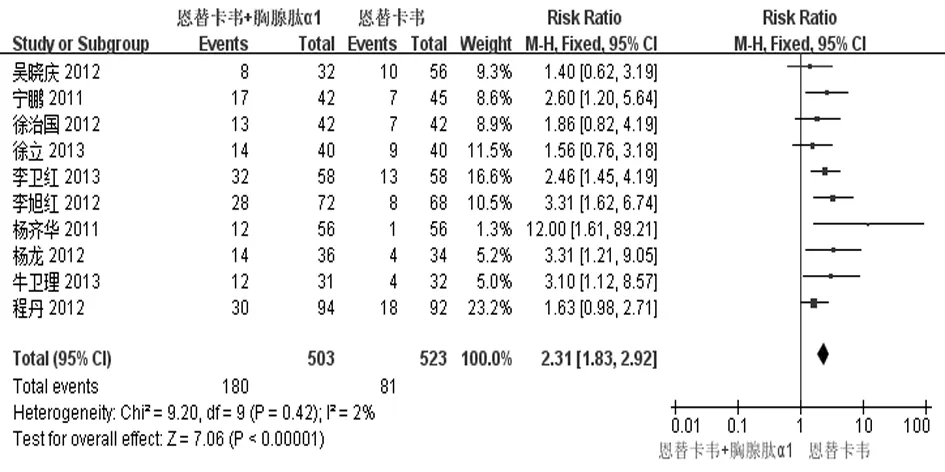
图8 2组血清HBeAg/抗-HBe血清学转换率比较的Meta分析
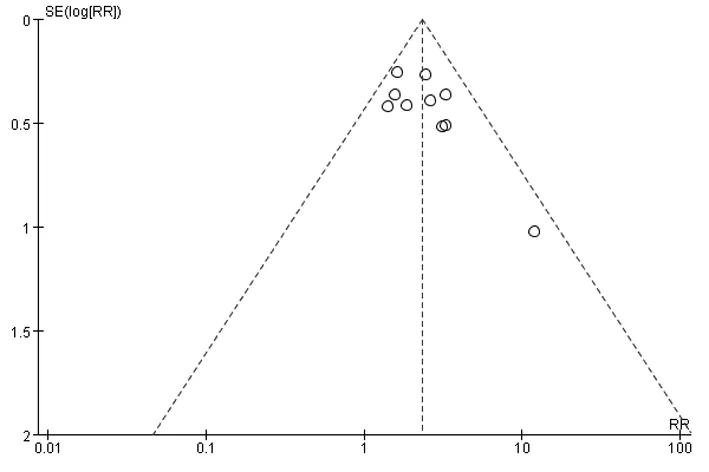
图9 2组血清HBeAg/抗-HBe血清学转换率比较漏斗图
2.2.6 其他 仅有宁鹏[17]对2组治疗前后患者的血清LN、HA、CⅣ、PCⅢ,用Fibroscan对肝纤维化程度进行定量检测。经过48周,治疗结果显示对于肝纤维化的改善,联合用药组优于对照组。
3 讨 论
恩替卡韦是2005年3月美国FDA批准上市的药物,适用于有活动性复制和血清学或肝组织学炎症指标的成年慢乙肝患者。恩替卡韦是鸟嘌呤核苷类药物,能有效选择性抑制HBV复制,阻断复制的3个环节:抑制HBV多聚酶的启动,抑制前基因组mRNA逆转录负链的形成,抑制DNA依赖的DNA合成,因此恩替卡韦抗病毒活性强,是现有国内市场上核苷类似物中抗病毒活性最强的化合物[22-23]。胸腺肽α1是胸腺提取物的主要活性成分,它与恩替卡韦有一定的协同作用,恩替卡韦可以快速抑制HBV的复制,胸腺肽α1则通过刺激机体细胞免疫,抑制HBV前基因组RNA的转录和反转录,有利于清除低水平复制的HBV,弥补恩替卡韦不能直接清除肝细胞核内HBV的不足,达到控制HBV感染、减少疾病复发的目的[22]。
目前,对于非肝硬化的肝病患者,干扰素、拉米夫定、阿德福韦酯和恩替卡韦都可以作为一线治疗用药,但是仍有许多问题,如IFN-α治愈率低且耐受性差;拉米夫定长期治疗容易发生耐药YMDD突变[24];单用核苷类似物治疗还存在停药后持续应答率低等局限性[25]。由于目前可选择的药物有限,导致人们开始研究新型药物和新的联合治疗方案。鉴于HBV和HIV治疗之间有相似性,根据治疗HIV经验可知,使用任何单一的药物来永久控制或消除慢性HBV感染无法实现[26]。Economou等[27]与单独使用拉米夫定相比,拉米夫定和联合干扰素治疗12个月可以防止或延缓YMDD变异的发生及病毒突破。胸腺肽α1与拉米夫定或干扰素联用可增强疗效[10]。Zhang等[28]已证实,胸腺肽α1与拉米夫定联用可以提高ALT复常率、病毒学反应率及HBeAg血清学转换率。本研究结果显示,恩替卡韦和胸腺肽α1联用可以提高血清ALT复常率、血清HBV DNA阴转率、HBeAg阴转率及HBeAg/抗-HBe转换率,且无明显不良反应,但由于胸腺肽α1长期用药价格相对昂贵,且需要进行注射给药,不利于经常出差或长时间在外地人员使用,存在患者长期应用时依从性欠佳等问题。另外,本分析收录的10篇文献均为国内研究,限制了结论的质量及科学性。因此,此种联合治疗方案的效果还需要大规模严谨的临床随机对照试验加以验证。
[1] Chen CF,Lee WC,Yang HI,et al.Changes in serum levels of HBV DNA and alanine aminotransferase determine risk for hepatocellular carcinoma[J].Gastroenterology,2011,141(4):1240-1248
[2] Chen CJ,Yang HI.Natural history of chronic hepatitis B REVEALed[J].J Gastroenterol Hepatol,2011,26(4):628-638
[3] Perrillo RP.Current treatment of chronic hepatitis B: benefits and limitations[J].Semin Liver Dis,2005,25 (Suppl1):20-28
[4] Santantonio TA,Fasano M.Chronic hepatitis B:Advances in treatment[J].World J Hepatol,2014,6(5):284-292
[5] Liaw YF,Kao JH,Piratvisuth T,et al.Asian-Pacific consensus statement on the management of chronic hepatitis B: a 2012 update[J].Hepatology international,2012,6(3):531-561
[6] Goldstein AL.From lab to bedside: emerging clinical applications of thymosin alpha 1[J].Expert Opin Biol Ther,2009,9(5):593-608
[7] Garaci E.Thymosin alpha1: a historical overview[J].Ann N Y Acad Sci,2007,9(1112):14-20
[8] Sugahara S,Ichida T,Yamagiwa S,et al.Thymosin-alpha1 increases intrahepatic NKT cells and CTLs in patients with chronic hepatitis B[J].Hepatol Res,2002,24(4):346-354
[9] Chien RN,Lin CY,Yeh CT,et al.Hepatitis B virus genotype B is associated with better response to thymosin alpha1 therapy than genotype C[J].J Viral Hepat,2006,13(12):845-850
[10] Lee HW,Lee JI,Um SH,et al.Combination therapy of thymosin alpha-1 and lamivudine for HBeAg positive chronic hepatitis B: A prospective randomized, comparative pilot study[J].J Gastroenterol Hepatol,2008,23(5):729-735
[11] 贾继东,李兰娟.慢性乙型肝炎防治指南(2010年版)[J].临床肝胆病杂志,2011,27(1):113-128
[12] 李卫红.恩替卡韦联合胸腺肽α1治疗HBeAg阳性慢性乙型肝炎116例疗效分析[J].青海医药杂志,2013,43(5):18-19
[13] 徐立.胸腺肽α1对恩替卡韦治疗HBeAg阳性慢性乙型肝炎疗效的影响[J].中国当代医药,2013,20(11):40-41
[14]杨龙,蒋雪花,陈芳妹.恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎临床研究[J].肝脏,2012,17(6):445-446
[15] 程丹,刘文涛,黄新造.恩替卡韦联合α1胸腺肽治疗HBeAg阳性慢性乙型肝炎疗效及安全性分析[J].实用肝脏病杂志,2012,15(4):350-351
[16] 徐治国,梁艳.恩替卡韦联合胸腺肽α1治疗HBeAg阳性慢性乙型肝炎的疗效分析[J].中国医药指南,2012,10(29):264-266
[17] 宁鹏.恩替卡韦联合胸腺肽α1治疗慢性肝炎疗效研究[D].青岛:青岛大学,2011
[18] 牛卫理.恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎的临床效果分析[J].中国当代医药,2013,20(27):58-59
[19] 杨齐华,郑拓,童楚盛.恩替卡韦联合胸腺肽治疗HBeAg阳性的慢性乙型肝炎临床观察[J].海峡药学,2011,23(5):88-90
[20] 吴晓庆,万红.恩替卡韦联合胸腺肽α1治疗慢性乙型肝炎近期疗效观察[J].实用肝脏病杂志,2012,15(6):568-569
[21] 李旭红,赖江琼,李奕鑫,等.恩替卡韦片联合胸腺肽α1治疗HBeAg阳性乙型肝炎疗效分析[J].传染病信息,2012,25(4):235-236
[22] 赵艳娟,高歌.干扰素α2b与苦参素、胸腺肽α1联合序贯治疗慢性乙型肝炎的实验研究[J].临床肝胆病杂志,2005,21(6):341-342
[23] 杨松.2009年恩替卡韦临床应用专家共识[J/CD].中华实验和临床感染病杂志:电子版,2009,3(2):42-45
[24] Paik YH,Han KH,Hong SP,et al.The clinical impact of early detection of the YMDD mutant on the outcomes of long-term lamivudine therapy in patients with chronic hepatitis B[J].Antivir Ther,2006,11(4):447-455
[25] 谢雯,闫杰,赵红.慢性乙型肝炎联合抗病毒治疗专家共识[J/CD].中华实验和临床感染病杂志:电子版,2011,13(2):224-233
[26] Locarnini S.Molecular virology and the development of resistant mutants: implications for therapy[J].Semin Liver Dis,2005,25 (Suppl 1):9-19
[27] Economou M,Manolakopoulos S,Trikalinos TA,et al.Interferon-alpha plus lamivudine vs lamivudine reduces breakthroughs, but does not affect sustained response in HBeAg negative chronic hepatitis B[J].World J Gastroenterol,2005,11(37):5882-5887
[28] Zhang YY,Chen EQ,Yang J,et al.Treatment with lamivudine versus lamivudine and thymosin alpha-1 for e antigen-positive chronic hepatitis B patients:a meta-analysis[J].Virol J,2009,25(6):63
Entecavir versus entecavir-thymosin alpha-1 combination therapy for chronic hepatitis B: a Meta analysis
QU Yachao1, TIAN Zhou1, BAO Xuli1, LYU Yanwei2, LYU Jun1
(1.Beijing Youan Hospital of Capital Medical University, Beijing 100069, China; 2.Beijing Institute of Trauma Department of Orthopedics, Beijing 100035, China)
Objective It is to value the effect of entecavir-thymosin alpha-1 combination therapy for chronic hepatitis B.Methods The papers were searched in the database of the PubMed, Cochrane Library, OVID, SpringerLink, CNKI, the Chinese Biomedical Database (CBM), Wanfangdata and CQVIP according to inclusion criteria and exclusion criteria from 2005 to April 2014.The findings of the selected ten randomized controlled trials (RCT) were analyzed by RevMan 5.2 Software.Results Compared with the control group, the ALT normalization rate, HBV DNA negative rate, HBeAg negative rate and HBeAg seroconversion rate of experimental group were significantly improved: RR were 1.13 [95%CI (1.06, 1.21),Z=3.61,P=0.000 3〗, 1.19 [95%CI (1.09, 1.30),Z=3.83,P=0.000 1], 2.25 [95%CI (1.52,3.33),Z=4.04,P<0.000 1] and 2.31 [95%CI (1.83, 2.92),Z=7.06,P<0.000 01].The injection of thymosin alpha-1 was no significant adverse events.Conclusion Entecavir-thymosin alpha-1 combination therapy is more effective in the HBV DNA reduction, increase of serum HBeAg negative rate, conversion rate and ALT normalization rate and without increasing drug adverse reactions compared with entecavir.More RCTs of high quality and large scale are required to verify this conclusion.
chronic hepatitis B; entecavir; thymosin alpha-1; Meta analysis
渠亚超,女,硕士研究生,主要从事肝病方面的研究。
闾军,E-mail:lujun98@ccmu.edu.cn
北京市卫生系统高层次卫生技术人才培训资助项目(2011-2-20);“十二五”重大科技专项基金资助项目(2014ZX10002002-001-002)
10.3969/j.issn.1008-8849.2015.09.001
R0512.62
A
1008-8849(2015)09-0913-05
2014-08-05
