广西合果木生长及光合特性*
2015-01-17伍荣善覃德文秦武明
伍荣善,覃德文,秦武明
(1.广西国有钦廉林场,广西 柳州535000;2.广西大学林学院,广西 南宁530004)
合果木(Paramichelia baillonii)为木兰科(Magnoliaceae)合果木属(Paramichelia)的常绿阔叶乔木,产于云南 (西双版纳、元江中游、思茅地区)。生于海拔500~1 500 m的山林中。常与龙脑樟树混生,为国家二级重点保护植物[1]。树干通直,生长迅速,能耐短期低温 (-2℃)。材质坚硬,美观,抗虫耐腐力强,为制造高级家具、重要建筑物的上等木材。冯弦[2]等对合果木木材进行测定,发现木材基本密度为0.530 0 g/cm3。合果木树叶翠绿、秀气、卵状椭圆形或披针形,花芳香,黄色,花被片总是18~21片,为名贵稀有观赏树种。该树种适生在肥沃酸性土壤中,抗风力较差,探讨其不同生境下的生长具有重要的科学意义。
国内外对合果木研究较少,多集中于物种的鉴定、病害研究以及植被多样性调查[3],李宗艳[4]等研究表明,大多数木兰科植物在繁殖过程中环境适应性差。Vaidyanathan[5]对100种木兰科植物物种调查,得出绝大多数木兰属植物药用价值高,广泛运用于当地居民生活当中。马小英[6]等对10年生合果木大树光合测定中发现,合果木净光合速率增长缓慢,在高光强下利用水分的能力差,水分需求量大。袁铁象[7]等调查了广西合果木苗木种植数据,总结出合果木种植的适宜密度为2 m×2 m。黄丹[8]在良凤江通过对合果木引种栽培实验,发现5年生合果木胸径可达5.48 cm,35年生林分年总蓄积量达到272.21 ~310.88 m3/hm2。目前对合果木苗木抗旱特性研究尚未见报道。因此,本项目研究合果木苗木不同强度干旱胁迫下光合特性指标和叶绿素荧光参数,对于揭示合果木对干旱的生长环境的适应能力,以及逆境下植物光合能力的响应状况具有重要的科学意义,也为合果木的引种栽培和推广提供参考依据。
1 材料与方法
1.1 试验材料
选用广西南宁市树木园1年生合果木实生苗作为材料,在广西大学林学院苗圃试验大棚内,采用盆栽对苗木进行干旱胁迫试验。用黄心土:细沙为3︰1的混合土作为育苗基质,基质土在装盆前用0.5%的高锰酸钾溶液消毒。
1.2 试验处理
本试验采用TDR土壤水分测定仪 (FS6440,USA)监测试验当中苗木土壤水分含量,以保证苗木土壤固定状态所含水分的数量占土壤饱和状态下的含水量的百分比例,而该试验设置4个水分梯度,分别为:正常供水 (土壤水分含量为最大田间持水量的80%,下同)、轻度干旱胁迫 (65%)、中度干旱胁迫 (35%)、重度干旱胁迫 (15%),分别用CK、P1、P2和P3表示。合果木在广西大学苗圃内进行培育。2013年4月30日,将温室中培育的生长状况良好的具有12~20片叶,地下根系长5 cm,株高为30~35 cm的合果木幼苗移植入苗木盆内。每个处理6盆,3个重复。在此期间进行日常的养护管理。待移植苗木适应了苗木盆生长环境后,于2013年5月10日开始控水,用称重法控制土壤含水量,在各处理期间于每日17:00时用电子天平称重补水,保证土壤内的含水量。
1.3 指标测定
1.3.1 光合生理指标
当各处理的土壤含水量 (土壤含水量达到最大饱和状态,RWC)达到标准后20天时 (2013年5月30日),开始叶片气体交换参数的测定。取各处理叶片3~6片,用精度为0.001的电子天平称其鲜重 (W)。称重后,置于85℃烘箱48 h后,测定叶片干重,计算叶片的相对含水率。运用TYS-A SPAD-502叶绿素测定仪测定不同处理下叶片叶绿素含量。
1.3.2 叶片气体交换参数
干旱处理20天后,于2013年5月30日的9:00~18:00进行气体交换测定,分别选取各处理下的植株顶端完全展开的饱满健康的叶片5片,釆用LI-6400XT光合测定系统 (IRGA,LI-COR,Lincoln,USA)测定合果木的叶片气体交换参数:最大光合速率 (Pmax)、蒸腾速率 (Tr)、胞间CO2浓度 (Ci)、气孔导度 (Gs)、气孔限制值(Ls)。对苗木进行30 min的暗适应,运用FMS-1叶绿素荧光仪测定叶片叶绿素荧光数据 (Fv/Fm、ΦPSII值)[9]。
2 结果与分析
2.1 叶片相对含水量和叶绿素变化
随着干旱胁迫程度加强,合果木叶片的相对含水量均呈下降趋势 (图1),各处理间差异显著(P<0.05)。合果木在P1、P2、P3条件下其叶片相对含水量分别下降了 12.38%、42.78%和49.52%,在干旱胁迫P3条件下,合果木叶片相对含水量只有16.78%,均低于重度胁迫下抗逆性较弱的降香黄檀 (Dalbergia odorifera)幼苗[10]叶片相对含水率,表明合果木叶片水分调节能力较弱,抗逆性较差。除正常供水外,相同土壤干旱胁迫下,合果木叶片保水能力差,下降幅度较大,从而直接影响了其光合作用。
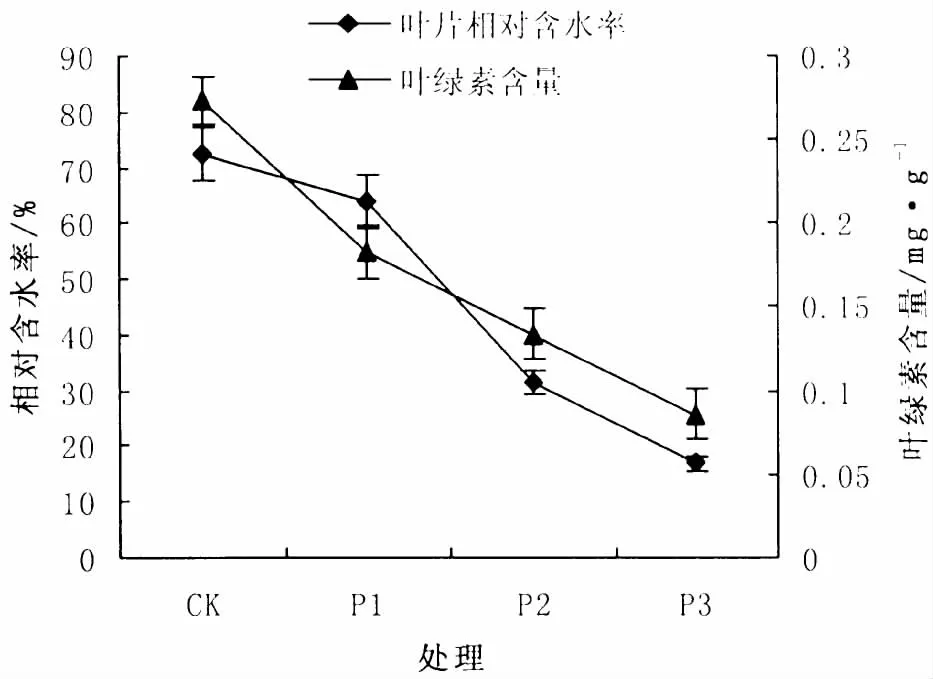
图1 干旱胁迫下合果木叶片相对含水率和叶绿素变化Fig.1 Leaf relative water and chlorophyll in leaves of Paramichelia baillonii by soil drought stress
在土壤干旱胁迫下,合果木叶绿素含量随着土壤含水量的下降而降低 (图1),各组处理间差异显著 (P<0.05)。合果木在P1、P2、P3干旱胁迫下叶绿素含量分别下降了18.88%、27.93%和46.23%。随着干旱胁迫的增强,叶片含水率持续下降,合果木叶绿素含量伴随降低,从而降低了合果木光合作用能力,而在P3处理中叶绿素含量仅为0.086 mg/g,相比干旱20天后耐旱能力较弱的狭叶坡垒 (Hopea chinensis)[11](在重度干旱条件下)叶绿素含量还少了0.18 mg,表明在干旱条件下合果木进行光合作用的场所较小,说明合果木绿素含量的下降会影响其光合能力。
2.2 光响应曲线
合果木的净光合速率响应曲线在光合辐射688 μmolCO2/(m2·s)达到饱和光照强度 (图2)。此时光合速率为最大净光合速率,而合果木随着干旱胁迫程度的加剧,Pn(净光合速率)逐渐下降,受干旱胁迫明显。该树种在P1干旱条件下已与CK存在较大的差异,特别在P3条件下,合果木Pn值降到了1.59 μmolCO2/(m2·s),以光合作用为指标,说明合果木的抗旱能力较差。

图2 干旱胁迫下合果木光响应曲线Fig.2 The light response curves of photosynthesis of Paramichelia baillonii by soil drought stress
2.3 叶片气体交换
合果木的各项光合作用参数对干旱胁迫非常敏感。最大光合速率 (Pmax)、蒸腾速率 (Tr)、胞间CO2浓度 (Ci)、气孔导度 (Gs)、气孔限制值(Ls)均随着干旱程度增强而下降,不同处理间差异显著 (P<0.05)。随着 P1~P3干旱处理的变化,Pmax 值从7.91 μmolCO2/(m2·s)降到1.09 μmolCO2/(m2·s),光合能力逐渐减弱 (表1)。

表1 合果木干旱胁迫的光合速率Tab.1 Photosynthesis of Paramichelia baillonii with different soil drought stress
随着光合作用的显著降低,合果木的蒸腾速率也逐渐下降,在P3干旱胁迫条件下,气孔导度降低,气孔限制值达到了最低,减缓叶片蒸腾速率仅为1.96 umolCO2/(m2·s),植物体表现出对干旱环境的响应。另外,合果木的Gs随着土壤干旱胁迫程度的加剧而显著下降 (P<0.05),在P2和P3干旱胁迫下仅为正常情况下的43.77%和30.47%;合果木Ci随着干旱胁迫程度的加剧呈先下降后上升的趋势,在P2干旱胁迫下Ci值最低为262.36 umolCO2/mol,随后在P3干旱胁迫下Ci缓慢上升,且各处理间Ci值差异显著 (P<0.05)。随着干旱胁迫程度增强,合果木叶片水分利用效率都呈现下降趋势,不同处理下降幅度有一定的差异 (P<0.05)。随着干旱胁迫的发生,叶片水分利用率急剧下降,合果木水分消耗与同化代谢能力持续下降。在P1干旱胁迫条件下,WUE值下降了69.03%。植物水分利用效率作为衡量植物抗性的衡量指标[12],随着干旱强度增强,合果木水分利用效率急剧下降,表明该植物水分利用能力较差,抗旱能力较差。
2.4 光合活性的日变化
经叶绿素荧光测定发现,合果木光合活性(Fv/Fm、ΦPSII)有明显的日变化 (图3~4)。正常浇水的情况下 (CK),Fv/Fm中午强光时降18.65%,意味着强光诱导光抑制发生;干旱胁迫的情况下Fv/Fm均显著下降至接近31.78%,光抑制最明显。在P3条件下,Fv/Fm下降速度最快,总体水平为4个处理最低。P1、P2干旱处理间差异值较小,5:00-10:00时期Fv/Fm下降较慢,1 h内仍维持在起始值的84.67%左右,随后下降加快;处理P3时Fv/Fm始终下降较快。不同干旱处理强度,Fv/Fm均能当日恢复,4个处理间均在10:00-13:00间下降,表明发生的均为动态光抑制。合果木Fv/Fm在经历中午高强光、高温度后的2 h内可恢复至0.65左右。光抑制最严重的P3,Fv/Fm当日也可完全恢复,但所需时间缓慢,比其他干旱处理的延后1 h,发生的光抑制较为严重。
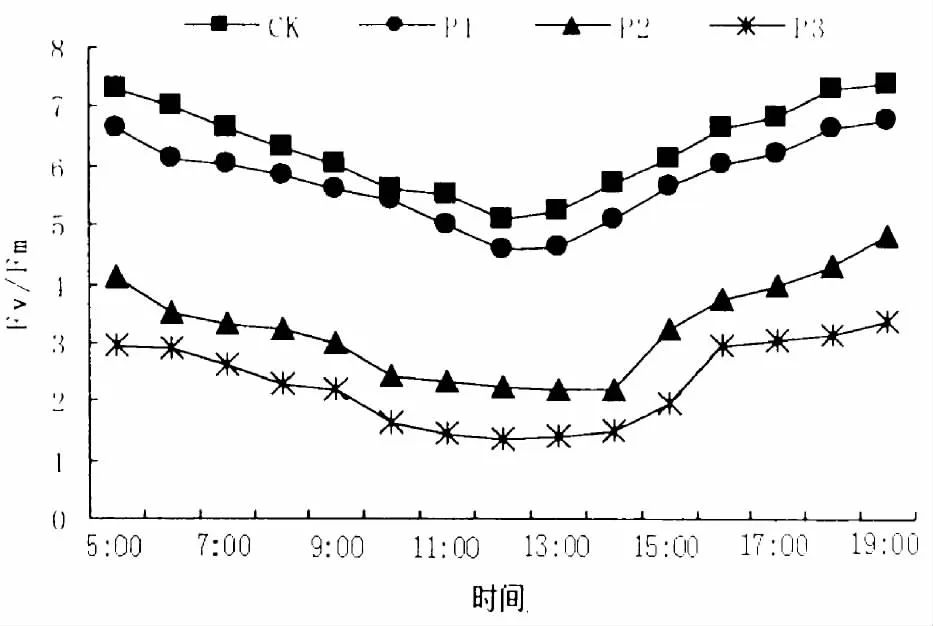
图3 不同干旱胁迫下合果木Fv/Fm日变化Fig.3 Diurnal change of Fv/Fm for Paramichelia baillonii under different soil drought stress
与Fv/Fm相比,ΦPSII下降幅度更大,不同干旱程度条件下也下降80%左右。与P1、P2、P3相比,对照处理 (CK)时ΦPSII下降最快,1 h内降至接近最低水平;P1、P2、P3也有差别,9:00开始,ΦPSII值均达到较低水平,在P3处理下变化最明显。ΦPSII傍晚开始恢复,在P3干旱胁迫下,ΦPSII当日一直下降。在各种干旱胁迫下,ΦPSII均不能当日完全恢复,具有滞后性,但次日6时均能恢复到起始水平,显示合果木在呼吸作用中变现出很强的恢复能力。
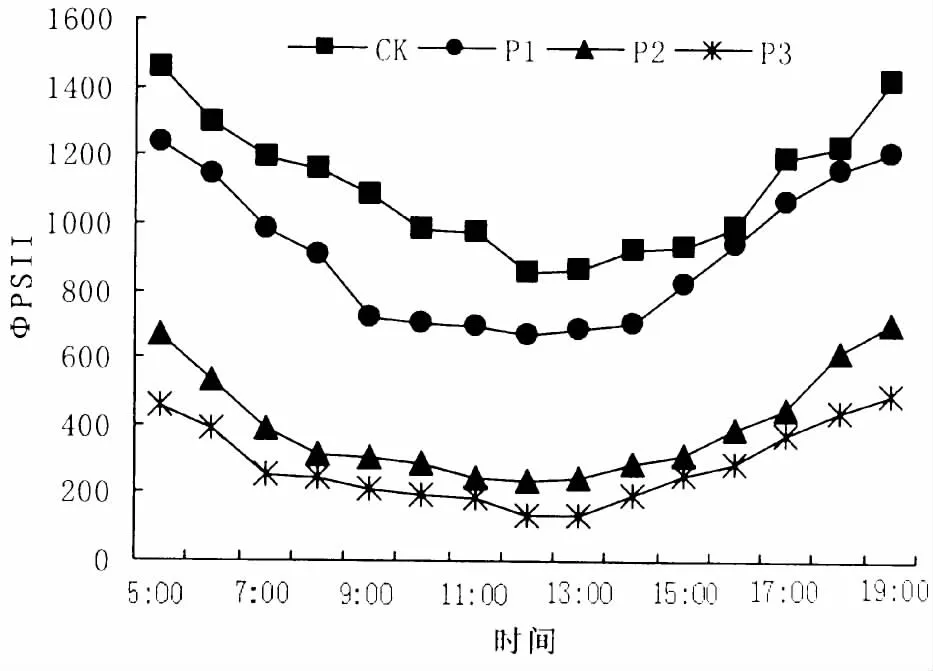
图4 不同干旱胁迫下合果木ΦPSII日变化Fig.4 Diurnal change of ΦPSII for Paramichelia baillonii under different soil drought stress
3 结论与讨论
合果木随着干旱程度的加强,表现出了明显的响应,植物叶片含水率、叶绿素含量降低,迫使叶片光能吸收与转化能力降低,光能不能得到合理的分配和耗失。广大植物在干旱逆境下,均会调节自身光合速率给予响应,维持植物体对能量的使用平衡[13~15]。在干旱胁迫下,合果木光系统Ⅱ (PSII)受影响较为明显,表现为 Pn值降低到了1.58 μmolCO2/(m2·s),与对照试验值相差了 6.37。植物体水分利用效率也不断降低,P2、P3情况下趋于平稳,表现了合果木具有一定抗旱能力。同时,合果木 Pmax在重度干旱情况下为 7.91 μmolCO2/(m2·s),远低于杨树在干旱情况下的光合能力[16]。干旱胁迫的逆境下,影响合果木光合作用,物质流受阻:气孔开度受限直接减少CO2供应[17]。随着干旱程度增强,合果木叶片的气孔导度值也随之降低,气孔导度在P3处理下仅为21.02 μmolCO2/(m2·s),合果木叶片获取 CO2能力降低。同时,随着水分供应不足,植物体获取能量流受阻,通过影响放氧复合体功能、膜结构等功能破坏光系统间电子传递过程[18]。合果木气孔受干旱胁迫影响明显,叶片气孔限制值在P3处理条件下达到了最低2.03%,直接导致胞间CO2浓度下降引起光合速率降低,当P2处理后胞间CO2浓度将稳定于287.93 umolCO2/mol,表明合果木在中度干旱胁迫下,气孔已做出响应,气孔导度下降,直接抑制了光合作用和获取CO2的正常进行。同时,在干旱逆境下合果木的蒸腾速率也不断下降,保持在一个较低水平,以限制植物体内水分的流失。
叶绿素荧光能力作为反映光能吸收、激发能传递和光化学反应等光合作用的原初反应过程,可反映植物体抗逆境光合利用效率[19]。本试验结合合果木叶绿素荧光Fv/Fm、ΦPSII值日变化状况可以得出,干旱胁迫的逆境条件下,非光化学能耗散能力为CK>P1>P2>P3,逆境条件下直接造成合果木叶片光抑制,随着胁迫强度的增加,影响了植株的自我恢复能力,叶绿素荧光Fv/Fm值,反映了合果木的环式电子传递能力,逆境处理条件下,合果木Fv/Fm值均小于0.7,光合作用严重受到影响,但ΦPSII日变化自我恢复缓慢,未能与正常情况下 (CK)迅速恢复,但仍可恢复凌晨ΦPSII值,表明合果木仍具有抗旱能力,维持在逆境情况下较低的光合能力。
合果木作为广西珍贵乡土树种,抗旱能力较弱,但该树种光系统Ⅱ在逆境情况下具有一定的自我修复能力,能够维持在一个较低水平的光合能力。因此,在发展合果木种植过程中,需要保证充足水分,表明该植物适应种植于南亚热带季风带降雨量充足地区。本项研究主要从光合特性对合果木进行抗旱能力的研究,今后可深入对该植物的叶脉结构、植物水利结构和细胞超纤维结构等方面进行研究。
[1]李树刚,韦发南.广西植物志[M].南宁:广西科学技术出版社,2005.
[2]冯弦,陈宏伟,刘永刚,等.山桂花人工林木材基本密度和纤维长度变异规律的研究[J].广西林业科学,2003,32(1):20-23.
[3]曹阳.厚朴伪品含笑的鉴别[J].现代中药研究与实践,2004,18(5):33-34.
[4]李宗艳,郭荣.木莲属濒危植物致濒原因及繁殖生物学研究进展[J].生命科学研究,2014,18(1):90-94.
[5]Vaidyanathan D,Senthilkumar S,Sisubalan N,et al.Studies on ethnomedicinal plants used by Malayali Gounder Tribes in Pachamalai of Eastern ghats,Tamil Nadu,India[J].Advances in Applied Science Research,2014,5(1):244-253.
[6]马小英,焦根林.合果木光合生理特性及水分利用特点的研究[J].安徽农业科学,2008,36(25):10787-10789.
[7]袁铁象,黄应钦.广西主要乡土树种[M].南宁:广西科学技术出版社,2011.
[8]黄丹.合果木在良凤江的引种试验[D].南宁:广西大学,2012.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000.
[10]杨振德,赵岩岩,玉舒中,等.干旱胁迫对降香黄檀幼苗生理特性及根系形态特征的影响[J].林业科技开发,2014,28(3):63-67.
[11]周太久,邓涛,唐文秀,等.狭叶坡垒幼苗对PEG模拟干旱胁迫的生理响应[J].湖北农业科学,2013,52(24):6079-6083.
[12]韩刚,赵忠.不同土壤水分下4种沙生灌木的光合光响应特性[J].生态学报,2010,30(15):4019-4026.
[13]Busch F,Hunter N P A,Ensminger I.Biochemical constrains limit the potential of the photochemical reflectance index as a predictor of effective quantum efficiency of photosynthesis during the winter-spring transition in Jack pine seedlings[J].Functional Plant Biology,2009,36(11):1016-1026.
[14]许鹏波,薛立,潘澜,等.稀土对低温胁迫麻楝幼苗生理生化特性的影响[J].中南林业科技大学学报,2011,31(2):34-40.
[15]姜英,郝海坤,黄志玲,等.红锥苗期生长特性和叶绿素荧光对不同光强的响应[J].中南林业科技大学学报,2013,33(10):61-66.
[16]张守攻,高荣孚,王连军.杂种杨无性系的光系统Ⅱ放氧活性、光合色素及叶绿体超微结构对光胁迫的响应[J].植物生态学报,2004,28(2):143-149.
[17]Williams M.H,Rosenqvist E,Buchhave M.Response of potted miniature roses(Rosaxhybrida)to reduced water availability during production[J].Journal of Horticultural Science and Biotechnology,1999,74:301-308.
[18]Lawlor D.W,Comic G.Photosynthetic carbon assimilation and associated metabolism in relation to water deficits in higher plants[J].Plant,Cell and Environment,2002,25:275-294.
[19]Uehlein N,Otto B,Hanson D T,et al.Function of Nicotiana tabacum aquaporins as chloroplast gas pores challenges the concept of membrane CO2permeability[J].The Plant Cell Online,2008,20(3):648-657.
